Ацетилцистеин

Acetylcysteinum

Получение ацетилцистеина основано на способности аминокислот ацетилироваться по аминогруппе:
Белый или белый со слегка желтоватым оттенком кристаллический порошок со слабым специфическим запахом. Легко растворим в воде и спирте. Практически не растворим в других органических растворителях.
Подлинность:
· реакция с нингидрином имеет отрицательное значение;
· по реакции образования этилацетата: после гидролиза в кислой среде выделяется уксусная кислота, которая в свою очередь вступает в реакцию этерификации с этиловым спиртом:


CH3COOH+C2H5OH CH3 – C – O – C2H5+H2O
· по реакции с раствором FeCl3, появляется быстро исчезающие сине-фиолетовое окрашивание (тиольная группа).
· по реакции с раствором йода:

Количественное определение:
· йодометрическое определение: Препараты серосодержащих аминокислот определяют иодометрическим методом. Вещество окисляют 0,1 моль/л раствором иода. Определение основано на окислении сульфгидрильных групп (см. реакцию с йодом).
· метод Кьельдаля.
Метод основан на минерализации органического вещества и определении продукта минерализации (NH3) кислотно-основным титрованием:
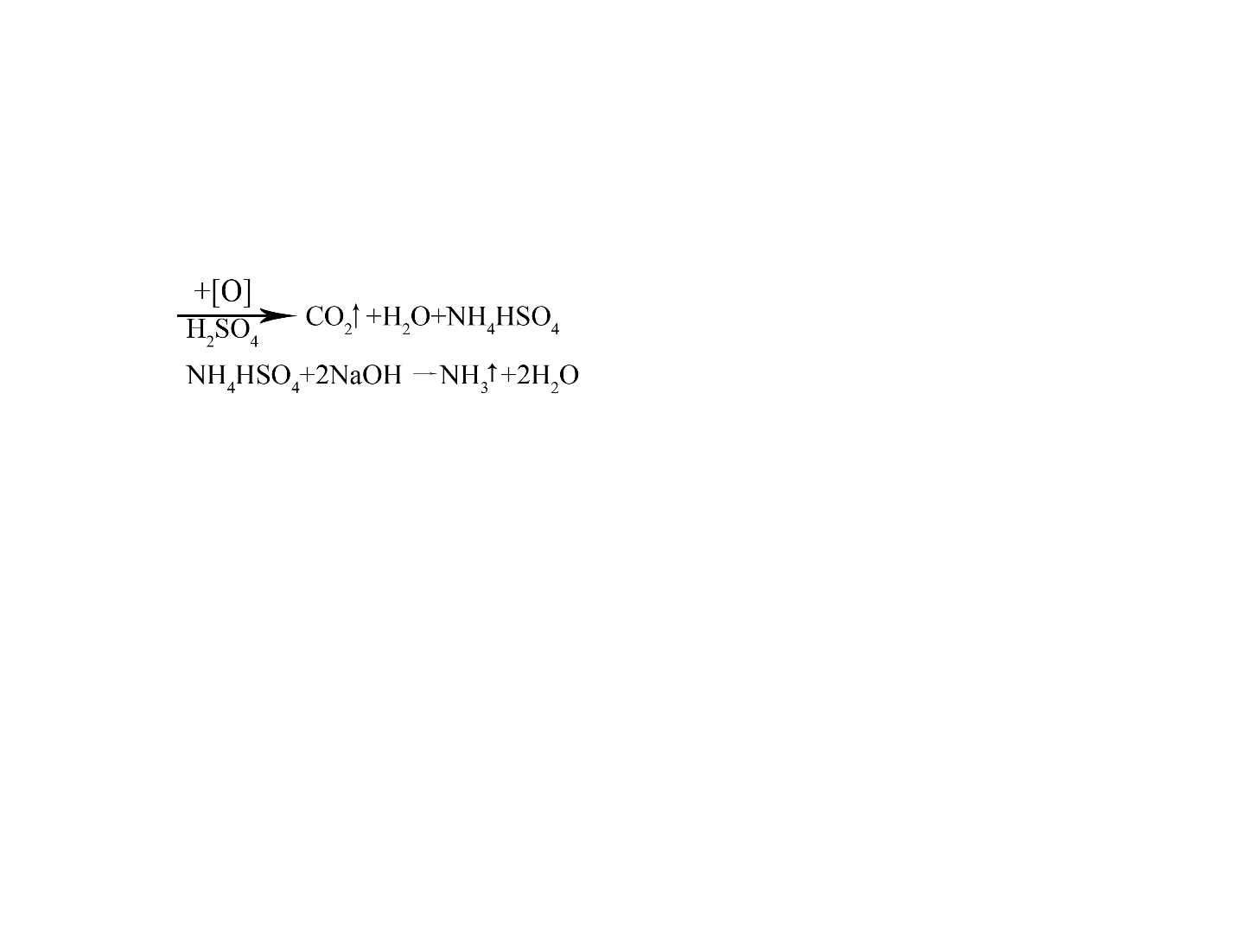 Анализируемое вещество
Анализируемое вещество
(амины, амиды, гетероциклический азот)

Образующийся в результате разложения молекулы аммиак отгоняется в преемник, где содержится борная кислота, образуя с последней два типа солей - метабораты и тетрабораты:
NH3 + Н3ВО3 NH4BO2 + Н2O
2NH3 + 4Н3ВO3 (NH4)2B4O7 + 5Н2O
Затем полученные соли титруют раствором соляной кислоты:
NH4BO2 + НС1 + Н2O NE4CI + Н3ВО3
(NH4)2B407 + 2НС1 + 5Н2O 2NH4C1 + 4Н3В03
Хранят препарат в хорошо укупоренной таре, предохраняющей от действия света, в сухом, прохладном месте, чтобы не допустить разложения. Список Б.
Оказывает муколитическое действие.
Задание 2. Приведите реакции определения подлинности на следующие ионы и функциональные группы (реактив, химизм реакций, условия проведения реакций, внешний аналитический эффект). Приведите 2-3 структурные формулы лекарственных веществ, содержащие указанные группы:
Карбонаты; Амидная группа
Карбонаты.
А. При действии на карбонаты и гидрокарбонаты разведенными кислотами появляются пузырьки диоксида углерода вследствие разложения выделяющейся нестойкой кислоты угольной:
СO2-3 + 2Н+ СO2 + Н2O
НСО-з + Н+ СO2 + H2O
Б. При пропускании выделяющегося диоксида углерода через известковую воду образуется осадок кальция карбоната:
С02 + Са(СО)2 СаСОз + Н2O
В. Отличить карбонаты от гидрокарбонатов можно по реакции среды с использованием индикатора - фенолфталеина. Карбонаты и гидрокарбонаты в растворе подвергаются гидролизу:
СО2-3+ 2Н2O НСО-3 + ОН-
НСО-3 + H2O H2O + CO2 + ОН-
Карбонаты имеют сильно щелочную реакцию среды в отличие от гидрокарбонатов, в которых происходит, помимо гидролиза, и диссоциации НСО3-иона:
HCO-3 CO2-3+H
В связи с этим реакция среды растворов гидрокарбонатов слабощелочная.
Таким образом, растворы карбонатов окрашивают фенолфталеин в розовый цвет, а растворы гидрокарбонатов не окрашивают.
Г. С насыщенным раствором магния сульфата растворы карбонатов образуют белый осадок:
С02-3 + Мg2+ MgCO3

Амидная группа
При нагревании в щелочной среде выделяется аммиак, который обнаруживают по запаху или по посинению красной лакмусовой бумаги:

Задание 3. Химические методы количественного определения. Приведите основные теоретические положения следующего титриметрического метода (индикатор, схема реакции, расчет молярной массы эквивалента) и укажите применение данного метода на примере двух - трех лекарственных веществ.
Кислотно-основное титрование в неводной среде с применением протофильных растворителей
Неводное титрование позволяет количественно определять органические вещества, обладающие слабыми кислотными с Ка<10-8 (барбитураты, сульфаниламидные препараты и др.), слабыми основными свойствами с Ка<10-8 (кофеин, резерпин и др.), солей органических оснований (солей алкалоидов и др.). Этот простой и быстрый метод позволяет с большой точностью определить многие синтетические и природные органические лекарственные вещества, которые при титровании в водных растворах не дают резких конечных точек титрования. Конечная точка титрования чаще всего определяется индикаторным или потенциометрическим способом.
Под влиянием неводных растворителей резко изменяются свойства различных веществ. В зависимости от растворителя одно и то же вещество может быть кислотой, основанием, амфотерным или нейтральным соединением, сильным или слабым электролитом.
Сила кислоты или основания определяется степенью их взаимодействия с растворителем. По характеру участия в кислотно-основном процессе все растворители делятся на две большие группы: алротонные и протолитические.
Протофильные или основные растворители. К ним относятся химические соединения основного характера, которые отличаются ярко выраженным сродством к протону. У основных растворителей акцепторные свойства по отношению к протону преобладают над донорными. К основным растворителям относятся: жидкий аммиак, пиридин, диметилформамид, этилендиамин, диоксан и др. Протофильные растворители усиливают кислотные свойства соединений.
Неводное титрование органических веществ, проявляющих кислые свойства, выполняют обычно, используя протофильные растворители (диметилформамид или его смесь с бензолом, а также этилендиамин, бутиламин, пиридин). Титрантом служит раствор гидроксида натрия в смеси метилового спирта и бензола или раствор метилата натрия (метилата лития). В качестве индикатора применяют тимоловый синий (титруют от желтого до синего окрашивания) или точку эквивалентности определяют потенциометрически.
В таких условиях можно количественно определять фенолы, карбоновые кислоты, аминокислоты, производные бензолсульфониламида, производные барбитуровой кислоты, 4-оксикумарина и др. Выбор растворителя и титранта зависит от степени ионизации титруемого объекта. Более сильные кислоты (барбитал, фенобарбитал, фталилсульфотиазол) титруют в среде диметилформамида раствором натрия гидроксида, а вещества со слабо выраженными кислотными свойствами (метилтиоурацил) - раствором метилата натрия.
Задание 4.
Контроль качества лекарственных веществ физическими, физико-химическими и химическими методами. Приведите основные теоретические положения приведенных ниже показателей, укажите их значение и области применения в фармацевтическом анализе.
Кислотное число
Кислотным числом называют количество миллиграммов едкого кали, необходимое для нейтрализации свободных кислот, содержащихся в 1 г исследуемого вещества.
Определение кислотного числа. Около 10 г (точная навеска) масла, жира, воска или около 1 г (точная навеска) смолы помещают в колбу вместимостью 250 мл и растворяют в 50 мл смеси равных объемов 95 % спирта и эфира, предварительно нейтрализованной по фенолфталеину раствором едкого натра (0,1 моль/л); если необходимо, нагревают с обратным холодильником на водяной бане до полного растворения. Прибавляют 1 мл раствора фенолфталеина и титруют при постоянном помешивании раствором едкого натра (0,1 моль/л) до появления розового окрашивания, не исчезающего в течение 30 с. Для вещества с небольшим кислотным числом (до 1) титрование проводят из микробюретки.
Кислотное число (Кч) вычисляют по формуле:
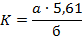
где а - количество миллилитров раствора едкого натра (0,1 моль/л), израсходованное на титрование; б - навеска вещества в граммах; 5,61 - количество миллиграммов едкого кали, соответствующее 1 мл раствора едкого натра (0,1 моль/л).