Для определения качественного химического состава вещества пользуются химическими методами анализа.
В зависимости от состояния вещества различают сухой и мокрый способы проведения качественных реакций. К сухим способам относят:
Ø пробы окрашивания пламени
Ø получение окрашенных стекол или перлов
Ø метод растирания вещества с твердым реактивом
 В практике качественного анализа наибольшее распространение получил «мокрый способ», основанный на реакциях, происходящих в растворах. Для проведения анализа «мокрым способом» вещество переводят в раствор растворением в дистиллированной воде или в минеральных кислотах.
В практике качественного анализа наибольшее распространение получил «мокрый способ», основанный на реакциях, происходящих в растворах. Для проведения анализа «мокрым способом» вещество переводят в раствор растворением в дистиллированной воде или в минеральных кислотах.
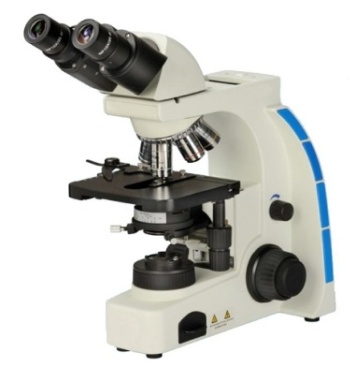 По способу проведения различают пробирочный, капельный, микрокристаллоскопический, хроматографический, экстракционный и другие методы анализа. Пробирочный анализ проводят в пробирках различного размера, капельный анализ на полосках фильтровальной бумаги. Микрокристаллоскопические реакции проводят на предметных стеклах и затем наблюдают под микроскопом форму и размеры получившихся кристаллов.
По способу проведения различают пробирочный, капельный, микрокристаллоскопический, хроматографический, экстракционный и другие методы анализа. Пробирочный анализ проводят в пробирках различного размера, капельный анализ на полосках фильтровальной бумаги. Микрокристаллоскопические реакции проводят на предметных стеклах и затем наблюдают под микроскопом форму и размеры получившихся кристаллов.
 Химические методы основаны на использовании химических реакций определяемого элемента с различными реагентами. В качественном анализе используются аналитические реакции. Аналитическая реакция - это реакция, которая сопровождается каким-либо внешним эффектом – аналитическим сигналом (образованием или растворением осадка, выделением газа, изменением окраски раствора и т.д.), позволяющим сделать вывод о наличии соответствующих ионов в анализируемом веществе. Выполнение каждой аналитической реакции требуют соблюдения определенных условий ее проведения, важнейшими из которых являются:
Химические методы основаны на использовании химических реакций определяемого элемента с различными реагентами. В качественном анализе используются аналитические реакции. Аналитическая реакция - это реакция, которая сопровождается каким-либо внешним эффектом – аналитическим сигналом (образованием или растворением осадка, выделением газа, изменением окраски раствора и т.д.), позволяющим сделать вывод о наличии соответствующих ионов в анализируемом веществе. Выполнение каждой аналитической реакции требуют соблюдения определенных условий ее проведения, важнейшими из которых являются:
Ø концентрация реагирующих веществ
Ø среда раствора
Ø температура
Аналитические реакции делятся на специфические и групповые. Специфическая реакция – это аналитическая реакция, внешний эффект которой характерен только для данного иона. С помощью специфической реакции ион может быть обнаружен в присутствии других ионов.
Групповая реакция – это реакция, внешний эффект которой характерен для группы ионов. С помощью групповых реакций смеси ионов разделяют на аналитические группы.
Реакции, характерные для какого – либо иона, называются частными реакциями этого иона.
Вещества, с помощью которых выполняется открытие ионов, называются реактивами на соответствующие ионы. Реактивы, используемые для выполнения аналитических реакций, делятся на специфические, избирательные, или селективные, и групповые. Специфические реактивы образуют характерный осадок или окрашивание только с определенным ионом. Избирательные, или селективные, реактивы реагируют с несколькими ионами, которые могут принадлежать к одной или к разным группам. Групповой реактив вступает в реакцию со всеми ионами данной группы. С помощью этого реактива ионы данной группы можно отделить от ионов других групп.
 По чистоте химические реактивы классифицируют на технические, чистые (ч.), чистые для анализа (ч.д.а.), химически чистые (х.ч.) и особо чистые (ос. ч.). Количество примесей регламентируется технической документацией: ГОСТ, ТУ, ГФ. Обычно в практике используют реактивы ч. и ч.д.а.
По чистоте химические реактивы классифицируют на технические, чистые (ч.), чистые для анализа (ч.д.а.), химически чистые (х.ч.) и особо чистые (ос. ч.). Количество примесей регламентируется технической документацией: ГОСТ, ТУ, ГФ. Обычно в практике используют реактивы ч. и ч.д.а.
Качественный анализ может быть выполнен дробным или систематическим методом.
Дробный метод анализа заключается в том, что ионы открывают в любой последовательности при помощиспецифических реакций в отдельных пробах раствора в присутствии других ионов.
 Систематический метод качественного анализа заключается в том, что смесь ионов с помощью групповых реагентов предварительно разделяют в определенной последовательности на аналитические группы. Отдельные ионы внутри каждой группы обнаруживаются с помощью их аналитических реакций после разделения или в условиях, устраняющих (маскирующих) влияние других ионов.
Систематический метод качественного анализа заключается в том, что смесь ионов с помощью групповых реагентов предварительно разделяют в определенной последовательности на аналитические группы. Отдельные ионы внутри каждой группы обнаруживаются с помощью их аналитических реакций после разделения или в условиях, устраняющих (маскирующих) влияние других ионов.
Важным условием правильного проведения анализа является чувствительность. Чувствительной называется такая реакция, при помощи которой можно открыть минимальное количество вещества или иона из наименьшего объема раствора. Количественно чувствительность характеризуется тремя взаимосвязанными параметрами:
Ø открываемый минимум
Ø предельной концентрацией Спред или предельным разбавлением V пред
Ø минимальным объемом предельно разбавленного раствора
Открываемый минимум – наименьшая масса вещества, которая может быть обнаружена данной реакцией; выражается в микрограммах. Чем меньше открывается минимум, тем более чувствительна реакция.
Предельной концентрацией открываемого вещества называют отношение одной весовой части (1 г) определяемого вещества или иона к наибольшей массе или объему растворителя; выражается в г/мл и показывает, при какой наименьшей концентрации раствора данная реакция позволяет однозначно открывать исследуемый ион.
Величина, обратная предельной концентрации, называется предельным разбавлением.
Vпр. = 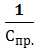
Открываемый минимум, предельная концентрация, минимальный объем и предельное разбавление взаимосвязаны:
m = Cпр.∙ Vmin ∙ 106 (мкг)
или
m = 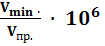 (мкг)
(мкг)
Методы анализа в зависимости от количества исследуемого вещества, объема раствора и техники выполнения классифицируют на макро-, полумикро -, микро-, ультра-, субмикро- и субультрамикрометоды:
| Название | Новое название | г | мл |
| макроанализ полумикроанализ микроанализ ультрамикроанализ субмикроанализ субультрамикроанализ | грамм-метод сантиграмм- метод миллиграмм-метод микрограмм- метод нанограмм- метод пикограмм -метод | 1-10 0,05-0,5 10-6-10-3 10-9-10-6 10-12-10-9 10-12 | 1-100 1-10 10-4-10-1 10-6-10-4 10-10-10-7 10-10 |
 Метод анализа выбирают в зависимости от предполагаемого содержания вещества и от предела обнаружения применяемой реакции. В настоящее время при изучении качественного химического анализа в учебных лабораториях применяется полумикрометод (полумикроанализ). Для работы полумикрометодом в лаборатории необходимо иметь соответствующее оборудование:
Метод анализа выбирают в зависимости от предполагаемого содержания вещества и от предела обнаружения применяемой реакции. В настоящее время при изучении качественного химического анализа в учебных лабораториях применяется полумикрометод (полумикроанализ). Для работы полумикрометодом в лаборатории необходимо иметь соответствующее оборудование:
1. переносной деревянный штатив с набором капельниц с растворами солей, реактивов, кислот и щелочей и баночек с сухими солями
2. штатив для пробирок
3.  металлический штатив с кольцом, фарфоровым треугольником и асбестированной сеткой
металлический штатив с кольцом, фарфоровым треугольником и асбестированной сеткой
4.  держатели для пробирок
держатели для пробирок
5. центрифужные пробирки
6. пробирки цилиндрические
7. капиллярные пипетки
8. стеклянные палочки
9. фарфоровые чашки диаметром 3-5 см
10. промывалка
11. 
 предметные стекла
предметные стекла
12. фарфоровая капельная пластинка
13. предметные стекла с углублениями
14. ершик для мытья посуды
15. водная баня
16. центрифуга
Качественный анализ делится на анализ катионов и анализ анионов.
В основе кислотно-основной классификации катионов лежит их различное отношение к соляной и серной кислотам, к растворам щелочей и аммиака. Катионы делятся на шесть аналитических групп:
| Аналитическая группа | Характеристика групп | Групповой реагент | Характер получаемых соединений | |
| I | K+, Na+, NH4+ | Хлориды, сульфаты и гидроксиды растворимы в воде | Не имеет | Раствор K+, Na+, NH4+ |
| II | Ag+, Pb2+, Hg22+ | Хлориды не растворимы в воде и разбавленных кислотах | Раствор HCl | Осадки AgCl, PbCl2, Hg2Cl2 |
| III | Ba2+, Sr2+, Ca2+ | Сульфаты нерастворимы в воде и кислотах | Раствор H2SO4 | Осадки BaSO4, SrSO4, CaSO4 |
| IV | Al3+,Cr3+, Zn2+, As3+, Sn2+ | Гидроксиды амфотерны, растворимы в избытке щелочи | Избыток раствора NaOH | Раствор AlO2- , CrO2-, ZnO22-, SnO32-, AsO33- |
| V | Mg2+, Mn2+, Fe2+, Fe3+, Bi3+, Sb3+ | Гидроксиды нерастворимы в избытке щелочи | Раствор NaOH | Осадки Mg(OH)2, Mn(OH)2, Fe(OH)2 , Fe(OH)3 , Bi(OH)3, HSbO2 |
| VI | Cu2+, Hg2+, Co2+, Ni2+ | Гидроксиды образуют растворимые аммиакаты | Избыток раствора NH4OH | Раствор [Cu(NH3)4]2+, [Hg(NH3)4]2+, [Co(NH3)6]2+, [Ni(NH3)6]2+ |
Общепринятой классификации анионов не существует. Чаще всего используется классификация анионов по растворимости солей бария и серебра:
| Группа | Анионы | Групповой реагент | Характеристика группы |
| I | SO42-,, SO32-, CO32-, PO43-, SiO32- | Хлорид бария BaCl2 в нейтральном или слабощелочном растворе | Соли бария практически нерастворимы в воде |
| II | Cl-, Br-, I-, S2- | Нитрат серебра AgNO3 в присутствии HNO3 | Соли серебра практически нерастворимы в воде и в разбавленной азотной кислоте |
| III | NO3-, NO2-, CH3COO- | Группового реагента нет | Соли бария и серебра растворимы в воде |