| ОБЩИЙ ОБЗОР СВОЙСТВ МЕТАЛЛОВ Детальное изучение свойств и характеристик материалов, с которыми должен работать ювелир, необходимо для правильной и качественной их обработки. Только тот, кто всесторонне изучил и познал свойства и особенности применяемых материалов, будет в состоянии придать им правильную форму и красивый внешний вид в готовых украшениях. В производстве ювелирных изделий необходимо в первую очередь учитывать физические свойства металлов и сплавов, плотность, температуру плавления, тепловое расширение, теплопроводность, отражательную способность. Знание этих свойств позволяет правильно выбрать термические режимы литья, ковки, прокатки, пайки и других видов горячей обработки металлов. Важное значение при различных методах изготовления металлических деталей ювелирных украшений, оправ драгоценных камней, столовых приборов и посуды из сплавов благородных металлов имеют их основные механические свойства. К ним относятся: прочность, твердость, упругость, пластичность. Эти же свойства имеют первостепенное значение и при использовании ювелирных изделий в качестве украшений и предметов домашнего обихода. Учитывая эксплуатационные требования, предъявляемые к долговечности этих изделий, ювелир может на основе детального знания механических свойств сплавов различной пробы обоснованно подойти к выбору наиболее рациональной в данном случае марки сплава. Не меньшую роль в технологии производства и в процессе потребления ювелирных изделий играют химические свойства как чистых металлов, так и их сплавов: стойкость к воздействию внешней среды—кислот, щелочей, газов, пресной и морской воды, оказывающих большее или меньшее агрессивное действие на металл колец, браслетов, кулонов, цепочек и других ювелирных украшений. И, наконец, особое место в характеристиках материалов занимают технологические свойства. К ним относятся жидкотекучесть, ликвация и усадка металлов при литье, ковкость, свариваемость и обрабатываемость резанием. Знание этих свойств особенно важно при выборе методов и режимов обработки ювелирных изделий. Ознакомление с металлическими материалами начинается с изучения их физико-химических свойств и основных положений металловедения — науки о металлах, знание которых поможет установить, какие многосторонние практические выводы вытекают из этой науки. При этом станет ясным, что многие дефекты, возникающие при обработке металлов на практике из-за недопонимания их внутреннего строения и свойств, могут быть легко предупреждены.
Золото.Химический элемент, символ Аи, имеет порядковый номер 79, атомный вес 197,0, основную валентность III, плотность 19,3 г/см3, температуру плавления 1063° С, температуру кипения 2970° С, твердость по Бринелю в отожженном состоянии 18—20 кгс/мм2. Золото —металл красивого желтого цвета, тонколистовое (сусальное) золото имеет зеленоватый оттенок. Золото с трудом образует химические соединения, оно химически устойчиво на воздухе, в воде и в кислотах, за исключением царской водки (в последней золото растворяется с образованием золотохлористоводородной кислоты Н [AuCl4]). Оно взаимодействует также со свободными ионами хлора, цианидом калия и натрия, бромом и некоторыми другими химикатами, не имеющими применения в производстве ювелирных изделий. Золото имеет высокую отражательную способность и хорошо полируется; оно обладает высокой пластичностью и прокатывается в листы толщиной до 0,0001 мм. Тепло- и электропроводность золота ниже, чем у меди. Удельная теплоемкость его сравнительно невелика. Из-за невысокой твердости и прочности золото используют в ювелирном деле в виде сплавов с другими металлами и в очень редких случаях в чистом виде.
Серебро.Химический элемент, символ Ag, имеет порядковый номер 47, атомный вес 107,88, валентность I, II, плотность 10,5 г/см3, температуру плавления 960,5° С, кипения 2210° С. твердость по Бринелю в отожженном состоянии 25 кгс/мм2. Серебро — металл белого цвета, практически не изменяю щийся под действием кислорода воздуха при комнатной темпера туре, однако из-за наличия в воздухе сероводорода со временем покрывается темным налетом сульфида серебра Ag2S. Серебро устойчиво в воде, но растворяется в азотной и горячей концентрированной серной кислоте. С царской водкой оно образует нерастворимый хлорид серебра AgCl. Как и золото, серебро взаимодействует со щелочными растворами цианидов. Серебро хорошо полируется, имеет высокую отражательную способность; оно обладает хорошей ковкостью и самой высокой из всех металлов тепло- и электропроводностью. Чтобы повысить тведрость и прочность серебра, его используют в сплавах с другими металлами. При изготовлении ювелирных украшений серебро в чистом виде применяют сравнительно редко.
Платина.Химический элемент, символ Pt, имеет порядковый номер 78, атомный вес 195,23, валентность II, IV, плотность 21,45 г/см3, температуру плавления 1773,5° С, температуру кипения 4410° С, твердость по Бринелю в отожженном состоянии около 50 кгс/мм2. Металл имеет бело-серую окраску, схожую по цвету со сталью, и практически нерастворим ни в воде, ни в кислотах, за исключением горячей царской водки, при взаимодействии с которой образуется платино-хлористоводородная кислота Н2 [PtCl2]. Платина весьма пластична, хорошо полируется и обладает большой отражательной способностью. Наряду с палладием и иридием она имеет очень низкую тепло- и электропроводность, низкую удельную теплоемкость и с трудом вступает в химические соединения. Платина в чистом виде очень мягка, поэтому ее легируют иридием, родием и другими металлами. Для изготовления ювелирных изделий в сплав, кроме этих компонентов, добавляют еще и медь.
Металлы платиновой группы (иридий, палладий, родий) в химическом отношении настолько схожи с платиной, что разделение их затруднительно.
Иридий.Химический элемент, символ Ir, имеет порядковый номер 77, атомный вес 193,1, основную валентность III, плотность 22,5 г/см3, температуру плавления 2454° С, температуру кипения 5300° С, твердость по Бринелю в отожженном состоянии 172 кгс/мм2. Из-за большой твердости и высокой температуры плавления иридий с трудом поддается обработке. Относительное удлинение при растяжении составляет лишь 2%. При высоких температурах металл можно обрабатывать давлением. При небольшой добавке иридия к платине значительно повышается ее твердость. Палладий.Химический элемент, символ Pd, имеет порядковый номер 46, атомный вес 106,4, основную валентность II, плотность 12,0 г/см3, температуру плавления 1554,5° С, температуру кипения 4000° С, твердость по Бринелю в отожженном состоянии 52 кгс/мм2. Палладий имеет более светлую окраску, чем платина, он химически устойчив на воздухе и в воде, растворяется в горячей, слегка разбавленной азотной кислоте с образованием нитрата палладия Pd (NO3)2. При температурах от 400 до 850° С палладий покрывается светло-фиолетовым окисньда слоем, который исчезает при более высоких температурах. Благодаря хорошей обрабатываемости, низкой температуре плавления и относительной дешевизне, он чаще других металлов платиновой группы используется в ювелирных изделиях. Как легирующий металл, палладий улучшает свойства платины, осветляет ее окраску, а также способствует отбеливанию сплава при получении так называемого белого золота. Родий.Химический элемент, символ Rh, имеет порядковый номер 45, атомный вес 102,91, основную валентность III, плотность 12,4 г/см3, температуру плавления 1966° С, температуру кипения 4500° С, твердость по Бринелю 101 кгс/мм3. По цвету родий сходен с платиной, не вступает во взаимодействие с кипящими кислотами и смесями кислот, но растворяется в щелочных растворах цианидов; абсолютно не окисляется на воздухе и в воде, хорошо поддается горячей обработке давлением.
Ртуть.Химический элемент, символ Hg, имеет порядковый номер 80, атомный вес 200,61, валентность I, II, плотность 13,55 г/см3, температуру плавления 38,83° С, температуру кипения 356,95° С. Ртуть—металл светло-серебристого цвета, находящийся в жидком состоянии при нормальной температуре, стойкий на воздухе и обладающий сильным блеском. При нагревании металла образуется окись ртути, диссоциирующая при температуре свыше 400° С. Так как ртуть при комнатной температуре выделяет ядовитые пары, то хранить ее необходимо только в закрытых емкостях. Ртуть взаимодействует со слабо разбавленной азотной кислотой с образованием нитрата HgNO3 и с концентрированной серной кислотой с образованием сульфата Hg2SO4. С соляной кислотой ртуть не взаимодействует. Для повышения температуры плавления в нее добавляют золото, серебро и другие металлы. Полученные таким образом амальгамы при комнатной температуре тверды. Ювелиры используют ртуть для получения золотой и серебряной амальгам при горячем золочении и серебрении.
Медь.Химический элемент, символ Cu, имеет порядковый номер 29, атомный вес 63,54, основную валентность II, плотность 8,9 г/см3, температуру плавления 1083° С, температуру кипения 2600° С, твердость по Бринелю в отожженном состоянии 35 кгс/мм2. Медь — единственный металл, имеющий красноватый цвет. На воздухе, в присутствии углекислого газа, она покрывается пленкой зеленого цвета (патиной), гидроокисным карбонатом меди CuCOg X Cu (OH)2. При нагреве на поверхности металла образуется черный налет окиси меди СиО. Медь растворяется: в азотной кислоте, образуя нитрат Си (NO3)2; в серной кислоте, образуя сульфат CuSO4; в разбавленной соляной кислоте, образуя хлорид меди СиС12, а при взаимодействии ее с уксусной кислотой образуется основной ацетат меди — ядовитая ярь-медянка. Медь прекрасно обрабатывается давлением и обладает хорошим блеском и высокой полируемостью, однако блеск ее довольно быстро исчезает. Медь — лучший проводник тепла и электрического тока после серебра и имеет очень высокую удельную теплоемкость. Чистая медь редко применяется для изготовления украшений, но иногда находит применение при изготовлении шаблонов и опытных образцов изделий. Медь часто используется и как присадочный материал. Латунь. Технические сплавы меди с цинком желтого цвета, содержащие свыше 50% Си, называются латунями. Сложные легированные латуни содержат кроме цинка и другие элементы — свинец, олово, алюминий, марганец, никель. В ювелирном деле латуни, обладающие высокой пластичностью, используют при изготовлении посуды и украшений. Латунь, содержащая 10% цинка, известна под названием «томпак». Она имеет желтоватый цвет и по свойствам близка к меди. «Томпак» используют для изготовления ювелирных изделий с последующим нанесением на них защитных покрытий. Бронза. В ювелирной промышленности используются оловянные бронзы (сплавы системы медь—олово), благодаря их высоким литейным свойствам (жидкотекучести, малой усадке), а также прочности, стойкости против коррозии и красивому желтоватому цвету. Наибольшее распространение имеют сплавы меди с содержанием 5—10% олова. Сплав с 5% олова называется монетной или медальной бронзой, сплав с 10% олова — пушечной бронзой (из него раньше отливались пушки). Нейзильбер. Сплав на основе меди, содержащий 13,5—16,5% никеля и 18—20% цинка. Сплав имеет высокую твердость, упругость и хорошую коррозионную стойкость. В ювелирном деле используется для изготовления игл, булавок, пружин и посеребрённых столовых приборов.
Цинк.Химический элемент, символ Zn, имеет порядковый номер 30, атомный вес 65,38, валентность II, плотность 7,13 г/см3, температуру плавления 419,46° С, температуру кипения 906° С, твердость по Бринелю 30—35 кгс/мм2. Цинк — металл голубовато-белого цвета, медленно покрывающийся на воздухе плотным серым защитным слоем, состоящим из карбоната цинка ZnCO3 и окиси цинка ZnO, вследствие чего блеск металла исчезает. При нагреве на воздухе цинк сгорая превращается в белый порошок — окись цинка ZnO, светящийся в темноте зеленоватым светом. При комнатной температуре он довольно хрупок; при температурах ПО—150° С хорошо поддается обработке давлением, а при температуре выше 200° С становится настолько хрупким, что его можно распылять. Цинк хорошо растворяется в разбавленных кислотах. Он используется в качестве присадки в сплавах благородных металлов.
Кадмий.Химический элемент, символ Cd, имеет порядковый номер 48, атомный вес 112,41; валентность II, плотность8,65 г/см3, температуру плавления 320,9° С, температуру кипения 765° С, твердость по Бринелю 16 кгс/мм2. Кадмий — металл белого цвета, по своим свойствам сходный с цинком. На воздухе покрывается защитной окисной пленкой серого цвета, поэтому полированная блестящая поверхность его быстро тускнеет. Сгорая, кадмий превращается в порошок коричневого цвета — окись кадмия CdO. Пластичность металла хорошая. Добавка кадмия снижает температуру плавления твердых припоев при введении его в сплавы серебро—медь их пластичность повышается.
Олово.Химический элемент, символ Sn, имеет порядковый номер 50, атомный вес 118,7, валентность II, IV, плотность 7,298 г/см3, температуру плавления 213,9° С, температуру кипения 2362° С, твердость по Бринелю 5 кгс/мм2. Олово имеет серебристо-белый цвет и обладает хорошей пластичностью, на воздухе постепенно покрывается защитным окисным слоем. При сгорании образуется белый порошок — окись олова SnO2, используемый в качестве полирующего средства. При температуре ниже 13,5° С происходит аллотропическое превращение Snb —» Sna, в результате чего металл превращается в серый порошок («оловянная чума»). Растворяясь в соляной кислоте, олово образует хлорид SnCl2; при взаимодействии его с концентрированной азотной кислотой образуется оловянная кислота H2Sn03 — серый порошок, растворимый в разведенной азотной кислоте. Олово является важнейшим составным компонентом мягких легкоплавких припоев.
Свинец.Химический элемент, символ РЬ, имеет порядковый номер 82, атомный вес 207,21, основную валентность II, плотность 11,34 г/см3, температуру плавления 327,4° С, температуру кипения 1740° С, твердость по Бринелю 4 кгс/мм2. Свинец имеет голубовато-белую окраску, на воздухе покрывается тускло-серым налетом окиси свинца РЬО. В воде на его поверхности образуется толстый слой, состоящий из карбоната свинца РbСО3 и сульфата свинца PbSO4, который защищает металл от дальнейшей коррозии. Окисный слой свинца стоек также в серной и соляной кислотах. Свинец растворяется только в азотной кислоте с образованием нитрата Pb (NO3)2, а также вступает в реакцию со слабой уксусной кислотой. Свинец — мягкий и высокопластичный металл. Пары свинца и его сплавов ядовиты и могут привести к параличу дыхательных путей. Ювелиры используют свинец для купелирования и как присадку для получения мягких припоев.
Железо.Химический элемент, символ Fe, имеет порядковый номер 26, атомный вес 55,85, валентность II, III, плотность 7,87 г/см3, температуру плавления 1539° С, температуру кипения 2740° С, твердость по Бринелю 60 кгс/мм3.
Железо имеет голубовато-белый цвет и на сухом воздухе довольно устойчиво. Однако из-за наличия во влажном воздухе паров воды и кислорода железо покрывается коричневым слоем ржавчины, состоящим из водосодержащего окисла железа Fe (ОН)3-2Fe2O3. Вследствие пористой структуры этого слоя процесс коррозии продолжается до тех пор, пока весь металл не превратится в ржавчину. Коррозия происходит и в воде, содержащей кислород. При нагреве металла на воздухе свыше 650° С образуется хрупкий черный слой окиси железа, так называемой окалины Fe3O4. Железо растворяется в соляной кислоте до хлорида FeCl2; в концентрированной серной и азотной кислотах оно покрывается защитным слоем, который предохраняет его от дальнейшего разъедания. Вследствие высокой температуры плавления и легкой окисляемости железо редко используется в ювелирном деле. Чугун. Сплавы железа с углеродом, содержащие свыше 2% С, а также примеси кремния, марганца, фосфора и серы относятся к чугунам. Чугун является продуктом доменного металлургического процесса. Во время плавки восстановленное из руды железо насыщается углеродом и другими примесями, сопутствующими руде, топливу и флюсам, что отражается на его свойствах. При содержании в чугуне от 3,0 до 5,0% углерода повышается его твердость и прочность, но уменьшается пластичность и снижается температура плавления; повышение содержания кремния от 0,3 до 2,5% благоприятствует графитизации и улучшению литейных свойств чугуна; присутствие 0,5—6% марганца способствует образованию карбида железа, повышению твердости и прочности чугуна; примесь 0,08—2,2% фосфора делает его жидкотекучим, твердым и хрупким, а вредная примесь 0,03—0,12% серы способствует ухудшению жидкотекучести чугуна и появлению красноломкости. Серый чугун, в котором углерод выделяется в виде пластинчатых включений графита, получают при медленном охлаждении. Этому процессу способствует наличие кремния. Поверхность излома выглядит мелкозернистой и имеет серый цвет. Серый чугун мягок и хрупок, он является исходным продуктом для получения чугунного литья. Если углерод в чугуне находится в связанном состоянии в виде карбида железа Fe3C, то такой чугун называется белым. Поверхность излома белого чугуна блестящая, белого цвета. Белый чугун тверд и хрупок, он является исходным продуктом для получения стали. Сталь. Углеродистая сталь содержит железо, углерод и сопутствующие примеси, но в меньших количествах, чем чугун. С увеличением содержания углерода повышаются твердость, прочность, сопротивление деформации и уменьшаются пластичность, свариваемость, вязкость, ухудшаются литейные свойства. Строительные и конструкционные малоуглеродистые стали содержат от 0,05 до 0,25% углерода, они хорошо куются, штампуются и свариваются. Изделия из этих сталей обычно не подвергаются закалке. Конструкционные (машиноподелочные) стали, содержащие от 0,25 до 0,7% углерода обладают высокой прочностью и поддаются закалке, также как и инструментальные углеродистые стали, содержащие от 0,7 до 1,5% углерода. Легированная сталь содержит железо, углерод, сопутствующие примеси и те или иные легирующие элементы: Cr, Ni, Si, Mn, W, Ti и др. При содержании в ней от 0,5 до 3% кремния повышаются прочность, твердость, упругость и уменьшается пластичность стали. Присутствие от 0,8 до 14% марганца повышает прокаливаемость, вязкость и износостойкость, но уменьшает упругость стали; наличие от 0,2 до 30% хрома повышает твердость, прочность, жаропрочность и коррозионную стойкость стали, но ухудшает ее обрабатываемость резанием; при добавлении от 0,2 до 10% молибдена повышаются прочность и коррозионная стойкость, но уменьшаются упругие свойства и ковкость стали, а также ухудшаются ее пластичность; прибавление от 0,25 до 36% никеля повышает вязкость металла; наличие 0,05—4% ванадия повышает прочность стали, ударную вязкость и стойкость к динамическим нагрузкам; присадка 0,5—25% вольфрама повышает твердость, вязкость и усилия, затрачиваемые на резание металла.
|
ОБЩИЕ СВЕДЕНИЯ О ПРОЦЕССАХ И РАБОЧИЙ ИНСТРУМЕНТ От кузнечной обработки выколотка отличается тем, что она выполняется на листовом материале. Если при ковке изменяют поперечное сечение заготовки, то при выколотке получают полые изделия из листа. Выколотка — прием холодной обработки металла, производимый непосредственными ударами молотка. Понятие «чеканка» является широким. Под чеканкой в ювелирном деле понимают сегодня главным образом чеканку выколоткой, а именно, изготовление мелких детальных форм на листовом материале. Первоначально понятие чеканки ограничивалось обработкой массивных литых предметов, например, скульптур посредством зубил и чеканов. Чеканкой называют также получение рельефа штампами на монетах, медалях и т. п. предметах. Четкое разграничение между этими методами обработки металла дать невозможно, так как некоторые выколоточные операции производятся так же, как и чеканочные на мастике (китте) с помощью чеканов и чеканочных молотков, а фасонные чеканы часто используются для обработки массивных изделий. Инструмент для выколотки и чеканки. Молотки.При выколотке необходим молоток с нижним плоским бойком, рабочая поверхность которого должна быть слегка выпуклой. Второй — клиновидный боек должен быть закруглен и не иметь острых кромок. Кроме того, в соответствии с технологией для работы необходимы молотки с плоскими, выпуклыми и шаровидными бойками. Все эти молотки должны быть изготовлены из высококачественной стали. Рабочая поверхность бойков требует тщательного ухода, ибо каждая неровность на ней отпечатывается на обрабатываемом материале. Качество чеканочного молотка оказывает большое влияние на результаты работы. Нижний боек его, наносящий удары по чекану, должен быть плоским, а верхний — шаровидным, Для выбивки крупных выпуклостей в листе. Рабочая поверхность нижнего бойка-должна иметь минимальный диаметр.  Расходники или обводные чеканы. Эти чеканы представляют собой несколько утолщенный в средней части и утоненный к концам Расходники или обводные чеканы. Эти чеканы представляют собой несколько утолщенный в средней части и утоненный к концам  стержень. Рабочая поверхность (боек) чекана выполняется в виде острого или слегка скругленного клина (рис. a). Для чеканки изогнутых линий применяются чеканы со слегка искривленной рабочей поверхностью (рис. б). Эту группу чеканов применяют для воспроизведения общего очертания рисунка или, например, рисунка шрифта, сходного с тем, который получают гравированием. Порушники и бобошники. Эти чеканы применяются для выбивания выпуклостей требуемой формы. Они имеют полушаровую головку или продолговатый, овальный боек (рис. в, г, д). Лощатники. Это довольно обширная группа чеканов с плоским бойком, применяемых для выравнивания и сглаживания поверхностей (рис. е). Бойки могут иметь различную форму, отвечающую обрабатываемой поверхности: квадратную, круглую, овальную, треугольную, прямоугольную, пятиугольную и т. д. Для этих чеканов особенно важно, чтобы их грани не были острыми, а слегка скругленными, иначе на рабочем материале могут остаться вмятины. Рифленые или матовые чеканы. Этот вид чеканов напоминает по форме лощатники, но рабочая поверхность у них не гладкая, а рифленая (рис. ж). Применяют такие чеканы для получения матовой поверхности и фона вокруг контурных рисунков. На лицевой поверхности бойка чекана гравируют насечку перекрещивающимися штрихами. Ее можно сделать также вбиванием в рабочую поверхность отожженного чекана старого напильника. После нанесения насечки производится закалка и отпуск бойка. Сечки. Это чеканы (рис. з), имеющие форму односторонне заточенного плоского зубила. Они применяются для выбивания тонкого линейного рисунка и для одностороннего ступенчатого смещения металла вниз. Фигурные (узорные) чеканы. В этом понятии объединены все те формы чеканов (рис. и, к, л, м), которые в меньшей мере служат в качестве вспомогательных средств при создании контура рисунка; они применяются для отделки орнамента. На рабочей части чекана имеется определенный рисунок. Чеканом, как пуансоном листового штампа, выбивают этот рисунок на изделии. Посредством периодических разряжений или сгущений ударов фигурным чеканом образуются привлекательные и более выразительные линии и поверхности.
ПРОЦЕСС ФОРМООБРАЗОВАНИЯ ПРИ ВЫКОЛОТКЕ И ЧЕКАНКЕ При выколотке и чеканке, так же как и при вальцовке, ковке и гибке, металл испытывает пластическую деформацию. Общие черты процесса деформации, на основе которого ежит изменение строения атомной решетки и структуры кристалита, имеют место и здесь. Особенно важно различать общую формацию всей заготовки и частичную деформац и ю, т. е. деформацию определенных участков заготовки при выколотке. Если, например, в листовой заготовке, укрепленной на мастичной подкладке, выбивают полукруглую выпуклость, то при этом протекают следующие процессы (см. рис. а): чекан с шаровой головкой ударом молотка вколачивается в лист, и в металле сначала образуется знакомое еще по ковке небольшое углубление. Подкладка при этом оказывает лишь слабое сопротивление в противоположность стальной наковальне, которая оказывает весьма сильное противодействие удару. В результате лист под воздействием чекана вдавливается в мастичную подкладку, а кристаллиты металла пластически деформируются. Поверхность листа в месте чеканки увеличивается за счет уменьшения толщины листа: чем глубже проникает чекан, тем больше становится сферическая поверхность и тем меньше делается толщина листа. В большинстве случаев наибольшему напряжению подвергаются те области, которые первыми были охвачены деформацией, в нашем примере — вершина выпуклости. Здесь в стержень. Рабочая поверхность (боек) чекана выполняется в виде острого или слегка скругленного клина (рис. a). Для чеканки изогнутых линий применяются чеканы со слегка искривленной рабочей поверхностью (рис. б). Эту группу чеканов применяют для воспроизведения общего очертания рисунка или, например, рисунка шрифта, сходного с тем, который получают гравированием. Порушники и бобошники. Эти чеканы применяются для выбивания выпуклостей требуемой формы. Они имеют полушаровую головку или продолговатый, овальный боек (рис. в, г, д). Лощатники. Это довольно обширная группа чеканов с плоским бойком, применяемых для выравнивания и сглаживания поверхностей (рис. е). Бойки могут иметь различную форму, отвечающую обрабатываемой поверхности: квадратную, круглую, овальную, треугольную, прямоугольную, пятиугольную и т. д. Для этих чеканов особенно важно, чтобы их грани не были острыми, а слегка скругленными, иначе на рабочем материале могут остаться вмятины. Рифленые или матовые чеканы. Этот вид чеканов напоминает по форме лощатники, но рабочая поверхность у них не гладкая, а рифленая (рис. ж). Применяют такие чеканы для получения матовой поверхности и фона вокруг контурных рисунков. На лицевой поверхности бойка чекана гравируют насечку перекрещивающимися штрихами. Ее можно сделать также вбиванием в рабочую поверхность отожженного чекана старого напильника. После нанесения насечки производится закалка и отпуск бойка. Сечки. Это чеканы (рис. з), имеющие форму односторонне заточенного плоского зубила. Они применяются для выбивания тонкого линейного рисунка и для одностороннего ступенчатого смещения металла вниз. Фигурные (узорные) чеканы. В этом понятии объединены все те формы чеканов (рис. и, к, л, м), которые в меньшей мере служат в качестве вспомогательных средств при создании контура рисунка; они применяются для отделки орнамента. На рабочей части чекана имеется определенный рисунок. Чеканом, как пуансоном листового штампа, выбивают этот рисунок на изделии. Посредством периодических разряжений или сгущений ударов фигурным чеканом образуются привлекательные и более выразительные линии и поверхности.
ПРОЦЕСС ФОРМООБРАЗОВАНИЯ ПРИ ВЫКОЛОТКЕ И ЧЕКАНКЕ При выколотке и чеканке, так же как и при вальцовке, ковке и гибке, металл испытывает пластическую деформацию. Общие черты процесса деформации, на основе которого ежит изменение строения атомной решетки и структуры кристалита, имеют место и здесь. Особенно важно различать общую формацию всей заготовки и частичную деформац и ю, т. е. деформацию определенных участков заготовки при выколотке. Если, например, в листовой заготовке, укрепленной на мастичной подкладке, выбивают полукруглую выпуклость, то при этом протекают следующие процессы (см. рис. а): чекан с шаровой головкой ударом молотка вколачивается в лист, и в металле сначала образуется знакомое еще по ковке небольшое углубление. Подкладка при этом оказывает лишь слабое сопротивление в противоположность стальной наковальне, которая оказывает весьма сильное противодействие удару. В результате лист под воздействием чекана вдавливается в мастичную подкладку, а кристаллиты металла пластически деформируются. Поверхность листа в месте чеканки увеличивается за счет уменьшения толщины листа: чем глубже проникает чекан, тем больше становится сферическая поверхность и тем меньше делается толщина листа. В большинстве случаев наибольшему напряжению подвергаются те области, которые первыми были охвачены деформацией, в нашем примере — вершина выпуклости. Здесь в  первую очередь может быть достигнут предел прочности, и при продолжении деформации возможен разрыв листа. При отжиге возникнут различные рекристаллизованные структуры: только в максимально деформированном участке листа получится мелкое зерно, в остальных частях листа кристаллиты будут более крупными. Несколько другая картина наблюдается в том случае, если вырезанную в виде кружка заготовку нужно прочеканить до полусферы в углублении анки (рис. б). В этом случае, испытывая давление чекана, материал бляшки поддается ему в первую очередь в краевых зонах. Здесь частицы металла сдвигаясь сближаются, подвергаясь сжатию. Чем дальше продвигается процесс первую очередь может быть достигнут предел прочности, и при продолжении деформации возможен разрыв листа. При отжиге возникнут различные рекристаллизованные структуры: только в максимально деформированном участке листа получится мелкое зерно, в остальных частях листа кристаллиты будут более крупными. Несколько другая картина наблюдается в том случае, если вырезанную в виде кружка заготовку нужно прочеканить до полусферы в углублении анки (рис. б). В этом случае, испытывая давление чекана, материал бляшки поддается ему в первую очередь в краевых зонах. Здесь частицы металла сдвигаясь сближаются, подвергаясь сжатию. Чем дальше продвигается процесс 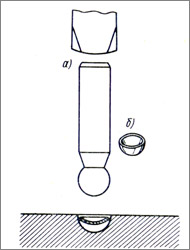 деформации, тем шире становится область заготовки, охваченная сжатием и тем значительнее должны сближаться кристаллиты краевой (наружной) зоны. Такой вид напряженно-деформированного состояния приводит в результате к увеличению толщины материала в наружной области бляшки, где в первую очередь началась деформация. Помимо этого наружная зона подвергается действию максимальных напряжений, величинакоторых, так же как и степень деформации, постепенно уменьшается к центру заготовки. Посредине кружка сохраняются первоначальная структура и толщина материала. ПРИМЕРЫЮВЕЛИРНЫХ ВЫКОЛОТОЧНЫХ РАБОТ Полусферическую заготовку изготавливают в углублении анки чеканом с шаровой головкой. Для придания вырезанной бляшке предварительной выпуклой формы, ее укладывают сначала в большую лунку чашеобразной формы и наносят удары сферическим чеканом, диаметр которого несколько меньше диаметра лунки (рис. а). Потом переходят к лунке с меньшим диаметром и процесс этот повторяют до тех пор, пока не будет получена желаемая выпуклость (рис. б). Если чекан слишком велик, то его поверхность разбивается о края лунки, если же он слишком мал, то заготовка получится неравномерно выпуклой. Другую, неполушаровую форму изделия можно получить свободной выколоткой, обрабатывая заготовку. Для получения чашечки слегка выпуклой формы заготовку помещают на металлический брусок и проковывают разгоночным молотком от центра наружу по спирали, уменьшая при этом силу удара к краям и совершенно не трогая внешний край. Этот процесс можно также осуществить равномерными ударами на деревянном основании с лункой. Последним способом пользуются в тех случаях, когда желательно избежать появления следов обработки на поверхности изделия. Небольшое скругление внешнего края достигается обстукиванием молотком по сферическому чекану соответствующего размера. Заготовкой для получения вогнутого сводчатого обручального кольца служит плоский обод. деформации, тем шире становится область заготовки, охваченная сжатием и тем значительнее должны сближаться кристаллиты краевой (наружной) зоны. Такой вид напряженно-деформированного состояния приводит в результате к увеличению толщины материала в наружной области бляшки, где в первую очередь началась деформация. Помимо этого наружная зона подвергается действию максимальных напряжений, величинакоторых, так же как и степень деформации, постепенно уменьшается к центру заготовки. Посредине кружка сохраняются первоначальная структура и толщина материала. ПРИМЕРЫЮВЕЛИРНЫХ ВЫКОЛОТОЧНЫХ РАБОТ Полусферическую заготовку изготавливают в углублении анки чеканом с шаровой головкой. Для придания вырезанной бляшке предварительной выпуклой формы, ее укладывают сначала в большую лунку чашеобразной формы и наносят удары сферическим чеканом, диаметр которого несколько меньше диаметра лунки (рис. а). Потом переходят к лунке с меньшим диаметром и процесс этот повторяют до тех пор, пока не будет получена желаемая выпуклость (рис. б). Если чекан слишком велик, то его поверхность разбивается о края лунки, если же он слишком мал, то заготовка получится неравномерно выпуклой. Другую, неполушаровую форму изделия можно получить свободной выколоткой, обрабатывая заготовку. Для получения чашечки слегка выпуклой формы заготовку помещают на металлический брусок и проковывают разгоночным молотком от центра наружу по спирали, уменьшая при этом силу удара к краям и совершенно не трогая внешний край. Этот процесс можно также осуществить равномерными ударами на деревянном основании с лункой. Последним способом пользуются в тех случаях, когда желательно избежать появления следов обработки на поверхности изделия. Небольшое скругление внешнего края достигается обстукиванием молотком по сферическому чекану соответствующего размера. Заготовкой для получения вогнутого сводчатого обручального кольца служит плоский обод.  Придерживая обод в наклонном положении на роге шперака, его края проковывают по окружности клиновидным плоскозакругленным бойком молотка (рис. а). Затем сферическим Придерживая обод в наклонном положении на роге шперака, его края проковывают по окружности клиновидным плоскозакругленным бойком молотка (рис. а). Затем сферическим
|
Поиск по сайту:
|
 Расходники или обводные чеканы. Эти чеканы представляют собой несколько утолщенный в средней части и утоненный к концам
Расходники или обводные чеканы. Эти чеканы представляют собой несколько утолщенный в средней части и утоненный к концам  стержень. Рабочая поверхность (боек) чекана выполняется в виде острого или слегка скругленного клина (рис. a). Для чеканки изогнутых линий применяются чеканы со слегка искривленной рабочей поверхностью (рис. б). Эту группу чеканов применяют для воспроизведения общего очертания рисунка или, например, рисунка шрифта, сходного с тем, который получают гравированием. Порушники и бобошники. Эти чеканы применяются для выбивания выпуклостей требуемой формы. Они имеют полушаровую головку или продолговатый, овальный боек (рис. в, г, д). Лощатники. Это довольно обширная группа чеканов с плоским бойком, применяемых для выравнивания и сглаживания поверхностей (рис. е). Бойки могут иметь различную форму, отвечающую обрабатываемой поверхности: квадратную, круглую, овальную, треугольную, прямоугольную, пятиугольную и т. д. Для этих чеканов особенно важно, чтобы их грани не были острыми, а слегка скругленными, иначе на рабочем материале могут остаться вмятины. Рифленые или матовые чеканы. Этот вид чеканов напоминает по форме лощатники, но рабочая поверхность у них не гладкая, а рифленая (рис. ж). Применяют такие чеканы для получения матовой поверхности и фона вокруг контурных рисунков. На лицевой поверхности бойка чекана гравируют насечку перекрещивающимися штрихами. Ее можно сделать также вбиванием в рабочую поверхность отожженного чекана старого напильника. После нанесения насечки производится закалка и отпуск бойка. Сечки. Это чеканы (рис. з), имеющие форму односторонне заточенного плоского зубила. Они применяются для выбивания тонкого линейного рисунка и для одностороннего ступенчатого смещения металла вниз. Фигурные (узорные) чеканы. В этом понятии объединены все те формы чеканов (рис. и, к, л, м), которые в меньшей мере служат в качестве вспомогательных средств при создании контура рисунка; они применяются для отделки орнамента. На рабочей части чекана имеется определенный рисунок. Чеканом, как пуансоном листового штампа, выбивают этот рисунок на изделии. Посредством периодических разряжений или сгущений ударов фигурным чеканом образуются привлекательные и более выразительные линии и поверхности.
ПРОЦЕСС ФОРМООБРАЗОВАНИЯ ПРИ ВЫКОЛОТКЕ И ЧЕКАНКЕ При выколотке и чеканке, так же как и при вальцовке, ковке и гибке, металл испытывает пластическую деформацию. Общие черты процесса деформации, на основе которого ежит изменение строения атомной решетки и структуры кристалита, имеют место и здесь. Особенно важно различать общую формацию всей заготовки и частичную деформац и ю, т. е. деформацию определенных участков заготовки при выколотке. Если, например, в листовой заготовке, укрепленной на мастичной подкладке, выбивают полукруглую выпуклость, то при этом протекают следующие процессы (см. рис. а): чекан с шаровой головкой ударом молотка вколачивается в лист, и в металле сначала образуется знакомое еще по ковке небольшое углубление. Подкладка при этом оказывает лишь слабое сопротивление в противоположность стальной наковальне, которая оказывает весьма сильное противодействие удару. В результате лист под воздействием чекана вдавливается в мастичную подкладку, а кристаллиты металла пластически деформируются. Поверхность листа в месте чеканки увеличивается за счет уменьшения толщины листа: чем глубже проникает чекан, тем больше становится сферическая поверхность и тем меньше делается толщина листа. В большинстве случаев наибольшему напряжению подвергаются те области, которые первыми были охвачены деформацией, в нашем примере — вершина выпуклости. Здесь в
стержень. Рабочая поверхность (боек) чекана выполняется в виде острого или слегка скругленного клина (рис. a). Для чеканки изогнутых линий применяются чеканы со слегка искривленной рабочей поверхностью (рис. б). Эту группу чеканов применяют для воспроизведения общего очертания рисунка или, например, рисунка шрифта, сходного с тем, который получают гравированием. Порушники и бобошники. Эти чеканы применяются для выбивания выпуклостей требуемой формы. Они имеют полушаровую головку или продолговатый, овальный боек (рис. в, г, д). Лощатники. Это довольно обширная группа чеканов с плоским бойком, применяемых для выравнивания и сглаживания поверхностей (рис. е). Бойки могут иметь различную форму, отвечающую обрабатываемой поверхности: квадратную, круглую, овальную, треугольную, прямоугольную, пятиугольную и т. д. Для этих чеканов особенно важно, чтобы их грани не были острыми, а слегка скругленными, иначе на рабочем материале могут остаться вмятины. Рифленые или матовые чеканы. Этот вид чеканов напоминает по форме лощатники, но рабочая поверхность у них не гладкая, а рифленая (рис. ж). Применяют такие чеканы для получения матовой поверхности и фона вокруг контурных рисунков. На лицевой поверхности бойка чекана гравируют насечку перекрещивающимися штрихами. Ее можно сделать также вбиванием в рабочую поверхность отожженного чекана старого напильника. После нанесения насечки производится закалка и отпуск бойка. Сечки. Это чеканы (рис. з), имеющие форму односторонне заточенного плоского зубила. Они применяются для выбивания тонкого линейного рисунка и для одностороннего ступенчатого смещения металла вниз. Фигурные (узорные) чеканы. В этом понятии объединены все те формы чеканов (рис. и, к, л, м), которые в меньшей мере служат в качестве вспомогательных средств при создании контура рисунка; они применяются для отделки орнамента. На рабочей части чекана имеется определенный рисунок. Чеканом, как пуансоном листового штампа, выбивают этот рисунок на изделии. Посредством периодических разряжений или сгущений ударов фигурным чеканом образуются привлекательные и более выразительные линии и поверхности.
ПРОЦЕСС ФОРМООБРАЗОВАНИЯ ПРИ ВЫКОЛОТКЕ И ЧЕКАНКЕ При выколотке и чеканке, так же как и при вальцовке, ковке и гибке, металл испытывает пластическую деформацию. Общие черты процесса деформации, на основе которого ежит изменение строения атомной решетки и структуры кристалита, имеют место и здесь. Особенно важно различать общую формацию всей заготовки и частичную деформац и ю, т. е. деформацию определенных участков заготовки при выколотке. Если, например, в листовой заготовке, укрепленной на мастичной подкладке, выбивают полукруглую выпуклость, то при этом протекают следующие процессы (см. рис. а): чекан с шаровой головкой ударом молотка вколачивается в лист, и в металле сначала образуется знакомое еще по ковке небольшое углубление. Подкладка при этом оказывает лишь слабое сопротивление в противоположность стальной наковальне, которая оказывает весьма сильное противодействие удару. В результате лист под воздействием чекана вдавливается в мастичную подкладку, а кристаллиты металла пластически деформируются. Поверхность листа в месте чеканки увеличивается за счет уменьшения толщины листа: чем глубже проникает чекан, тем больше становится сферическая поверхность и тем меньше делается толщина листа. В большинстве случаев наибольшему напряжению подвергаются те области, которые первыми были охвачены деформацией, в нашем примере — вершина выпуклости. Здесь в  первую очередь может быть достигнут предел прочности, и при продолжении деформации возможен разрыв листа. При отжиге возникнут различные рекристаллизованные структуры: только в максимально деформированном участке листа получится мелкое зерно, в остальных частях листа кристаллиты будут более крупными. Несколько другая картина наблюдается в том случае, если вырезанную в виде кружка заготовку нужно прочеканить до полусферы в углублении анки (рис. б). В этом случае, испытывая давление чекана, материал бляшки поддается ему в первую очередь в краевых зонах. Здесь частицы металла сдвигаясь сближаются, подвергаясь сжатию. Чем дальше продвигается процесс
первую очередь может быть достигнут предел прочности, и при продолжении деформации возможен разрыв листа. При отжиге возникнут различные рекристаллизованные структуры: только в максимально деформированном участке листа получится мелкое зерно, в остальных частях листа кристаллиты будут более крупными. Несколько другая картина наблюдается в том случае, если вырезанную в виде кружка заготовку нужно прочеканить до полусферы в углублении анки (рис. б). В этом случае, испытывая давление чекана, материал бляшки поддается ему в первую очередь в краевых зонах. Здесь частицы металла сдвигаясь сближаются, подвергаясь сжатию. Чем дальше продвигается процесс  деформации, тем шире становится область заготовки, охваченная сжатием и тем значительнее должны сближаться кристаллиты краевой (наружной) зоны. Такой вид напряженно-деформированного состояния приводит в результате к увеличению толщины материала в наружной области бляшки, где в первую очередь началась деформация. Помимо этого наружная зона подвергается действию максимальных напряжений, величинакоторых, так же как и степень деформации, постепенно уменьшается к центру заготовки. Посредине кружка сохраняются первоначальная структура и толщина материала. ПРИМЕРЫЮВЕЛИРНЫХ ВЫКОЛОТОЧНЫХ РАБОТ Полусферическую заготовку изготавливают в углублении анки чеканом с шаровой головкой. Для придания вырезанной бляшке предварительной выпуклой формы, ее укладывают сначала в большую лунку чашеобразной формы и наносят удары сферическим чеканом, диаметр которого несколько меньше диаметра лунки (рис. а). Потом переходят к лунке с меньшим диаметром и процесс этот повторяют до тех пор, пока не будет получена желаемая выпуклость (рис. б). Если чекан слишком велик, то его поверхность разбивается о края лунки, если же он слишком мал, то заготовка получится неравномерно выпуклой. Другую, неполушаровую форму изделия можно получить свободной выколоткой, обрабатывая заготовку. Для получения чашечки слегка выпуклой формы заготовку помещают на металлический брусок и проковывают разгоночным молотком от центра наружу по спирали, уменьшая при этом силу удара к краям и совершенно не трогая внешний край. Этот процесс можно также осуществить равномерными ударами на деревянном основании с лункой. Последним способом пользуются в тех случаях, когда желательно избежать появления следов обработки на поверхности изделия. Небольшое скругление внешнего края достигается обстукиванием молотком по сферическому чекану соответствующего размера. Заготовкой для получения вогнутого сводчатого обручального кольца служит плоский обод.
деформации, тем шире становится область заготовки, охваченная сжатием и тем значительнее должны сближаться кристаллиты краевой (наружной) зоны. Такой вид напряженно-деформированного состояния приводит в результате к увеличению толщины материала в наружной области бляшки, где в первую очередь началась деформация. Помимо этого наружная зона подвергается действию максимальных напряжений, величинакоторых, так же как и степень деформации, постепенно уменьшается к центру заготовки. Посредине кружка сохраняются первоначальная структура и толщина материала. ПРИМЕРЫЮВЕЛИРНЫХ ВЫКОЛОТОЧНЫХ РАБОТ Полусферическую заготовку изготавливают в углублении анки чеканом с шаровой головкой. Для придания вырезанной бляшке предварительной выпуклой формы, ее укладывают сначала в большую лунку чашеобразной формы и наносят удары сферическим чеканом, диаметр которого несколько меньше диаметра лунки (рис. а). Потом переходят к лунке с меньшим диаметром и процесс этот повторяют до тех пор, пока не будет получена желаемая выпуклость (рис. б). Если чекан слишком велик, то его поверхность разбивается о края лунки, если же он слишком мал, то заготовка получится неравномерно выпуклой. Другую, неполушаровую форму изделия можно получить свободной выколоткой, обрабатывая заготовку. Для получения чашечки слегка выпуклой формы заготовку помещают на металлический брусок и проковывают разгоночным молотком от центра наружу по спирали, уменьшая при этом силу удара к краям и совершенно не трогая внешний край. Этот процесс можно также осуществить равномерными ударами на деревянном основании с лункой. Последним способом пользуются в тех случаях, когда желательно избежать появления следов обработки на поверхности изделия. Небольшое скругление внешнего края достигается обстукиванием молотком по сферическому чекану соответствующего размера. Заготовкой для получения вогнутого сводчатого обручального кольца служит плоский обод.  Придерживая обод в наклонном положении на роге шперака, его края проковывают по окружности клиновидным плоскозакругленным бойком молотка (рис. а). Затем сферическим
Придерживая обод в наклонном положении на роге шперака, его края проковывают по окружности клиновидным плоскозакругленным бойком молотка (рис. а). Затем сферическим