В природе алкены встречаются редко. Методы получения алкенов можно разделить на промышленные и лабораторные.
A. Промышленные методы получения:
Обычно газообразные алкены (этилен, пропилен, бутен) выделяют из газов деструктивной переработки нефти (это термический, каталитический крекинг), реакции пиролиза, из газов коксования угля. В зависимости от видов сырья и условий, содержание алкенов может варьироваться от 15 до 55%.
1. Реакция дегидрирования алканов..

B. Лабораторные методы:
2.Частичное гидрирование ацетиленовых углеводородов

2. Отщепление галогеноводородов от галогеналкилов при действии на них спиртового раствора щелочи:
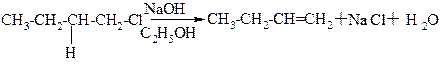
Правило Зайцева: при отщеплениигалогена атом водорода легче всего отщепляется от соседнего наименее гидрогенизированного атома углерода.

3. Дегидратация спиртов (отнятие воды).
Различают два вида дегидратации:
a)Сернокислотный способ H2SO4 концент.
б) Каталитический способ, в присутствии Al2O3 (при 350-400 0С)

Легче в реакцию вступают третичные спирты, далее вторичные, и усложняется проведение реакции с первичными.
Химические свойства
В отличии от алканов алкены обладают значительной реакционной активностью, что определяются наличием двойной связи.
1. Галогенирование (присоединение галогенов). Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенпроизводных:

3. Гидрогалогенирование (присоединение галогенводородов)

Правило Марковникова:
В реакции присоединения галогенводорода к несимметричным алкенам в обычных условиях, водород присоединяется к наиболее гидрогенизированному атому углерода по месту двойной связи.


Правило объясняется с точки зрения электронной теории, либо теории устойчивости промежуточного карбкатиона
Отклонение в реакции гидрогалогенирования происходит в присутствии перекиси водорода Н2О2 или кислорода. Порядок реакции меняется с ионного на радикальный и присоединение идет против реакции Марковникова, т.е. имеет обратный порядок. Такая реакция имеет свое название:
Гидрогалогенирование. Перекисный эффект Караша.
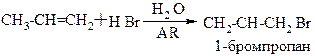
4. Гидратация – присоединение воды, протекает в присутствии серной кислоты, с образованием спиртов. 
Окисление
а) окисление в мягких условиях – реакция Вагнера (разбавленный раствор КМnО4 при н.у.)

б) жесткое окисление, протекает с разрывом σ- и π –связей, с образованием карбоновых кислот или кетонов.

Полимеризация

n - степень полимеризации, n = 100 – 10 000
ДИЕНЫ
Алкадиены – ациклические непредельные углеводороды, в молекулах которых помимо одинарных связей имеется две двойные связи между атомами углерода.
Общая формула алкадиенов СnH2n-2.
Строение. В зависимости от взаимного расположения двойных связей различают три вида диенов:
· Алкадиены с куммулированным расположением двойных связей
СH2=C=CH2
· Алкадиены с сопряженными двойными связями
СH2=CH-CH=CH2
· Алкадиены с изолированными двойными связями
CH2=CH-CH2-CH2-CH=CH2
Методы получения.
1. Дегидрирование н-бутана (двухстадийный каталитический процесс).

Аналогичным способом получают изопрен (2-метилбутадиен-1,3).

2. Метод Лебедева. Получение бутадиена из этилового спирта, в данном методе протекают две реакции одновременно дегидратации и дегидрирования.

3. Дегидрогалогенирование.
При действии на дибромалканы спиртового раствора щелочи происходит отщепление двух молекул галогеноводорода и образование двух двойных связей.

Химические свойства.
Свойства алкадиенов с изолированными двойными связями мало отличаются от обычных алкенов. Мы остановимся на диенах с сопряженными связями, которые обладают некоторыми особенностями.
А. Реакции присоединения. Диены способны присоединять водород, галогены, галогеноводороды. Особенностью присоединения к диенам является способность присоединять молекулы как в положение 1,2- так и в положение 1,4-.
1. Гидрирование.

2. Галогенирование.

3. Гидрогалогенирование.
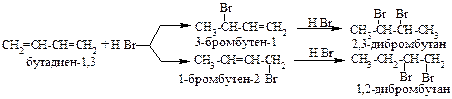
Б.Реакции полимеризации.
Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Реакция эта является основой для получения синтетических каучуков.
