Способ основан на свойстве ионов Са2+ и Mg2+ образовывать в щелочной среде прочные комплексные соединения с трилоном Б, являющимся двунатриевой солью этилендиаминтетрауксусной кислоты:

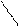 NaООС – СН2 СН2 – СООNa
NaООС – СН2 СН2 – СООNa

 N –СН2 –СН2 –N
N –СН2 –СН2 –N
НООС – СН2 СН2 – СООН
или сокращенно Na2Н2Т. Схематически реакции можно выразить уравнениями: Na2Н2Т +Са2+ = Na2СаТ + 2Н+, Na2Н2Т + Mg2+ = Na2MgТ + 2Н+.
Вначале образуется комплекс с ионами Са2+, а затем с ионами Mg2+.
В качестве индикатора применяют спиртовый раствор красителя «эриохром черного Т». В умеренно щелочной среде (рН≈10) резкое изменение голубой окраски индикатора в винно-красную происходит вследствие образования
MgInd-: Mg2++ HInd-2=MgInd-+ H+
голубой винно-красный
В процессе титрования сначала образуется комплексное соединение трилона Б с ионами кальция, а затем с ионами магния, при этом соединение ионов Mg2+с индикатором разрушается и в конце титрования изменяется окраска раствора из винно-красной в голубую по реакции:
MgInd-+Na2Н2Т = Na2MgТ + HInd-2+ H+
винно-красный голубой
Ионы Са2+ такого четкого изменения окраски индикатора не дают, поэтому отдельно ионы Са2+ в присутствии индикатора эриохром черного Т определить нельзя.
Ход определения. В коническую колбу отбирают пипеткой 50 мл водопроводной воды, прибавляют 5 мл аммиачного буферного раствора (для поддержания рН≈10),8 капель индикатора эриохром черного и медленно титруют 0,01н раствором трилона Б, все время энергично перемешивая содержимое колбы до изменения окраски из винно-красной в голубую. Свидетелем может служить перетитрованная проба, так как при прибавлении избытка раствора трилона Б окраска больше не изменяется. Титрование повторяют 2 раза, для расчетов принимают средний результат.
Расчет общей жесткости воды производят по формуле:
Жобщ =  ∙ 1000,мэкв/л.
∙ 1000,мэкв/л.
Опыт 2. Определение жесткости воды по ионам Са2+
Принцип трилонометрического метода определения кальция основан на применении трилона Б в присутствии индикатора мурексида, который изменяет свою окраску под влиянием ионов кальция и не реагируетс ионами магния.
Мурексид представляет собой аммониевую соль пурпуровой кислоты, его водный раствор в щелочной среде (рН >10) имеет лиловый цвет, обусловленный окраской анионов пурпуровой кислоты:NH4+ [пурпур] ↔ NH4+ + [пурпур]-
В присутствии ионов кальция раствор мурексида окрашивается в красный цвет за счет образующегося комплекса пурпурата кальция:
Са2++ 2[пурпур]-= Са[пурпур]2
лиловый цвет красный цвет
Пурпураткальция – соединение нестойкое, при титровании трилоном Б в точке эквивалентности образуется более стойкое соединение Са2+ с трилоном Б, а ионы пурпуровой кислоты освобождаются и окрашивают раствор в лиловый цвет. Этот процесс можно изобразить следующей схемой:
Са[пурпур]2 + Na2Н2Т = СаNa2Т+ 2[пурпур]-
красный цвет лиловый цвет
Изменение цвета от красного до лилового происходит в эквивалентной точке.
Ход определения. В коническую колбу емкостью 250 мл отмеривают пипеткой 50 мл водопроводной воды, прибавляют 2 мл 2н раствора NaOH и 10-15 мг сухого индикатора мурексида. При этом раствор окрашивается в красный цвет Титруют 0,01н раствором трилона Б при энергичном перемешивании до появления устойчивой в течение 3-5 минут лиловой окраски. При прибавлении избытка трилона Б окраска не изменяется. В качестве свидетеля применяют перетитрованную пробу.
Расчет жесткости воды по ионам Са2+ производят по формуле:
ЖСа2+ = 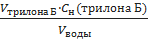 ∙ 1000,мэкв/л.
∙ 1000,мэкв/л.
Вопросы и задачи для самоконтроля
1.Почему разрывается стеклянный сосуд при замерзании содержащейся в
немводы? Ответ поясните с учетом строения воды.
2. Почему не происходит полное замерзание воды в прудах, озерах и реках?
3.Вычислить жесткость воды, зная, что в 500 мл ее содержится 202,5 г
Са(НСО3)2.
4. Сколько граммов СаSO4содержится в 1 м3 воды, если жесткость,
обусловленная присутствием этой соли, равна 4 ммоль/л?
5. Сколько граммов соды надо прибавить к 500 л воды, чтобы устранить ее
жесткость, равную 5 ммоль/л?
6. Вычислить карбонатную жесткость воды, зная, что на титрование 100 мл
этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 мл
0,08н раствороа НС1.
7. В 1 л воды содержится 36,47 мг ионов магния и 50,1 мг ионов кальция.
Чему равна жесткость этой воды?
8. Вода, содержащая только гидрокарбонат магния, имеет жесткость
3,5 ммоль/л. Сколько граммов гидрокарбоната магния содержится в 500 мл
этой воды?