Методические указания
по теме: «Определение жесткости воды»
Ростов-на-Дону

 УДК 541.2
УДК 541.2
Методические указания по курсу «Общая химия» «Определение жесткости воды». – Ростов н/Д: Рост.гос.строит.ун-т, 2012. – 12 с.
В методических указаниях даются сведения о жесткости природных вод, о карбонатной, некарбонатной и общей жесткости воды. Приводятся методы устранения жесткости воды.
В экспериментальной части излагается методика определения временной и общей жесткости воды.
Указания предназначены для студентов 1 курсавсех специальностей дневной и заочной форм обучения.
Составители:
ассист. И.В. Власенко
Редактор Т.М. Климчук
Темплан 2012 г., поз.
__________________________________________________________________
Подписано в печать. Формат 60x84/16. Бумага писчая. Ризограф.
Уч.-изд.л. 0,5. Тираж 100 экз. Заказ
__________________________________________________________________
Редакционно-издательский центр Ростовского государственного строительного университета 344022, Ростов-на-Дону, ул. Социалистическая, 162
©Ростовский государственный
строительный университет, 2012
Природная вода находится в непрерывном взаимодействии с окружающей средой. Она реагирует с атмосферой, почвой, растительностью, минералами и различными породами. Приэтом вода растворяет органические и неорганические соединения. Состав природных вод определяется характером этого взаимодействия.
Все примеси природных вод можно разделить на три группы в зависимости от размера частиц: истинно растворенные, коллоидные и взвешенные. Истинно растворенные вещества находятся в виде ионов и молекул и имеют размеры менее 1 нм. Коллоидные частицы имеют размеры от 1 до 100 нм. Взвешенные или грубодисперсные частицы имеют размеры свыше 0,1 мкм. По химическому составу примеси подразделяются на органические и неорганические. Первые имеют,как правило, очень сложный состав и находятся в коллоидном или истинно растворенном состоянии. Неорганические примеси находятся в основном в виде ионов: Na+, Ca2+, Mg2+, К+, С1-, SO42-, HСO3-.Вводе растворены азот, кислород, углекислый и другие газы, содержатся карбонаты. Между угольной кислотой и ее анионами устанавливается равновесие, называемое углекислотным: СО2 + Н2О ↔ H2CО3↔ НСО3- + Н+ ↔ СО32- + 2Н+.
При повышении рН равновесие сдвигается в сторону образованиякарбонат-ионов, которые доминируют при рН>10. При понижении рН равновесие сдвигается в сторону образования Н2СО3, которая превалирует при рН<6. Вода, у которой угольная кислота, гидрокарбонат- и карбонат-ионы находятся в равновесии, называется стабильной. При сдвиге равновесия в сторону образования угольной кислоты вода становится агрессивной, при этом повышается ее коррозионная активность. При сдвиге равновесия в сторону образования карбонат-ионов из воды выпадает малорастворимый карбонат кальция.
Вода – универсальный растворитель. Она обладает высокой теплоемкостью (75,3 Дж/моль·К) и теплопроводностью (0,556 Вт/м·К), обеспечивающими хороший отвод теплоты. Но воде свойственны и отрицательные качества. Замерзая, она увеличивается в объеме на 9% и создает опасность для систем охлаждения.Соли и другие малорастворимые примеси технических вод осаждаются на стенках котлов и других аппаратов, снижая эффективность этих устройств. Хлориды натрия и некоторыедругиепримеси в котлах переходят в пар и затем, осаждаясь налопастяхтурбин, изменяют их профиль и соответственно снижают КПД электростанций. Растворенные в воде кислород, диоксид углерода, ионы железа и нитрит-ионы вызывают коррозию металлов.
Жесткая вода не дает пены с мылом, так как образует нерастворимые кальциевые и магниевые мыла с содержащимися в них растворимыми натриевыми солями жирных кислот.
Самый серьезный недостаток воды - образование накипи, которая имеет плохую теплопроводность, вызывает местный перегрев стенок, ухудшает отвод теплоты, уменьшает проходное сечение труб и нарушает тепловой режим. Интенсивность образования накипи зависит от содержания солей кальция и магния, что характеризуется жесткостью воды.
Жесткость воды – это совокупность свойств, обусловленных содержанием в воде катионов Са2+ и Mg2+ и в меньшей степени катионов железа.Источником образования ионов Са2+ являются осадочные карбонатные породы и породы, содержащие гипс. Источником обогащения воды ионами Mg2+ являются различные горные породы, среди которых значительную роль играют доломиты СаСО3∙MgСО3. Анионами солей могут быть НСО3-,SO42-,С1-. Количественно жесткость выражают числом миллимолей эквивалентов ионов кальция и магния, содержащихся в 1л воды. Учитывая эквивалентные атомные массы ионов кальция и магния, жесткость воды 1мэкв/л соответствует содержанию 20,04 мг/л ионов Са2+ и 12,16 мг/л ионов Mg2+.
Различают жесткость общую, постоянную,временную (устранимую)и карбонатную. Общая жесткость (Жобщ) воды обусловлена содержанием в ней общего количества ионов Са2+ и Mg2+.
Временнаяжесткость обусловлена наличием в воде Са(НСО3)2 и Mg(НСО3)2, которые при нагревании воды до 800С и выше выпадают в осадок в виде СаСО3 и Mg(ОН)2, т.е. при кипячении временная жесткость устраняется. Жесткость воды, которая кипячением не удаляется, называется постоянной.
Постоянная жесткость связана с наличием в воде хлоридов и сульфатов кальция и магния и других солей, которые не выпадают в осадок при нагревании воды, но накипь могут образовать при испарении воды, если их увеличивающаяся при этом концентрация превысит предельную растворимость в воде. Постоянную жесткость оценивают содержанием сульфатов СаSО4,MgSО4и хлоридов СаС12 и MgС12. Особо нежелательна накипь, вызванная СаSО4, т.к. данная соль (гипс) обладает высокой твердостью.
Карбонатная жесткость обусловлена наличием в воде гидрокарбонатов не только кальция и магния, но и натрия, калия, железа, алюминия, а также карбонатов этих же металлов. В щелочных водах, в которых присутствуют соли щелочных металлов в больших количествах, карбонатная жесткость обычно превышает общую жесткость.
В зависимости от содержания солей жесткости вода может быть мягкой (до 4мэкв/л), средней жесткости (от 4 до 8мэкв/л), жесткой (более 8мэкв/л) и очень жесткой (более 12мэкв/л).
Способы умягчения воды. Жесткость воды устраняют физическими и химическими методами.Временную жесткость устраняют термическим или реагентным методами, при этом гидрокарбонаты кальция и магния превращаются в СаСО3 и Mg(ОН)2. Термический метод - кипячение воды:
Са(НСО3)2 = СаСО3↓ + СО2↑ + Н2О; Mg(НСО3)2 = Mg(ОН)2↓+ 2СО2↑.
Этот способ дорог и неэкономичен в сравнении с обработкой воды реагентами. Для уменьшения временной жесткости применяют известкование:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓ + 2Н2О;
Mg(НСО3)2+2Са(ОН)2=Mg(ОН)2↓+2СаСО3↓+2Н2О.
Одновременно устраняются и магниевые соли постоянной жесткости:
MgС12 + Са(ОН)2 = Mg(ОН)2↓+ СаС12.Постоянную жесткость устраняют содой Na2CO3: СаSО4 + Na2CO3 = СаСО3↓ + Na2SО4или фосфатом натрия Na3РO4: 3СаС12 + 2Na3РO4 = Са3(РO4)2↓ + 6NaС1,
3MgSО4 + 2Na3РO4 = Mg3(РO4)2↓ + 3Na2SО4.
На каждый 1 мэкв/л жесткости 1м3 умягчаемой воды надо добавить 53г безводной соды или 55г фосфата натрия.
Метод ионного обмена основан на способности некоторых природных и искусственных высокомолекулярных соединений -ионитов – обменивать входящие в их состав радикалы на ионы, находящиеся в растворе. Вещества, способные обменивать ионы на катионы раствора, называются катионитами, а на анионы раствора – анионитами. Катионитами являются алюмосиликаты типа цеолитов, условно их обозначают Na2R, где R – алюмосиликатный радикал. Происходящий между алюмосиликатом и жесткой водой обмен ионами можно представить так:
Na2R + CaCl2 = CаR + 2NaCl,Na2R +Mg(НСО3)2 = MgR + 2NaНСО3.
Для умягчения воды применяют также искусственные органические полимеры, называемые ионообменными смолами.Катионообменные смолы содержат активные группы, в которых атом водорода способен замещаться на катион (RH); в анионообменных смолах активными являются основные группы (RОH). Пропуская природную воду через систему катионитов и анионитов, можно получить дистиллированную воду:
катионный обмен 2RH + СаSО4 = R2Са + Н2SО4;
анионный обмен 2RОH + Н2SО4 = R2SО4 + 2Н2О,
где R – сложный органический радикал.
Когда процесс ионного обмена доходит до равновесия, ионит перестает работать, утрачивает способность умягчать воду. Однако любой ионит легко подвергается регенерации. Для этого через катионит пропускают концентрированный растворNaCl, Na2SО4, НС1 или Н2SО4. При этом катионы Са2+ и Mg2+ выходят в раствор, а катионит вновь насыщается ионами
Na+ или Н+:CаR + 2NaCl = Na2R + CaCl2; MgR + 2NaCl = Na2R + MgCl2.
Для регенерации анионита его обрабатывают раствором щелочи или соды. В результате поглощенные анионы вытесняются в раствор, а анионит вновь насыщается ионами ОН- RС1 + NaОН = RОН + NaCl.
В настоящее время самым простым, экономичным и эффективным способом снижения жесткости является магнитная обработка. Воду пропускают через магнитное силовое поле в направлении, перпендикулярном силовым линиям, в результате чего содержащиеся в воде соли не образуют накипи, а выпадают в виде легкосмываемого шлама. Под действием обработанной воды разрушается ранее образовавшаяся накипь.
Расчет жесткости.
Ж = 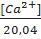 +
+  ,
,
где [Са2+] и [Mg2+] – концентрации катионов кальция и магния в мг/л;
20,04 и 12,16 – эквивалентные массы кальция и магния в г/моль или мг/ммоль;
Ж =  ·1000 мэкв/л,
·1000 мэкв/л,
где m – содержание в воде двухзарядных катионов металлов (или соответствующих им солей), г;
mэ – эквивалентные массы катионов металлов (или соответствующих им солей), г/моль;
Жобщая = Жпостоянная + Жвременная.
Пример 1. Определение общей жёсткости воды (Жобщ) по массе содержащихся в воде солей.
Рассчитайте общую жесткость воды (мэкв/л), если в 0,25 л воды содержится 16,20 мг гидрокарбоната кальция, 2,92 мг гидрокарбоната магния, 11,10 мг хлорида кальция и 9,50 мг хлорида магния.
Решение. Жесткость воды (Ж) выражается в миллиэквивалентах двухзарядных катионов металлов Ca², Mg² или соответствующих им солей, содержащихся в 1 л воды:Ж =  ,где m 1, m 2, m 3 – массы двухзарядных катионов металлов (или соответствующих им солей) в воде, мг; MЭ 1, MЭ 2, MЭ 3 – молярные массы эквивалентов катионов металлов (или соответствующих им солей); V – объём воды, л.
,где m 1, m 2, m 3 – массы двухзарядных катионов металлов (или соответствующих им солей) в воде, мг; MЭ 1, MЭ 2, MЭ 3 – молярные массы эквивалентов катионов металлов (или соответствующих им солей); V – объём воды, л.
Определяем молярные массы эквивалентов солей, обуславливающих жёсткость воды:



Общая жесткость данного образца воды равна сумме временной и постоянной жёсткости и обусловлена содержанием в ней солей, придающих жесткость:Жобщ = 
 = 2,56 ммоль/л
= 2,56 ммоль/л
Пример 2. Определение временной (гидрокарбонатной) жесткости воды по объёму соляной кислоты, пошедшей на её титрование.
Найдите временную жесткость воды, если на титрование 0,1 л образца воды, содержащей гидрокарбонат магния, израсходовано 0,0072л 0,14нHCl.
Решение. При титровании воды соляной кислотой происходит следующая химическая реакция:Mg(HCO3)2 + 2HCl→ MgCl2 + 2CO2 + 2H2O.
В соответствии с законом эквивалентов количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. На титрование 0,1 л воды израсходовано 0,14·0,0072 = 0,001008 моль НСl. Следовательно, такое же количество ионов магния содержится в воде, т. е.
VHC1·Cн(НС1) = Vводы ·Сн(Н2О);
Сн(Н2О) =  =
=  = 0,01008моль/л = 10,08 мэкв/л.
= 0,01008моль/л = 10,08 мэкв/л.
Жесткость данного образца воды равна 10,08 мэкв/л (вода жёсткая).
Пример 3. Определение временной и постоянной жесткости воды по количеству реагентов, необходимых для устранения жесткости.
Для устранения общей жесткости по известково-содовому методу к 50 л воды добавлено 7,4 г Ca(OH)2 и 5,3 г Na2CO3. Рассчитайте временную и постоянную жесткость воды.
Решение. Добавление к воде Ca(OH)2 может устранить временную жёсткость, а добавление Na2CO3 – постоянную жесткость. При добавлении этих реагентов к воде происходят следующие химические реакции:
Me(HCO3)2 + Ca(OH)2 → MeCO3 + CaCO3 + 2H2O;
Me(NO3)2 + Nа2СО3 → МеСО3 + 2NаNО3;(Ме²+: Са²+, Mg²+, Fe²+идр.).
Временную жесткость воды Жвр измеряют количеством гидроксида кальция, участвующего в реакции, а постоянную жесткость Жпост – количеством карбоната натрия.
Жвр =  ;Жпост =
;Жпост = 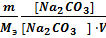 ;
;
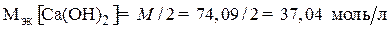 ;
;

Жвр=7400/ (37,04·50) = 4мэкв/л;Жпост = 5300 / (53,0·50) = 2 мэкв/л.
 = Жвр + Жпост = 4+2 = 6 мэкв/л (вода средней жесткости).
= Жвр + Жпост = 4+2 = 6 мэкв/л (вода средней жесткости).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1.Определение временной жесткости воды
Способ основан на реакции между соляной кислотой и гидрокарбонатами:Са(HCO3)2 + 2НС1 = СаС12 + 2Н2О + 2СО2.
При титровании кислотой добавленный в воду индикатор метиловый оранжевый изменит окраску, как только в растворе появится небольшой избыток кислоты.
Ход определения. Отмерьте с помощью пипетки в две колбы по 50 мл водопроводнойводы и прибавьте в каждую по 1-2 капли индикатора метилового оранжевого. Одна из колб будет служить контрольной. Во вторую колбу приливайте из бюретки по каплям децинормальный (0,1н) раствор соляной кислоты до тех пор, пока от одной капли кислоты окраска из желтой перейдет в оранжевую (цвет сравнивают с цветом в контрольной пробе). Титрование повторяют два раза, для расчетов принимают средний результат.
Расчет временной жесткости воды производят по формуле:
Жводы= 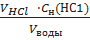 · 1000, где Жводы– временная жесткость воды,мэкв/л; VНС1– объем раствора кислоты, израсходованный на титрование, мл;
· 1000, где Жводы– временная жесткость воды,мэкв/л; VНС1– объем раствора кислоты, израсходованный на титрование, мл;
Сн(НС1) –нормальная концентрация кислоты;Vводы – объем воды, мл.