 Допишите методом электронно-ионного баланса уравнение реакции, молекулярно-ионная схема которой
Допишите методом электронно-ионного баланса уравнение реакции, молекулярно-ионная схема которой
KMnO4 + MnSO4 + H2O ® MnO2 + …
Решение.
1. Рассчитывают степени окисления атомов тех элементов, которые ее изменяют, определяют окислитель, восстановитель и среду:

Отсутствие сильной кислоты или щелочи в левой части уравнения указывает на то, что реакция проходит в нейтральной среде.
2. Составляют ионную схему реакции
 К+ + MnO4¯+ Mn2+ + SO42–+ Н2О ® MnO2 +...,
К+ + MnO4¯+ Mn2+ + SO42–+ Н2О ® MnO2 +...,
выделяют окислительно-восстановительные пары
Mn2+ ® MnO2
MnO4¯ ® MnO2.
3. Составляют уравнения полуреакций.
Уравнивают число атомов кислорода, а затем водорода (среда нейтральная, в левой части уравнений – только молекулы Н2О, в правой – ионы Н+ и ОН¯).
Mn2+ + 2Н2О ® MnO2 + 4Н+
MnO4¯ + 2Н2О ® MnO2 + 4ОНˉ.
4. Определяют число отданных и принятых электронов, дописывают уравнения полуреакций:
Mn2+ + 2Н2О - 2ē = MnO2 + 4Н+
MnO4¯ + 2Н2О + 3ē = MnO2 + 4ОНˉ.
5. Определяют множители для уравнивания числа отданных и принятых электронов, затем суммируют уравнения полуреакций с учетом найденных множителей:

 Mn2+ + 2Н2О - 2ē = MnO2 + 4Н+ 3
Mn2+ + 2Н2О - 2ē = MnO2 + 4Н+ 3
 MnO4¯ + 2Н2 О + 3ē = MnO2 + 4ОН¯ 2
MnO4¯ + 2Н2 О + 3ē = MnO2 + 4ОН¯ 2
3Mn2+ + 6Н2О + 2MnO4¯ + 4Н2О ® 3MnO2 + 2MnO2 + 8ОН¯ + 12Н+.
6. Приводят подобные, предварительно объединив ионы Н+ и ОН¯ в правой части уравнения в молекулы Н2О:
 3Mn2+ + 6Н2О + 2MnO4¯ + 4Н2О ® 3MnO2 + 2MnO2 + 12Н+ + 8ОН¯,
3Mn2+ + 6Н2О + 2MnO4¯ + 4Н2О ® 3MnO2 + 2MnO2 + 12Н+ + 8ОН¯,
8Н2О + 4Н+
получают краткое ионное уравнение
3Mn2+ + 2MnO4¯+ 2Н2О ® 5MnO2 + 4Н+.
7. Дописывают в левую часть противоионы, а затем те же противоионы добавляют к ионам правой части, группируя их с учетом формул веществ:




 3Mn2+ + 2MnO4¯ + 2Н2О ® 5MnO2 + 4Н+.
3Mn2+ + 2MnO4¯ + 2Н2О ® 5MnO2 + 4Н+.
3SO42- 2K+ 2SO42- 2K+ + SO42–
8. Составляют молекулярное уравнение реакции:
3MnSO4 + 2KMnO4 + 2Н2О = 5MnO2 + 2Н2SO4 + K2SO4
Проверка баланса атомов кислорода

 3·4 + 2·4 + 2 = 5·2 + 2·4 + 4
3·4 + 2·4 + 2 = 5·2 + 2·4 + 4
22 22
подтверждает правильность расстановки коэффициентов.
Окислительно-восстановительные потенциалы.
Направление ОВР
В каждой ОВР участвуют две окислительно-восстановительные пары.
ОВР: Zn + CuSO4 = ZnSO4 + Cu, (1)
восст-ль окисл-ль
Окислительно-восстановительные пары:
 Zn — Zn2+
Zn — Zn2+
|
В ходе ОВР электроны переходят от одной пары к другой.
Каждая пара имеет потенциальную возможность принимать и отдавать электроны. Так в реакции
Mg + ZnSO4 = MgSO4 + Mg, (2)
В отличие от реакции (1), электроны переходят к паре, содержащей цинк:
 Mg — Mg 2+
Mg — Mg 2+
|
Мерой окислительно-восстановительной способности данной пары является окислительно-восстановительный или электродный потенциал, который обозначают  , где Ок-окисленная форма, Вс-восстановленная форма данной пары (например,
, где Ок-окисленная форма, Вс-восстановленная форма данной пары (например,  ,
,  ). Размерность потенциала – Вольт. Стандартные потенциалы большого числа окислительно-восстановительных пар приведены в справочных таблицах. Следует отметить, что за нуль принят стандартный окислительно-восстановительный потенциал пары Н+/Н2,
). Размерность потенциала – Вольт. Стандартные потенциалы большого числа окислительно-восстановительных пар приведены в справочных таблицах. Следует отметить, что за нуль принят стандартный окислительно-восстановительный потенциал пары Н+/Н2,  .
.
Электроны переходят от пары, содержащей восстановитель, к паре, содержащей окислитель (от меньшего потенциала к большему). Из этого следует:
· чем больше значение потенциала окислительно-восстановительной пары, тем более сильным окислителем является окисленная форма (Ок) данной пары;
· чем меньше значение потенциала - тем более сильным восстановителем является восстановленная форма (Вс). окислительно-восстановительной пары.
В частности, сильнейший окислитель – фтор,  сильнейшие восстановители – щелочные металлы,
сильнейшие восстановители – щелочные металлы, 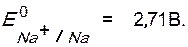
Пользуясь значениями окислительно-восстановительных (ОВ) потенциалов можно определить направление протекания ОВР.
Обозначим
 - о.-в. потенциал пары, содержащей окислитель;
- о.-в. потенциал пары, содержащей окислитель;
 - о.-в. потенциал пары, содержащей восстановитель.
- о.-в. потенциал пары, содержащей восстановитель.
Условие самопроизвольного прохождения ОВР:
если  >
>  – самопроизвольно может протекать
– самопроизвольно может протекать
прямая реакция,
 <
<  – прямая реакция невозможна,
– прямая реакция невозможна,
самопроизвольно может
протекать обратная реакция.
Для реакции Zn + CuSO4 = ZnSO4 + Cu:



реакция в стандартных условиях возможна.