Равновесие в гетерогенной системе
Гетерогенные системы
В предыдущем разделе мы рассмотрели ионные равновесия в растворах электролитов, представляющих собой гомогенные, т.е. однородные системы. При анализе используются и более сложные – гетерогенные или неоднородные системы. Гетерогенными системами называют системы, состоящие из двух или нескольких фаз. Фазой называют отдельные части гетерогенной системы, различающиеся по свойствам и отделенные друг от друга поверхностями раздела. Примерами гетерогенных систем могут служить следующие системы:
- "вода - лед" (жидкая фаза - вода, твердая фаза - лед),
- "толуол - вода", это - две несмешивающиеся жидкости (обе фазы - жидкие),
- "насыщенный водный раствор соли, находящийся в равновесии с осадком" (жидкая фаза - водный раствор соли, твердая фаза - кристаллы той же соли).
Насыщенный раствор - это раствор, находящийся в равновесии с осадком или раствор, в котором при данных условиях вещество больше не растворяется. Ненасыщенный раствор - это раствор, в котором при данных условиях вещество еще может растворяться. Не надо путать насыщенные и концентрированные растворы.
Концентрированный раствор - это такой раствор, в котором масса растворенного вещества соизмерима с массой растворителя (10%, 20% и более). Разбавленный раствор - это раствор, в котором масса растворенного вещества много меньше, чем растворителя.
Насыщенный раствор может быть разбавленным, а концентрированный - ненасыщенным.
Равновесия в насыщенных растворах труднорастворимых электролитов
Произведение растворимости
В насыщенном водном растворе труднорастворимого электролита ВmAn устанавливается равновесие (1), которое показывает, что переход труднорастворимого электролита в водный раствор происходит непосредственно в виде ионов.
ВmAn(тв) 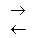 mВn+ + nАm- (1).
mВn+ + nАm- (1).
Для реакции (1), отображающей обратимый и равновесный процесс, справедлив закон действующих масс:
 ,
,
где [Bn+] и [Am-] – концентрации ионов в насыщенном водном растворе, моль/л. Величина равновесной концентрации твердой фазы ВmAn(тв) является постоянной и ее переносят в левую часть:
 .
.
Произведение двух постоянных величин  называют произведением растворимости и обозначают
называют произведением растворимости и обозначают  . В скобках или в виде индекса записывают формулу того труднорастворимого электролита, к которому относится произведение растворимости. С учетом этого получают выражение:
. В скобках или в виде индекса записывают формулу того труднорастворимого электролита, к которому относится произведение растворимости. С учетом этого получают выражение:
 . (4)
. (4)
Из него следует общепринятое определение произведения растворимости. Произведение растворимости (ПР) - это произведение концентраций ионов в насыщенном растворе труднорастворимого электролита, возведенных в степени, соответствующие стехиометрическим коэффициентам. Произведение растворимости в изобаро-изотермических условиях, т.е. при постоянных температуре и давлении, в данном растворителе для каждого электролита является величиной постоянной, характеризующей его растворимость. Значения произведений растворимости большинства труднорастворимых соединений в водных растворах определены экспериментально и приведены в соответствующих справочниках по аналитической химии.