Все факторы, которые будут рассматриваться в этом разделе, влияют лишь на ионную составляющую растворимости. Молекулярная растворимость при этом остается постоянной и рассчитывается по формуле (8). Для соединений с ионной кристаллической решеткой и соединений с сильнополярными ковалентными связями молекулярная растворимость пренебрежимо мала по сравнению с ионной растворимостью.
Влияние индифферентных электролитов
Рассмотрим насыщенный водный раствор труднорастворимого электролита, в котором установилось равновесие:
ВmAn(тв) 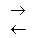 mВn+ + nАm-.
mВn+ + nАm-.
Этому равновесию соответствует протекание двух реакций. Прямая – растворение ВmAn, обратная – соединение ионов Вn+ и Аm- и образование осадка. Допустим, что растворимость соединения мала и ионная сила раствора стремится к нолю. В этом случае электростатические взаимодействия ионов несущественны и раствор можно считать идеальным.
Добавим в насыщенный раствор индифферентный электролит, то есть хорошо растворимый сильный электролит, не вступающий в химическое взаимодействие с компонентами гетерогенной системы, например нитрат калия. Ионная сила раствора при этом возрастет, вокруг ионов образуются ионные атмосферы, что затруднит обратную реакцию, но не влияет на прямую. Это приведет к смещению равновесия в системе в сторону прямой реакции, т.е. к увеличению растворимости электролита ВmAn.
Влияние одноименных ионов
Рассмотрим насыщенный водный раствор труднорастворимого электролита ВmAn. В этой гетерогенной системе устанавливается равновесие:
ВmAn(тв) 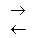 mВn+ + nАm-.
mВn+ + nАm-.
В систему добавим хорошо растворимый электролит, содержащий в своем составе ионы Вn+ или Аm-, так называемые одноименные ионы. Какие изменения произойдут в такой системе и как изменится растворимость ВmAn? В соответствии с принципом Ле-Шателье равновесие в системе сместится в сторону уменьшения концентрации ионов Вn+ или Аm- в растворе. Таким образом, равновесие сместится в сторону обратной реакции и растворимость ВmAn уменьшится.
Влияние кислотности
Кислотность среды оказывает влияние на растворимость труднорастворимых солей, образованных слабыми кислотами или кислотами средней силы, а также на растворимость труднорастворимых гидроксидов. С увеличением кислотности среды растворимость этих веществ увеличивается. Растворимость труднорастворимых хлоридов и сульфатов не зависит от кислотности среды.
ГРАВИМЕТРИЧЕСКИЕ МЕТОДЫ
Гравиметрический анализ заключается в выделении вещества в чистом виде и его взвешивании. Чаще всего такое выделение проводят осаждением. Реже определяемый компонент выделяют в виде летучего соединения (методы отгонки). В ряде случаев гpавиметрия - лучший способ решения аналитической задачи, например, при анализе образцов с содержанием определяемого компонента более 0,1%, особенно если требуется проанализировать ограниченное число проб. Погpешность определения не превышает 0,1-,2%. Гравиметрия – это абсолютный (безэталонный) метод.
Недостатками гpавиметрических методов являются длительность определения, особенно при серийных анализах большого числа проб, а тaкже неселективность - реaгенты-осадители за небольшим исключением редко бывают специфичными. Вследствие этого часто необходимо предваритeльное разделение компонентов пробы.
Сущность метода
Аналитическим сигналом в гpавиметрии является масса. Гравиметрическое определение обычно состоит из нескольких этапов:
1. Осаждение соединения, содержащего определяемое вещество (eгo называют осаждаемой формой).
2. Фильтрование полученной смеси для отделения осадка от надосадочной жидкости.
3. Промывание осадка для удаления надосадочной жидкости и адсорбированных примесей с его поверхности.
4. Высушивание при относительно низкой температуре для удаления воды или прокаливание при высокой температуре для превращения осадка в более подходящую для взвешивания форму (гравиметpическую форму).
5. Взвешивание полученного осадка.
Большинство аналитических методов использует зависимость между измеряемым физическим свойством у и количеством определяемого вещества (или его концентрацией), которая в идеальном случае (отнюдь не всегда) линейна:
c=ky,
где k - константа. Обычно значение k находят эмпирически, измеряя сигнал у от одного или более образцов с известной концентрацией. Из этого правила есть два исключения: гpавиметрический и кулонометрический методы анализа. В гpавиметрии k - это гpавиметрический фактор F, который можно рассчитать непосредственно из общеизвестных констант. В общем случае:

где а и b - числа, необходимые для уравнивания числа молей определяемого вещества в числителе и знаменателе.

К осадкам в гpавиметрии предъявляют ряд довольно жестких требований.