Закон сохранения энергии: история открытия, значение в науке Закон сохранения энергии -- фундаментальный закон природы, установленный эмпирически и заключающийся в том, что энергия изолированной (замкнутой) физической системы сохраняется с течением времени. Другими словами, энергия не может возникнуть из ничего и не может исчезнуть в никуда, она может только переходить из одной формы в другую
Однако в различных разделах физики по историческим причинам закон сохранения энергии формулируется по-разному, в связи с чем говорится о сохранении различных видов энергии. Например, в термодинамике закон сохранения энергии выражается в виде первого начала термодинамики. Поскольку закон сохранения энергии относится не к конкретным величинам и явлениям, а отражает общую, применимую везде и всегда, закономерность, то более правильным является его именование не законом, а принципом сохранения энергии.
В 1841 г. русский ученый Ленц и англичанин Джоуль почти одновременно и независимо друг от друга экспериментально доказали, что теплота может быть создана за счет механической работы. Джоуль определил механический эквивалент тепла. Эти и другие исследования подготовили открытие закона сохранения и превращения энергии. В 1842--1845 г.г. немецкий ученый Р. Майер сформулировал этот закон на основе обобщения данных естествознания о механическом движении, электричестве, магнетизме, химии и даже физиологии человека. Одновременно в Англии (Гров) и в Дании (Кольдинг) были высказаны аналогичные идеи. Несколько позднее этот закон разрабатывал Гельмгольц (Германия). Разными путями шли открыватели закона сохранения и превращения энергии к его установлению.Получается, что физические законы универсальны для всей природы, и их можно использовать в разных сферах, так же как и в самой физике и в науке целом.
с его помощью можно находить значение неизвестых переменных
особенно в тяжелых задачах, когда бывает неизвестно более пяти переменных,соответственно нужно составить не менее 5 уравнений, не выходящих друг из друга
12. Планетарная модель атома по Бору.(см также семинар и лекцию) Чтобы связать свойства химических элементов со строением их атомов, требовалось преодолеть внутреннюю протеворечивость резерфордовской модели атома. Согласно классической электродинамике электроны, вращающиеся вокруг ядра, рано или поздно должны были «упасть» на него. В действительности же атомы представляли чрезвычайно устойчивые системы. Н.Бор в 1913г. Впервые четко сформулировал вывод, что «классическая электродинамика недостаточна для описания частиц атомного размера». Этот вывод привел его к разработке квантовой теории строения атома водорода в качестве первого шага и далее к построению моделей атомов всех элементов периодической системы. Применив к атомной теории гипотезу Планка, Н.Бор сформулировал два основных постулата:1)атом может существовать, не излучая, в определенных стационарных состояниях, характеризующихся определенным значением энергии; 2)поглощение или испускание света происходит квантами лишь при переходе атома из одного стационарного состояния в другое. Тем самым, была устранена противоречивость резерфордовской модели атома. Работа Н.Бора в 1913г. Явилась важнейшим опорным пунктом для развития представлений о связи свойств элементов со строением атома и далее для разработки теории периодической системы. Многое теперь зависело от дальнейшей разработки модели атома, прежде всего от уточнения схемы формирования электронных конфигураций атомов по мере роста Z. В свою очередь это было связано с необходимостью более точной характеристики положения электронов в атоме. Большое значение здесь имело правильное истолкование спектральных данных.Н.Бору удалось рассчитать спектр атома водорода, причем результаты вычислений совпали с эмпирическими (см рис.).Н.Бором было показано, что радиусы возможных электронных орбит атома водорода относятся как 12:22:32:….: n2. Величина n получила название главного квантового числа.Энергия электрона определялась по формуле: Еn= - 2π2me4/n2h2. Поскольку все величины, кроме n, постоянны, то тем самым постулировалось, что энергия электрона в атоме водорода зависит от значения главного квантового числа. 
13. Модель атома по Дж.Томсону и Э.Резерфорду Ни одна из существовавших до этого моделей атома не объясняла, каким же образом свойства химических элементов связаны со строением их атомов.Подобную связь впервые попытался установить Дж.Томсон,который в 1904г. предложил собственную модель атома.
Подобно «пудинговой модели» В.Кельвина (1902г.), он допускал,что положительный заряд атома равномерно распределен по сфере. Внутри нее сосредоточены электроны,расположение которых подчиняется определенным закономерностям. А именно электроны образуют концентрические оболочки,или кольца, причем каждое из колец может содержать конечное число электронов. Таким образом,томсоновская модель атома в известной степени могла бы называться «оболочечной».Опираясь на нее,Дж. Томсон сделал попытку связать периодичность изменения свойств элементов с закономерным изменением строения их атомов. Помещая электроны в различных кольцах, концентрически расположенных вокруг «центра» атома, Дж.Томсон показал, что устойчивость таких колец изменяется периодически по мере роста числа электронов. Например, он рассматривал девять различных моделей атома, каждая из которых содержала по пять колец, причем общее число электронов в кольцах колебалось в пределах от 59 до 67 (числа,конечно, были произвольными). Отсюда Дж.Томсон делал весьма интересный вывод. По его мнению, способность колец отдавать или приобретать электроны коррелирует с численным значением и знаком валентности,проявляемой элементами второго и третьего периодов менделеевской системы. Например, по Дж.Томсону, атом с 59 электронами должен проявлять свойства благородного газа, с 60- щелочного металла, с 61- щелочно-земельного металла и т.д.. Конечно, от модели Дж.Томсона нельзя было требовать многого. Оставалось неизвестным общее число электронов в атоме. Отыскивая связь между строением и свойствами атома, Дж.Томсон фактически брал произвольное число электронов в кольцах, строил из этого числа электронов определенные модели и на этой основе пытался объяснить свойства элементов сообразно их положению в периодической системе. Ни о какой общей теории периодичности не могло быть и речи. Тем не менее Дж. Томсон совершенно правильно заключил, что число электронов в атомах при переходе от элемента к элементу в периодической системе непрерывно изменяется. Он близко подошел к идее, что место элемента в системе должно быть связано с особенностями распределения электронов в атоме (со спецификой строения концентрических колец). В течение 10 лет теория Дж.Томсона пользовалась общим признанием. На почве этой модели атома было разработано учение о внутриатомных вибраторах, разъяснявшее сложный характер явлений дисперсии и поглощения света, возникло учение о поляризации атомов, был понят физический смысл диэлектрической постоянной, предсказано существование изотопов. На основании лишь представления об электроне оказалось невозможным разработать достаточно строго обоснованную атомную модель. Важнейшую роль в ее создании сыграли исследования, явившиеся следствием открытия радиоактивности. Непосредственный экспериментальный путь, приведший к формулировке представлений о модели атома, заключался в изучении рассеяния α -частиц различными веществами. Эти работы проводились начиная с 1908г. В лаборатории знаменитого английского физика Э.Резерфорда. В мае 1911г. Э.Резерфорд в статье «Рассеяние α- и β- частиц веществом и строение атома» предложил новую атомную модель, получившую название ядерной или планетарной: «Атом содержит центральный заряд, распределенный в очень малом объеме». Первоначально Э.Резерфорд ничего не говорил о знаке центрального заряда (к выводу о его положительном характере он пришел несколько позже), а лишь считал, что «атом имеет заряд  e в центре, окруженном наэлектризованной сферой, содержащей заряд
e в центре, окруженном наэлектризованной сферой, содержащей заряд  e, который мыслится распределенным во всей сфере радиусом R». Термин «ядро» Э.Резерфорд ввел в 1912г. Таким образом, согласно Э.Резерфорду, атом должен быть устроен так: воруг положительно заряженного ядра, в котором сосредоточена почти вся масса атом, вращаются отрицательно заряженные электроны наподобие того, как планеты вращаются вокруг Солнца. Кроме того, предварительные данные свидетельствовали, что заряды ядер различных атомов численно равны примерно половинам атомных масс соответствующих химических элементов. Но этот вывод оказался справедливым лишь для легких элементов.
e, который мыслится распределенным во всей сфере радиусом R». Термин «ядро» Э.Резерфорд ввел в 1912г. Таким образом, согласно Э.Резерфорду, атом должен быть устроен так: воруг положительно заряженного ядра, в котором сосредоточена почти вся масса атом, вращаются отрицательно заряженные электроны наподобие того, как планеты вращаются вокруг Солнца. Кроме того, предварительные данные свидетельствовали, что заряды ядер различных атомов численно равны примерно половинам атомных масс соответствующих химических элементов. Но этот вывод оказался справедливым лишь для легких элементов.
14.Волновая модель электронной оболочки по Шредингеру.(см ткже семинар и лекцию)
В 20-е годы прошлого века на смену модели Бора пришла волновая модель электронной оболочки атома, которую предложил австрийский физик Э. Шредингер. К этому времени было экспериментально установлено, что электрон имеет свойства не только частицы, но и волны. Например, видимый нашими глазами свет представляет собой электромагнитные волны. Ряд свойств таких волн есть и у электрона. Шредингер применил к электрону-волне математические уравнения, описывающие движение волны в трехмерном пространстве. Однако с помощью этих уравнений он предложил рассчитывать не траекторию движения электронов внутри атома, а вероятность найти электрон-волну в той или иной точке пространства вокруг ядра.
Общее у волновой модели Шредингера и планетарной модели Бора в том, что электроны в атоме существуют на определенных уровнях, подуровнях и орбиталях. В остальном эти модели не похожи друг на друга. В волновой модели орбиталь - это пространство около ядра, в котором можно обнаружить заселивший ее электрон с вероятностью 95%. За пределами этого пространства вероятность встретить такой электрон меньше 5%. Полученные с помощью математического расчета такие "области вероятности" нахождения в электронном облаке s-, p- и d-электронов показаны на рисунке. 
Примерно такую форму в волновой модели атома имеют "области вероятности" существования электронов: s-, p-, и d-орбитали. Ядро атома находится в точке пересечения координат. Итак, в волновой модели тоже существуют орбитали разных видов: s-орбитали (сферической формы), p-орбитали (похожие на веретено или на объемные восьмерки), а также d-орбитали (рис. 2-7) и f-орбитали еще более сложной формы. Все эти фигуры очерчивают область 95%-ной вероятности найти s-, p-, d- или f-электроны именно в том месте электронного облака, которое ограничено этими сложными фигурами. Области вероятности нахождения разных электронов могут пересекаться. К этому свойству волновой модели следует отнестись спокойно, поскольку она является не столько физической, сколько абстрактной математической моделью электронной оболочки. Однако, как мы увидим в дальнейшем, такая модель обладает хорошей предсказательной силой в отношении химических свойств атомов и молекул.
15.Вещество и поле. Корпускулярно-волновой дуализм. Гиптеза де Бройля.(см также лекцию и семинар) Вещество - это вид материи, имеющей атомарно-молекулярную или плазменную структуру. Частицы вещества имеют массу покоя, не равную нулю. Вселенная представляет собой самую крупную вещественную систему, т. е. систему объектов, состоящих из вещества. В современном представлении различают три взаимосвязанных формы материи: вещество, поле и физический вакуум. Вещество состоит из дискретных частиц, проявляющих волновые свойства. Для микрочастиц характерна двойственная корпускулярно-волновая природа. Свойства физического вакуума пока познаны намного хуже многих вещественных систем и структур. Физический вакуум обнаруживается при взаимодействии с веществом на его глубинных уровнях. Предполагается, что вакуум и вещество неразделимы и ни одна вещественная частица не может быть изолирована от его присутствия и влияния. В соответствии с концепцией самоорганизации физический вакуум выступает в роли внешней среды для Вселенной. У вещества есть четыре агрегатных состояния: § твердое; § жидкое; § газообразное; § плазма. Поле - особое состояние среды, в каждой точке которой заданы параметры, которые характеризуют состояние вещества и которые непрерывно и плавно меняются от точки к точке. Поле является материальным фактором, который приводит к взаимодействию тел. Корпускулярно-волновой дуализм -- это теория о том, что любое вещество (электромагнитное излучение, физическое тело, атом и т.п.) представляется на микроуровне одновременно и как мельчайшие частицы (корпускулы), и как волны. В истории развития учения о свете сменяли друг друга корпускулярная теория света (Ньютон) и волновая (Р. Гук, Ч. Гюйгенс, Т. Юнг, Ж. Френель), представлявшая свет как механическую волну. В 70-х годах после утверждения теории Максвелла под светом стали понимать электромагнитную волну. В начале 20-го века на основе экспериментов было неопровержимо доказано, что свет обладает как волновыми, так и корпускулярными свойствами. Было также обнаружено, что в проявлении этих свойств существуют вполне определенные закономерности: чем меньше длина волны (т.е. чем больше частота), тем сильнее проявляются корпускулярные свойства света. В 1924 г. французский физик Луи де Бройль выдвинул смелую гипотезу: корпускулярно-волновой дуализм имеет универсальный характер, т.е. и все частицы вещества, имеющие массу m и импульс p, обладают волновыми свойствами. Так в физике появилась знаменитая формула де Бройля: л=h/ (mv), где m - масса частицы, v - ее скорость, h - постоянная Планка. В настоящее время волновые свойства микрочастиц находят широкое применение, например, в электронном микроскопе. Современные электронные микроскопы позволяют видеть молекулы и даже атомы вещества (увеличение в 105-106 раз). При проявлении у микрообъекта корпускулярных свойств его волновые свойства существуют как потенциальная возможность, способная при определенных условиях перейти в действительность (диалектическое единство корпускулярных и волновых свойств материи). По современным представлениям квантовый объект - это не частица, не волна, и даже не то и другое одновременно. Квантовый объект - это нечто третье, не равное простой сумме свойств частицы и волны. Для выражения свойства квантового объекта у нас в языке просто нет соответствующих понятий. Но, поскольку сведения о микрообъекте, о его характеристиках мы получаем в результате взаимодействия его с прибором (макрообъектом), то и описывать этот микрообъект приходится в классических понятиях, т.е. используя понятия волны и частицы.
16.Элементарные частицы: основные характеристики,классификация.(см также лекцию и семинар)Термин «элементарная частица» первоначально означал простейшие, далее ни на что не разложимые частицы, лежащие в основе любых материальных образований. Позднее физики осознали всю условность термина «элементарный» применительно к микрообъектам. Сейчас уже не подлежит сомнению, что частицы имеют ту или иную структуру, но тем не менее исторически сложившееся название продолжает существовать. Основными характеристиками элементарных частиц являются масса, заряд, среднее время жизни, спин и квантовые числа. Массу покоя элементарных частиц определяют по отношению к массе покоя электрона. Существуют элементарные частицы, не имеющие массы покоя, -- фотоны. Остальные частицы по этому признаку делятся на: лептоны -- легкие частицы (электрон и нейтрино); мезоны -- средние частицы с массой в пределах от одной до тысячи масс электрона; барионы -- тяжелые частицы, чья масса превышает тысячу масс электрона и в состав которых входят протоны, нейтроны, гипероны и многие резонансы. Электрический заряд является другой важнейшей характеристикой элементарных частиц. Все известные частицы обладают положительным, отрицательным либо нулевым зарядом. Каждой частице, кроме фотона и двух мезонов, соответствуют античастицы с противоположным зарядом. В 1967 г. американский
| Агрегатные состояния вещества. |
физик М. Гелл-Манн высказал гипотезу о существовании кварков -- частиц с дробным электрическим зарядом. По времени жизни частицы делятся на стабильные и нестабильные. Стабильных частиц пять: фотон, две разновидности нейтрино, электрон и протон. Именно стабильные частицы играют важнейшую роль в структуре макротел. Все остальные частицы нестабильны, они существуют около 10-10 -- 10-24, после чего распадаются. Помимо заряда, массы и времени жизни, элементарные частицы описываются также понятиями, не имеющими аналогов в классической физике: понятием «спин», или собственный момент количества движения микрочастицы, и понятием «квантовые числа», выражающим состояние элементарных частиц. Согласно современным представлениям, все элементарные частицы делятся на два класса: фермионы (названные в честь Э. Ферми) и бозоны (названные в честь Ш. Бозе). К фермионам относятся кварки и лептоны, к бозонам -- кванты полей (фотоны, векторные бозоны, глюоны, гравитино и гравитоны). Эти частицы считаются истинно элементарными, т.е. далее неразложимыми. Остальные частицы классифицируются как условно элементарные, т.е. составные частицы, образованные из кварков и соответствующих квантов полей. Фермионы составляют вещество, бозоны переносят взаимодействие. Достижения в области исследования элементарных частиц способствовали дальнейшему развитию концепции атомизма. В настоящее время считают, что среди множества элементарных частиц можно выделить 12 фундаментальных частиц и столько же античастиц. Шесть частиц -- это кварки с экзотическими названиями: «верхний», «нижний», «очарованный», «странный», «истинный», «прелестный». Остальные шесть -- лептоны: электрон, мюон, тау-частица и соответствующие им нейтрино (электронное, мюонное, тау-нейтрино). Эти 12 частиц группируют в три поколения, каждое из которых состоит из четырех членов. В первом поколении -- «верхний» и «нижний» кварки, электрон и электронное нейтрино. Во втором поколении -- «очарованный» и «странный» кварки, мюон и мюонное нейтрино. В третьем поколении -- «истинный» и «прелестный» кварки и тау-частицы со своим нейтрино. Обычное вещество состоит из частиц первого поколения. Предполагается, что остальные поколения можно создать искусственно на ускорителях заряженных частиц. На основе кварковой модели физики разработали простое и изящное решение проблемы строения атомов. Каждый атом состоит из тяжелого ядра (сильно связанных глюонными полями протонов и нейтронов) и электронной оболочки. Число протонов в ядре равно порядковому номеру элемента в периодической таблице химических элементов Д.И. Менделеева. Протон имеет положительный электрический заряд, массу в 1836 раз больше массы электрона, размеры порядка 10-13 см. Электрический заряд нейтрона равен нулю. Протон, согласно кварковой гипотезе, состоит из двух «верхних» кварков и одного «нижнего», а нейтрон -- из одного «верхнего» и двух «нижних» кварков. Их нельзя представить в виде твердого шарика, скорее, они напоминают облако с размытыми границами, состоящее из рождающихся и исчезающих виртуальных частиц.
Остаются еще вопросы о происхождении кварков и лептонов, о том, являются ли они основными «кирпичиками» природы и насколько фундаментальны. Ответы на эти вопросы ищут в современной космологии. Большое значение имеет исследование рождения элементарных частиц из вакуума, построение моделей первичного ядерного синтеза, породивших те или иные частицы в момент рож
17.Химические свойства атома. Виды химической связи. Атомное строение тел. Различные состояния вещества (газ,жидкость,твердое тело,плазма).
На сегодня атомы обозначаются следующим стандартным образом: 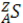 , где S - символ атома, Z - атомный номер, равный числу протонов (т.е. заряду ядра), A=Z+N - массовое число, где N - число нейтронов. Таким образом, массовое число показывает полное число нуклонов. Ясно, что изотопы химических элементов имеют ядра с разным числом нейтронов, следовательно, различаются их массовые числа. В качестве примера приведем некоторые сведения об изотопах урана: В природных условиях радиоактивность урана обусловлена изотопом 234U. Химические элементы, особенно их сочетания, во многом определяют свойства вещества, что отчетливо проявляется для многоатомных соединений. Например, рассмотрим ряд на основе водорода: H2, H2O, HCl, CH4,. Первое соединение из двух атомов водорода - газ, второе – вода, получается при присоединении к двум атомам водорода одного атома кислорода, третье соединение - добавили водороду атом хлора и получили газ, при растворении в воде образующий соляную кислоту, четвертое - углеводород, состоящий из углерода и водорода и т.п. (естественно, все вещества находятся при нормальных условиях). Многие (но далеко не все!) свойства химических элементов, а тем более соединений можно получить из анализа «таблицы Менделеева». Не вдаваясь в детали, известные из школьных курсов химии и физики, вспомним строение нескольких первых атомов: Химические свойства атома (то есть то, какого рода связи будут образованы с другими атомами) определяются числом электронов в наружном слое. Так, у водорода и лития только по одному внешнему электрону, поэтому в химических реакциях они ведут себя похоже. В свою очередь, гелий и неон оба имеют заполненные внешние оболочки, и тоже ведут себя похоже, но совершенно не так, как водород и литий. Окружающий нас мир состоит из 92 элементов (в 1930-е годы они все уже были открыты) — от водорода (атомный номер Z=1) до урана (Z=92), которые представлены 287 стабильными изотопами, т.е. химические элементы вплоть до урана (содержит 92 протона и 92 электрона) встречаются в природе. Начиная с номера 93 идут искусственные элементы, созданные в лаборатории. К середине 1990-х годов было синтезировано уже 109 элементов (открыты тяжелые трансурановые элементы, которые живут очень короткое время). Время жизни радиоактивных изотопов уменьшается до тех пор, пока существует ядро атома: расчеты показывают, что может существовать около 5000 радиоактивных ядер. Названия новым элементам даются в честь великих ученых или названий мест расположения научных центров: 101-й элемент – менделевий, 102-й - нобелий, 103-й - лоуренсий, 104-й - дубний, 105-й - жолиотий, 106-й - сиборгий, 107-й - борий, 108-й - хассий, 109-й – мейтнерий, 110-й – дармштатдий, 111-й - рентгений, 112-й – коперникий, 113 – 118 пока не названы. Пока самый большой заявленный учеными номер — 118. У любознательного студента может возникнуть вопрос: а сколько всего может быть элементов? Элементы, стоящие в таблице за ураном, - искусственного происхождения. Чем выше их атомный номер, тем быстрее они распадаются. Но жизнь сверхтяжелых элементов стала, напротив, увеличиваться – появились "острова стабильности". С другой стороны, казалось бы, можно оценить электростатические силы притяжения внутренних электронов атомов к положительно заряженному ядру. Для тяжелых элементов, имеющих большой заряд ядра, электронная «шуба» сильнее сжимается, сильнее притягиваются внутренние электроны к ядру и электроны начнут захватываться ядром. Но законы квантовой механики показывают, что нет ограничений для существования очень тяжелых элементов с точки зрения представлений о строении электронных оболочек. Ограничения возникают в результате неустойчивости самих ядер.Перейдем от разрозненных химических элементов к химическим соединениям, чтобы понять, чем определяются свойства материалов. Напомним, что химическое соединение - это вещество, состоящее из атомов одного или нескольких сортов, которые объединены в частицы - молекулы, комплексы, кристаллы или иные агрегаты. Различают соединения постоянного состава (дальтониды) и переменного (бертоллиды). Молекула - наименьшая частица вещества, которая полностью определяет его свойства и в то же время существует самостоятельно. Причина образования химических соединений заключается в различной физической природе химических сил, объединяющих атомы в молекулу как единую квантово-химическую систему. Химическая связь обусловлена обменным взаимодействием электронов (обобщение валентных электронов). Теперь химическое соединение можно трактовать как вещество, состоящее из одного или нескольких химических элементов, атомы которых за счет обменного взаимодействия (химической связи) объединены в частицы - молекулы, комплексы, монокристаллы или иные агрегаты. Укажем, что химическое соединение может состоять и из атомов одного элемента например, кислород, алмаз и т.л. Различают четыре вида химической связи - ионную, ковалентную, металлическую и водородную. 1. Ионная связь Ионная связь: один из атомов легко отдает электрон с внешней оболочки, а атом другого сорта легко принимает к себе этот электрон. Образовавшиеся ионы (катион - положительно заряженная частица и анион - отрицательно заряженная) за счет сил электростатического взаимодействия притягивают друг друга. Например, в кристалле NaCl катионы
, где S - символ атома, Z - атомный номер, равный числу протонов (т.е. заряду ядра), A=Z+N - массовое число, где N - число нейтронов. Таким образом, массовое число показывает полное число нуклонов. Ясно, что изотопы химических элементов имеют ядра с разным числом нейтронов, следовательно, различаются их массовые числа. В качестве примера приведем некоторые сведения об изотопах урана: В природных условиях радиоактивность урана обусловлена изотопом 234U. Химические элементы, особенно их сочетания, во многом определяют свойства вещества, что отчетливо проявляется для многоатомных соединений. Например, рассмотрим ряд на основе водорода: H2, H2O, HCl, CH4,. Первое соединение из двух атомов водорода - газ, второе – вода, получается при присоединении к двум атомам водорода одного атома кислорода, третье соединение - добавили водороду атом хлора и получили газ, при растворении в воде образующий соляную кислоту, четвертое - углеводород, состоящий из углерода и водорода и т.п. (естественно, все вещества находятся при нормальных условиях). Многие (но далеко не все!) свойства химических элементов, а тем более соединений можно получить из анализа «таблицы Менделеева». Не вдаваясь в детали, известные из школьных курсов химии и физики, вспомним строение нескольких первых атомов: Химические свойства атома (то есть то, какого рода связи будут образованы с другими атомами) определяются числом электронов в наружном слое. Так, у водорода и лития только по одному внешнему электрону, поэтому в химических реакциях они ведут себя похоже. В свою очередь, гелий и неон оба имеют заполненные внешние оболочки, и тоже ведут себя похоже, но совершенно не так, как водород и литий. Окружающий нас мир состоит из 92 элементов (в 1930-е годы они все уже были открыты) — от водорода (атомный номер Z=1) до урана (Z=92), которые представлены 287 стабильными изотопами, т.е. химические элементы вплоть до урана (содержит 92 протона и 92 электрона) встречаются в природе. Начиная с номера 93 идут искусственные элементы, созданные в лаборатории. К середине 1990-х годов было синтезировано уже 109 элементов (открыты тяжелые трансурановые элементы, которые живут очень короткое время). Время жизни радиоактивных изотопов уменьшается до тех пор, пока существует ядро атома: расчеты показывают, что может существовать около 5000 радиоактивных ядер. Названия новым элементам даются в честь великих ученых или названий мест расположения научных центров: 101-й элемент – менделевий, 102-й - нобелий, 103-й - лоуренсий, 104-й - дубний, 105-й - жолиотий, 106-й - сиборгий, 107-й - борий, 108-й - хассий, 109-й – мейтнерий, 110-й – дармштатдий, 111-й - рентгений, 112-й – коперникий, 113 – 118 пока не названы. Пока самый большой заявленный учеными номер — 118. У любознательного студента может возникнуть вопрос: а сколько всего может быть элементов? Элементы, стоящие в таблице за ураном, - искусственного происхождения. Чем выше их атомный номер, тем быстрее они распадаются. Но жизнь сверхтяжелых элементов стала, напротив, увеличиваться – появились "острова стабильности". С другой стороны, казалось бы, можно оценить электростатические силы притяжения внутренних электронов атомов к положительно заряженному ядру. Для тяжелых элементов, имеющих большой заряд ядра, электронная «шуба» сильнее сжимается, сильнее притягиваются внутренние электроны к ядру и электроны начнут захватываться ядром. Но законы квантовой механики показывают, что нет ограничений для существования очень тяжелых элементов с точки зрения представлений о строении электронных оболочек. Ограничения возникают в результате неустойчивости самих ядер.Перейдем от разрозненных химических элементов к химическим соединениям, чтобы понять, чем определяются свойства материалов. Напомним, что химическое соединение - это вещество, состоящее из атомов одного или нескольких сортов, которые объединены в частицы - молекулы, комплексы, кристаллы или иные агрегаты. Различают соединения постоянного состава (дальтониды) и переменного (бертоллиды). Молекула - наименьшая частица вещества, которая полностью определяет его свойства и в то же время существует самостоятельно. Причина образования химических соединений заключается в различной физической природе химических сил, объединяющих атомы в молекулу как единую квантово-химическую систему. Химическая связь обусловлена обменным взаимодействием электронов (обобщение валентных электронов). Теперь химическое соединение можно трактовать как вещество, состоящее из одного или нескольких химических элементов, атомы которых за счет обменного взаимодействия (химической связи) объединены в частицы - молекулы, комплексы, монокристаллы или иные агрегаты. Укажем, что химическое соединение может состоять и из атомов одного элемента например, кислород, алмаз и т.л. Различают четыре вида химической связи - ионную, ковалентную, металлическую и водородную. 1. Ионная связь Ионная связь: один из атомов легко отдает электрон с внешней оболочки, а атом другого сорта легко принимает к себе этот электрон. Образовавшиеся ионы (катион - положительно заряженная частица и анион - отрицательно заряженная) за счет сил электростатического взаимодействия притягивают друг друга. Например, в кристалле NaCl катионы 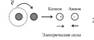 Na+ притягивают анионы Cl-.
Na+ притягивают анионы Cl-.  2. Ковалентная связь Ковалентная связь: ни один из атомов не может полностью отдать электрон. В этом случае происходит частичное “объединение” электронов, т.е. электрон проводит часть времени у “своего” старого ядра, а часть времени - у нового.
2. Ковалентная связь Ковалентная связь: ни один из атомов не может полностью отдать электрон. В этом случае происходит частичное “объединение” электронов, т.е. электрон проводит часть времени у “своего” старого ядра, а часть времени - у нового. 
3. Металлическая связь Металлическая связь: в этом случае происходит полное обобществление электронов, ядра как бы находятся в “электронном газе” (или “жидкости”). При этом электроны могут легко двигаться, что и объясняет малое электрическое сопротивление металлов  . 4. Водородная связь Водородная связь: проявляется как результат взаимодействия атома водорода с электроотрицательным атомом и неподеленной парой электронов другого атома. Водородная связь приводит к ассоциации одинаковых или различных молекул в различные комплексы; она во многом определяет свойства воды и льда, молекулярных кристаллов, структуру и свойства белков, нуклеиновых кислот и др.
. 4. Водородная связь Водородная связь: проявляется как результат взаимодействия атома водорода с электроотрицательным атомом и неподеленной парой электронов другого атома. Водородная связь приводит к ассоциации одинаковых или различных молекул в различные комплексы; она во многом определяет свойства воды и льда, молекулярных кристаллов, структуру и свойства белков, нуклеиновых кислот и др. 
В природе перечисленные типы связей в «чистом виде» проявляются редко, в большинстве соединений имеет место наложение разных типов связей. Атомное строение тел. Различные состояния вещества. Кроме того, что свойства соединения зависят от его состава, очевидно, что большое значение имеет атомное строение тел, т.е. расположение атомов в пространстве. Действительно, напомним самый простой пример: хотя вода и лед имеют один и тот же химический состав, свойства их существенно различны. Очевидно, что с понятием структуры связаны и агрегатные состояния вещества. Большинство веществ может существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Например – вода, которая при обычном давлении (p= 760 мм рт.ст.) может находиться в виде льда (при t < 0ОС), жидкости (от нуля до 100ОС) и водяного пара (при t>100OC). Четвёртым агрегатным состоянием вещества считают плазму.Переход из одного агрегатного состояния вещества в другое сопровождается скачкообразным изменением расстояний между молекулами (атомами) (и, как следствие) межмолекулярных взаимодействий. Как известно, в любом веществе его частицы (молекулы, атомы) находятся в непрерывном движении, и степень (интенсивность) этого движения характеризует температура. С другой стороны, эти частицы взаимодействуют между собой благодаря наличию химических связей. При низких температурах энергия связей частиц больше энергии тепловых колебаний частицы, частицы не могут «удалиться» друг от друга на большие (конечно, по сравнению с размерами атомов, т.е. 10-8см) расстояния - вещество существует в твердом состоянии. Зачастую частицы образуют правильную геометрическую структуру, в таком случае, говорят о кристаллической структуре. У твёрдых тел в кристаллообразном состоянии атомы совершают только колебания около равновесных положений, или узлов кристаллической решётки; структура этих тел характеризуется высокой степенью упорядоченности — дальним и ближним порядком. Если дальний порядок отсутствует, то имеем аморфное состояние (например, стекло).
При повышении температуры энергия тепловых колебаний частиц возрастает, энергия тепловых колебаний увеличивается и энергии связей уже недостаточно, чтобы удерживать частицы. Связи между частицами постоянно разрушаются и вновь образуются, частицы начинают двигаться не только около положений равновесия, но и перемещаться на достаточно большие расстояния. Однако они еще остаются в контакте, хотя правильная геометрическая структура частиц нарушается — вещество существует в жидком состоянии. Иными словами, молекулы (атомы) колеблются около положений равновесия и совершают перескоки из одного положения равновесия в другое. При этом в жидкостях наблюдается порядок только в расположении
ближайших частиц (ближний порядок, в отличие от дальнего порядка в кристаллах), а также свойственные им подвижность и текучесть.
При дальнейшем повышении температуры тепловые колебания увеличиваются, в результате молекулы практически не взаимодействуют друг с другом и движутся фактически свободно, заполняя весь объём. Вещество переходит в газообразное состояние. В “идеальном” газе частицы свободно перемещаются во всех направлениях.
Если еще сильнее повысить температуру (до тысяч или даже десятков тысяч градусов, то удастся «разрушить» атомы и перевести вещество в четвертое состояние - плазму, которая представляет собой газ, состоящий из смеси нейтральных и ионизованных молекул и электронов. Таким образом, при переходах твердое тело ® жидкость ® газ ® плазма происходит «уничтожение» порядка на различных уровнях.
Указанные четыре основные состояния вещества - плазменное, газообразное, жидкое и твердое (перечисленные в порядке существования при понижении температуры), известны давно, однако на сегодня ученые выделяют еще два состояния – низкотемпературные конденсаты. Конденсат - новое состояние вещества при сверхнизких температурах - меньше 0.00000001 К (!!!), т.е. при температурах ниже температуры космического вакуума (в космосе температура около 3 К).
18.Естественнонаучная картина мира: механическая картина мира (МКМ). Естественнонаучная картина мира (ЕНКМ) - это система важнейших принципов и законов, лежащих в основе окружающего нас мира. Механическая картина мира (МКМ). Формирование МКМ происходило в течение нескольких столетий до середины XIX века под сильным влиянием взглядов выдающихся мыслителей древности:
Демокрита, Эпикура, Аристотеля, Лукреция и др. Она явилась необходимым и очень важным шагом на пути познания природы. Имена учёных, внесших основной вклад в создание МКМ: Н.Коперник, Г.Галилей, Р.Декарт, И.Ньютон, П.Лаплас и др.
Основные черты механической картины мира: § все материальные тела состоят из молекул, находящихся в непрерывном и хаотическом механическом движении. Материя - вещество, состоящее из неделимых частиц; § взаимодействие тел осуществляется согласно принципа дальнодействия, мгновенно на любые расстояния (закон всемирного тяготения, закон Кулона), или при непосредственном контакте (силы упругости, силы трения); § пространство - пустое вместилище тел. Всё пространство заполняет невидимая невесомая «жидкость» - эфир; § время - простая длительность процессов. Время абсолютно; § всё движение происходит на основе законов механики Ньютона, все наблюдаемые явления и превращения сводятся к механическим перемещениям и столкновениям атомов и молекул; § мир выглядит как колоссальная машина с множеством деталей, рычагов, колёсиков. Достоинство МКМ состоит в том, что это первая научная картина мира.
19.Естественнонаучная картина мира: электромагнитная картина мира (ЭМКМ). Естественнонаучная картина мира (ЕНКМ) - это система важнейших принципов и законов, лежащих в основе окружающего нас мира.
Электромагнитная картина мира (ЭМКМ).
В XIX веке естественные науки накопили огромный эмпирический материал, нуждающийся в переосмыслении и обобщении. Многие полученные в результате исследований научные факты не совсем вписывались в устоявшиеся механические представления об окружающем мире. Во второй половине XIX века на основе исследований в области электромагнетизма сформировалась новая физическая картина мира - электромагнитная картина мира (ЭМКМ). В её формировании сыграли решающую роль исследования, проведённые выдающимися учёными М. Фарадеем и Дж. Максвеллом, Г. Герцем. Весь мир заполнен электромагнитным эфиром, который может находиться в различных состояниях. Физические поля трактовались как состояния эфира. Эфир является средой для распространения электромагнитных волн и, в частности, света. Материя существует в двух видах: вещество и поле.
Вещество - это вид материи, имеющей атомарно-молекулярную или плазменную структуру. Частицы вещества имеют массу покоя, не равную нулю. Поле - это особый вид материи, посредством которого осуществляются электромагнитные взаимодействия; представляющий собой единство электрического и магнитного полей. 1. Материя считается непрерывной. Все законы природы сводятся к уравнениям Дж. Максвелла, описывающим непрерывную субстанцию: природа не делает скачков. Вещество состоит из электрически заряженных частиц, взаимодействующих между собой посредством полей. 2. На основе электромагнитных взаимодействий объясняются все известные механические, электрические, магнитные, химические, тепловые, оптические явления. 20.Естественнонаучная картина мира: современная - квантово-релятивистская (квантово-полевая) картина мира (КПКМ).\ Естественнонаучная картина мира (ЕНКМ) - это система важнейших принципов и законов, лежащих в основе окружающего нас мира. Как и все предшествующие картины мира, КПКМ представляет собой процесс дальнейшего развития и углубления наших знаний о сущности физических явлений. Процесс становления и развития КПКМ продолжается и прошел уже ряд стадий, в частности: 1)утверждение корпускулярно-волновых представлений о материи;2)изменение методологии познания и отношения к физической реальности; Пояснение: ранее считалось, что устройство мира можно познавать, не вмешиваясь в него, не влияя на протекающие в нем процессы, т.е. находясь как бы вне его, вне абсолютной физической реальности. Эйнштейн не включал в понятие «физическая реальность» акт наблюдения, а Бор считал его важным элементом физической реальности. Картина реальности в квантовой механике становится как бы двуплановой: с одной стороны в нее входят характеристики исследуемого объекта, а с другой - условия наблюдения. Таким образом, в КПКМ появляется принцип относительности к средствам наблюдения. Все рассмотренные ранее картины мира отличались своей трактовкой таких фундаментальных понятий как пространство и время, движение, принцип причинности, взаимодействия. Рассмотрим, как они представлены в КПКМ. Пространство и время. При рассмотрении МКМ подчеркивалось, что пространство и время в ней абсолютны и независимы друг от друга. Для характеристики объекта в пространстве вводились три пространственные координаты (x,y,z), а для обозначения времени независимо от них вводилась одна временная координата t. В СТО и ЭМКМ они потеряли абсолютный и независимый характер. Появилось новое пространство-время как абсол