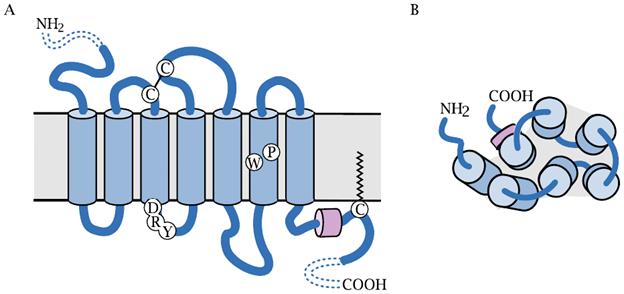
GPCR(G-белок-связанный рецептор) представляют собой белки, интегрированные в плазматическую мембрану и состоящие из связки семи гидрофобных спиралей, проходящих через нее. При этом N-концевые участки спиралей находятся вне клетки, а С-концевые — со стороны цитозоля.
Связывание агониста с внеклеточной стороны рецептора вызывает перегруппировку спиралей, в результате которой меняется структура сайта связывания для гетеротримера G-белка со стороны цитоплазмы, и эта измененная конформация связывающей поверхности G-белка способствует его активации.(Когда рецептор находится в состоянии покоя, три субъединицы G-белка и гуанозиндифосфат (ГДФ) прочно связаны с альфа-субъединицей G-белка. Связывание агониста приводит к конформационным изменениям рецептора, что, в свою очередь, вызывает конформационное изменение G-белка, ведущее к диссоциации ГДФ от альфа-субъединицы. Это инициирует последовательность реакций и способствует трансдукции G-белок-связанного рецептора.)
.
.
G-белки являются гетеротримерами; их субъединицы обозначаются греческими буквами α, β и γ.Гетеротример Gαβγ называется по своей а-субъединице, которая в основном определяет селективность G-белка среди рецепторов
К наиболее распространённым клеточным рецепторам этого типа относят вазопрессиновые и ангиотензиновые, α-адренорецепторы, β-адренорецепторы и м-холинорецепторы, опиатные и дофаминовые. Все вышеперечисленные рецепторы - мишени ЛС, составляющих обширные фармакологические группы.
Различают два типа рецепторов к вазопрессину, посредством которых он оказывает действие, – V1 (А- и В-подтипы) и V2. Вазопрессиновые рецепторы связаны с гетеротримерными Gq-белками и стимулируют фосфолипазно-кальциевый механизм передачи гормонального сигнала. Они представлены во многих клетках периферических органов и тканей.
V1A-рецепторы локализованы в гладких мышцах сосудов и в печени, а также в центральной нервной системе.
V1B-рецепторы экспрессируются в передней доле гипофиза (аденогипофизе) и головном мозге, где вазопрессин выступает в роли нейромедиатора.
V2-рецепторы связаны с Gsбелками и стимулируют аденилатциклазный механизм передачи гормонального сигнала, локализованы преимущественно в почках (Десмопрессин – синтетический аналог человеческого гормона вазопрессина, который способствует концентрированию мочи в ночное время за счет воздействия на специфические V2- рецепторы в дистальных канальцах почек.)
Этапы передачи сигнала
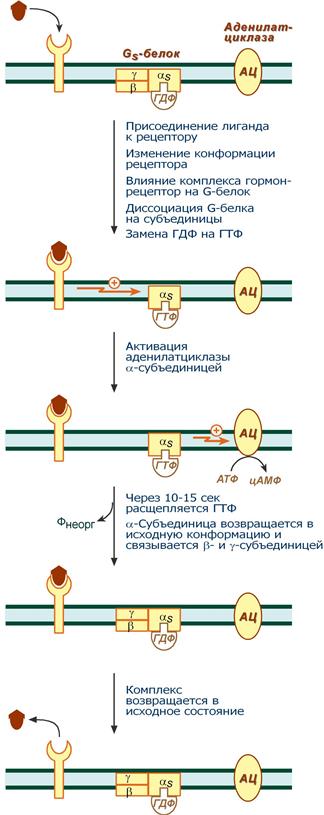
Этапы передачи сигнала выглядят следующим образом:
1. Взаимодействие лиганда с рецептором приводит к изменению конформации последнего. Это изменение передается на G-белок (GTP, ГТФ-зависимый), который состоит из трех субъединиц (α, β и γ), α-субъединица связана с ГДФ.
В составе G-белков α-субъединицы бывают двух типов по отношению к аденилатциклазе: активирующие αs и ингибирующие αi.
Например, в случае действия адреналина с активирующей субъединицей αs взаимодействуют β-адренорецепторы, с ингибирующей – α2-адренорецепторы.
2. В результате взаимодействия с рецептором β- и γ -субъединицы отщепляются, одновременно на α- субъединице ГДФ заменяется на ГТФ.
3. Активированная таким образом αs-субъединица стимулирует аденилатциклазу, которая начинает синтез цАМФ. Если в действо была вовлечена αi-субъединица, то она ингибирует аденилатциклазу, все останавливается.
4. Циклический АМФ (цАМФ) – вторичный мессенджер – в свою очередь связывается с регуляторными (R) субъединицами протеинкиназы А и вызывает их диссоциацию от каталитических. В результате каталитические (C) субъединицы становятся активными..
Протеинкиназа А (ПК А) фосфорилирует ряд ферментов, среди которых киназа фосфорилазы гликогена, гликогенсинтаза, гормончувствительная липаза, транскрипционный фактор CREB (cAMP-response element-binding protein).
5. Наработка цАМФ продолжается некоторое время, пока α-субъединица, которая является ГТФ-азой, отщепляет фосфат от ГТФ.
6. Как только ГТФ превратился в ГДФ, то α-субъединица инактивируется, теряет свое влияние на аденилатциклазу, обратно соединяется с β- и γ-субъединицами.
7. Все возвращается в исходное положение.
Антагонисты рецепторов ангиотензина II, или блокаторы АТ1-рецепторов — одна из новых групп антигипертензивных средств. Она объединяет лекарственные средства, модулирующие функционирование ренин-ангиотензин-альдостероновой системы (РААС) посредством взаимодействия с ангиотензиновыми рецепторами.
К настоящему времени установлено существование нескольких подтипов ангиотензиновых рецепторов: АТ1, АТ2, АТ3 и АТ4 и др.
У человека идентифицированы и наиболее полно изучены два подтипа мембраносвязанных, сопряженных с G-белком рецепторов ангиотензина II — подтипы АТ1 и АТ2.
АТ1-рецепторы локализуются в различных органах и тканях, преимущественно в гладкой мускулатуре сосудов, сердце, печени, коре надпочечников, почках, легких.
Большинство физиологических эффектов ангиотензина II, включая и неблагоприятные, опосредуется АТ1-рецепторами:повышение гидравлического давления в почечных клубочках,усиление реабсорбции натрия в проксимальных почечных канальцах,секреция альдостерона корой надпочечников,пролиферация гладкомышечных клеток сосудов, гиперплазия интимы, гипертрофия кардиомиоцитов, стимуляция процессов ремоделирования сосудов и сердца.
Эффекты ангиотензина II, опосредуемые АТ2-рецепторами, были обнаружены лишь в последние годы.Большое количество в тканях плода (в т.ч. и в мозге). В постнатальном периоде количество АТ2-рецепторов в тканях человека уменьшается
.
По наличию фармакологической активности блокаторы АТ1-рецепторов делят на:активные лекарственные формы и пролекарства.
По механизму связывания с рецепторами блокаторы АТ1-рецепторов (а также их активные метаболиты) делят на конкурентные и неконкурентные антагонисты ангиотензина II. Так, лозартан и эпросартан обратимо связываются с АТ1-рецепторами и являются конкурентыми антагонистами (т.е. при определенных условиях, например, при повышении уровня ангиотензина II, могут вытесняться из мест связывания), тогда как валсартан, идействуют как неконкурентные антагонисты и связываются с рецепторами необратимо.
Для адренорецепторов характерна разная чувствительность к химическим соединениям, и поэтому их делят на α (α1, α2) и β (β1, β2, β3). Как правило, при стимуляции α-адренорецепторов обычно наблюдается усиление функции эффекторного органа, а при возбуждении β-адренорецепторов – снижение. Таким образом, эффект раздражения симпатических нервов зависит от количественного соотношения в тканях α- и β-адренорецепторов.
Типы рецепторов, их локализация и эффекты, возникающие при их стимуляции.
α1-адренорецепторы находятся в сосудах кожи, почек, кишечника, сердца и др., в селезенке, радиальной мышце радужки. При их возбуждении происходит спазм и сокращение.
α2-адренорецепторы находятся на пресинаптической мембране синапсов симпатической нервной системы, в ЦНС. При их возбуждении снижается высвобождение норадреналина и угнетение сосудодвигательного центра.
β1-адренорецепторы расположены в миокарде, синусовом узле, атриовентрикулярном узле, печени и скелетных мышцах. При их возбуждении происходит увеличение силы сердечных сокращений, повышение возбудимости и проводимости, стимуляция гликогенолиза.
β2-адренорецепторы находятся в артериолах скелетных мышц, печени, коронарных сосудах и др., в бронхах, матке, жировой ткани, на пресинаптической мембране синапсов симпатической нервной системы. При их возбуждении происходит расслабление сосудов, снижается тонус
Основные направления фармакологического воздействия на адренергическую передачу нервного импульса заключаются в изменении процесса высвобождения норадреналина из пресинаптических окончаний и взаимодействии препарата с постсинаптическими адренорецепторами. Препараты, стимулирующие адренорецепторы, называют адреномиметиками, а угнетающие – адреноблокаторами (адренолитиками).
Адреномиметики
По преимущественному влиянию на α- или β-адренорецепторы адреномиметики подразделяют на:
• α -адреномиметики (средства, преимущественно стимулирующие а - адренорецепторы);
• β-адреномиметики (средства, преимущественно стимулирующие β - адренорецепторы);
• α -, β-адреномиметики (средства, стимулирующие а - и β-адренорецепторы).
α -Адреномиметики
По преимущественному влиянию на а1- или а2-адренорецепторы делят на а1-адреномиметики и а2-адреномиметики.
α1-Адренорецепторы локализованы на постсинаптической мембране эффекторных клеток, получающих симпатическую иннервацию: гладкомышечных клеток сосудов, радиальной мышцы радужки, сфинктера мочевого пузыря, простатической части уретры, предстательной железы.
Стимуляция α1-адренорецепторов (связанных с Gg-белками) вызывает сокращение гладких мышц
α2 -Адреномиметики (стимуляторы α2 -адренорецепторов)
а2-Адренорецепторы находятся в сосудах в основном вне синапсов. Стимуляция внесинаптических а2-адренорецепторов (связанных с Gi-белками, угнетающими аденилатциклазу) уменьшает уровень цАМФ и активность протеинкиназы А. В результате повышается активность киназы легких цепей миозина и фосфорилирование легких цепей миозина под действием этого фермента, что облегчает взаимодействие актина с миозином и приводит к сокращению гладких мышц кровеносных сосудов.
βγ-Адреномиметики (стимуляторы βγ-адренорецепторов)
β1-Адренорецепторы преимущественно локализованы в сердце в мембране кардиомиоцитов. Стимуляция β1-aдренорецепторов (связанных с Gs-белками) приводит к увеличению поступления Са2+ в кардиомиоциты через кальциевые каналы - в результате концентрация цитоплазматического кальция повышается
Увеличение поступления Са2+ в кардиомиоциты повышает, частоту сокращений сердца, в атриовентрикулярном узле это приводит к облегчению атриовентрикулярной проводимости и повышению автоматизма, повышается также автоматизм волокон Пуркинье. В клетках рабочего миокарда кальций связывается с тропонином С, который является составной частью тропонин-тропомиозинового комплекса. При этом происходит изменение конформации комплекса и устраняется его тормозное влияние на сократительные белки миокарда, облегчается взаимодействие актина с миозином, что приводит к увеличению силы сердечных сокращений.
При стимуляции β1-aдренорецепторов юкстагломерулярных клеток почек увеличивается секреция ренина, вследствие чего повышается образование ангиотензина II.
β2- Адреномиметики (стимуляторы β2 -адренорецепторов)
Внесинаптические β2-aдренорецепторы в основном находятся в мембранах гладкомышечных клеток бронхов, матки, кровеносных сосудов. При стимуляции этих рецепторов (связанных с Gs-белками, стимулирующими аденилатциклазу) происходит расслабление гладких мышц бронхов, снижается тонус и сократительная активность миометрия, расширяются кровеносные сосуды. Расслабление гладких мышц при стимуляции β2-aдренорецепторов связано с повышением уровня цАМФ в гладкомышечных клетках, что приводит к активации цАМФ-зависимой протеинкиназы А, которая угнетает киназу легких
цепей миозина, в результате не происходит фосфорилирования легких цепей миозина и нарушается взаимодействие актина с миозином. Кроме того, при повышении уровня цАМФ в гладкомышечных клетках снижается концентрация кальция, что также приводит к снижению тонуса и сократительной активности гладких мышц.
Стимуляторы β2-адренорецепторов - одна из основных групп ЛС, применяемых при лечении бронхообструктивных заболеваний.
.
М-холиномиметики стимулируют М-холинорецепторы, расположенные в мембране клеток эффекторных органов и тканей, получающих парасимпатическую иннервацию. М-холинорецепторы подразделяют на несколько подтипов, которые проявляют неодинаковую чувствительность к разным фармакологическим веществам. Обнаружено 5 подтипов М-холинорецепторов (М1, М2, М3, М4, М5). Наиболее подробно изучены М1-, М2- и М3-холинорецепторы. Все М-холинорецепторы относятся к мембранным рецепторам, взаимодействующим с G-белками, а через них с определенными ферментами или ионными каналами.
М1-холинорецепторы также сопряжены с Gq-белками. Стимуляция М1-холинорецепторов клеток желудка приводит к повышению концентрации цитоплазматического Са2+ и увеличению секреции этими клетками гистамина. Гистамин в свою очередь, действуя на париетальные клетки желудка, стимулирует секрецию хлористоводородной кислоты.
М2-холинорецепторы мембран кардиомиоцитов взаимодействуют с Gi-белками, угнетающими аденилатциклазу. При их стимуляции в клетках снижается синтез цАМФ и, как следствие, активность цАМФ-зависимых протеинкиназ, фосфорилирующих белки. В кардиомиоцитах нарушается фосфорилирование кальциевых каналов, в результате меньше Са2+ поступает в клетку во время деполяризации мембраны. Это приводит к снижению автоматизма синоатриального узла и, следовательно, к уменьшению частоты сердечных сокращений. Кроме того, при стимуляции М2-холинорецепторов активируются калиевые каналы и усиливается выход калия из клетки, что приводит к гиперполяризации мембраны и развитию тормозных эффектов.
М3-холинорецепторы гладкомышечных клеток и клеток экзокринных желез взаимодействуют с Gq-белками, которые активируют фосфолипазу С. При участии этого фермента из фосфолипидов клеточных мембран образуется инозитол-1,4,5-трифосфат, который способствует высвобождению Са2+ из саркоплазматического/эндоплазматического ретикулума (внутриклеточного депо кальция). В результате при стимуляции М3-холинорецепторов концентрация Са2+ в цитоплазме клеток увеличивается, что вызывает повышение тонуса гладких мышц внутренних органов и увеличение секреции экзокринных желез. Кроме того, в мембране эндотелиальных клеток сосудов располагаются неиннервируемые (внесинаптические) М3-холинорецепторы. При их стимуляции увеличивается высвобождение из эндотелиальных клеток эндотелиального релаксирующего фактора (NO), который вызывает расслабление гладкомышечных клеток сосудов. Это приводит к снижению тонуса сосудов и уменьшению АД.
Экзогенные опиоиды поступают в организм извне и связываются с опиоидными рецепторами. Первым открытым опиоидом был морфин. Механизм действия агонистов опиатных рецепторов заключается в стимулировании ими рецепторов: μ- (мю), κ- (каппа) и δ- (дельта).
Стимуляция μ-рецепторов приводит к возникновению супраспинальной анальгезии и эйфории, угнетению дыхания и формированию лекарственной зависимости (при длительном применении).
Стимуляция κ-рецепторов вызывает супраспинальную анальгезию, миоз, седацию.
Все препараты этой группы обладают выраженным анальгезирующим действием.
Дофаминовые рецепторы присутствуют как в центральной нервной системе, так в периферических органах. Дофаминомиметики.
Эти вещества подразделяются на две группы:
1) непрямого действия, влияющие на пресинаптические дофаминовые рецепторы, регулирующие синтез и выделение дофамина и норадреналина;
2) прямого действия, влияющие на постсинаптические дофаминовые рецепторы.
К первой группе непрямого действия из отечественных препаратов относятся леводопа, мидантан и другие, стимулирующие синтез дофамина и предположительно задерживающие его разрушение, способствующие освобождению дофамина из гранул пресинаптических окончаний, применяемые для лечения болезни Паркинсона.
Вторая группа – психостимуляторы, обладающие дофаминергическими свойствами (фенамин (амфетамин)), способствующие освобождению дофамина и норадреналина из гранул пресинаптических нервных окончаний и тормозящие обратный нейрональный захват дофамина. Меридил (метилфенидат) – психостимулятор, обладающий способностью освобождать дофамин из гранул пресинаптических нервных окончаний.
Дофаминолитики.
Препараты нейролептического действия, блокирующие постсинаптические дофаминовые рецепторы с одновременным блокированием пресинаптических дофаминовых рецепторов. Считается, что подавление дофаминергической передачи нервных импульсов в различных областях ЦНС вызывает различия в спектре психотропной активности и характере побочных эффектов препаратов этой группы.

Связывание лекарственного средства с рецептором может быть двух типов:
1. Реверсивное связывание
2. Необратимое связывание
При обратимом связывании связь между препаратом и рецептором очень слабая ионная, водородная или Ван-дер-вальсовая. Этот эффект недолговечен.
При необратимом связывании присутствуют очень сильные ковалентные связи, что продлевает действие препарата. Эффект продолжается до тех пор, пока препарат не будет выведен или не будет создан новый рецептор.
Пролонгированный контакт с агонистами приводит к уменьшению количества рецепторов. В качестве примера можно привести пациентов, страдающих бронхиальной астмой, у которых при длительном применении бета-агонистов происходит снижение регуляции. При этом эффект уменьшается.
Запасные Рецепторы
Иногда видно, особенно в изолированных тканях, что при добавлении различных количеств лекарств, например, когда в кишечнике кроликов добавляют ацетилхолин, это может привести к максимальному эффекту. Только один процент рецепторов может быть занят, но максимальная реакция может быть замечена. Это связано с огромным резервом. Есть запасные рецепторы, для максимального эффекта требуется лишь очень небольшое количество препаратов.
Противники:
Связывание препарата с рецептором происходит одинаково. Большинство препаратов, связывающих рецепторы, похожи на агонисты, но они не могут активировать рецепторы, а также предотвращать связывание агонистов. При этом противоположный эффект возникает в случае агонистов и антагонистов. У них есть два свойства:
1. Близость
2. Не обладают эффективностью или внутренней активностью
Примеры включают атропин, который является антагонистом ацетилхолина. Пропанол является антагонистом бета-рецепторов.
Связывание антагониста с рецептором бывает двух типов:
1. Реверсивное связывание
2. Необратимое связывание
Обратимое связывание также известно как конкурентный антагонизм. Например, атропин.
Неконкурентоспособный антагонизм возникает, когда связывающее действие антагониста продлевается до тех пор, пока препарат не будет выведен или не будет создан новый рецептор. Пример включает феноксибензамин, который неконкурентоспособно блокирует действие катехоламинов на бета-рецепторы. Гистамины второго поколения Н1 также являются неконкурентными блокаторами.
Длительный контакт тканей с антагонистами приводит к усилению регуляции рецепторов или увеличению количества рецепторов в тканях. Пример включает пациентов, страдающих аритмией или стенокардией, принимающих бета-блокаторы, если мы резко откажемся от них, произойдет реверсирование аритмии и стенокардии. Происходит повышенная регуляция катехоламинов, что ухудшает состояние организма.
Частичные Антагонисты
Частичные антагонисты обладают промежуточным уровнем эффективности. Они связываются с рецепторами, но обладают очень малой внутренней активностью и эффективностью. Видно, что даже при 100-процентной занятости рецепторов реакция субмаксимальна. Примеры включают бета-блокаторы, такие как пиндолол и окспранолол. Они обладают свойством ISA (внутреннее симпатомиметическое свойство) и применяются у пациентов, страдающих сахарным диабетом, заболеваниями периферических сосудов и бронхиальной астмой.
Обратные Агонисты
Когда обратные агонисты связывают рецепторы, они вызывают активацию рецепторов, но производят эффект, противоположный агонистам. Примеры включают бензодиазепины, используемые в качестве седативных снотворных средств. Они производят успокоение, снимают тревогу и расслабление мышц. При введении бета-карболинов они связывают бензодиазепиновые рецепторы, вызывая активацию рецепторов, вызывая стимуляцию, повышение тонуса, тревогу и судороги.
Препараты, обладающие агонистическим действием на рецепторы, обладают положительной эффективностью.
Препараты, обладающие обратным агонистическим действием на рецепторы, обладают отрицательной эффективностью.
Препараты, обладающие антагонистическим действием на рецепторы, имеют нулевую

Тест.
1.Что из себя представляет G-белок-связанный рецептор?
А) представляют собой белки, интегрированные в плазматическую мембрану и состоящие из связки семи гидрофобных спиралей, проходящих через нее