Этот процесс включает гидридное элиминирование после встраивания молекулы субстрата по связи Ni – аллил. В присутствии НБН образуется интермедиат А cis, exo – строения. Далее происходит замыкание четырехчленного кольца (направление a), с образованием cis, exo продукта I, имеющего метиленциклобутановый фрагмент. Реакция может реализовываться по направлению b с образованием продукта II (exo), имеющего метиленовую и винильную группу.
Соотношение продуктов зависит от температуры: если при 800С А/В =3/7, то при 200С соотношение продуктов А и В равно 1/1.
Диспропорционирование аллильных лигандов в η3-аллильных комплексах переходных металлов при взаимодействии с норборнадиеном и НБН - производными.
Перераспределение водорода между η3-аллильными лигандами – наименее изученное направление превращения комплексов переходных металлов. Это свойство проявляется количественно в реакции Ni(C3H5) 2 с НБД, приводящей к широкой гамме продуктов окислительного аллилирования (I – III) и восстановления (СзН6) 10.
 |
Ni(C3H5) 2 + 3,3C7H8 → C10H12 + 0,3 C10H14 + 0,7 C3H6 + Ni(C7H8) 2 (1)
Указанные соединения образуются в результате присоединения к НБД аллильной группы, ранее принадлежавшей комплексу.
Взаимодействие Ni(C3H5) 2 с НБД протекает количественно при 25°С за несколько минут и сопровождается изменением окраски реакционного раствора. Желтый цвет, обусловленный Ni(СзН5) 3, переходит в темно-красный, характерный для олефиновых комплексов Ni(0). Интенсивность окрашивания пропорциональна исходной концентрации аллильного комплекса. При образовании темно-красных растворов существенно уменьшается концентрация НБД, расход которого составляет 3,3 моля на 1 моль Ni(C3H5) 2. Реакцию (1) удобно анализировать в виде суммы двух уравнений,
0,7 Ni(C3H5) 2 + 3C7H8 → С10Н12 + С3Н6 + Ni(C7H8) 2 (2)
0,3 Ni(C3H5) 2 + 4С7Н8 → С10Н12 + С10Н14 + Ni(C7H8) 2 (3)
относительный вклад которых составляет 0,7 и 0,3 соответственно.
Каждое уравнение формально описывает реакцию переноса атома водорода между аллильными лигандами. При этом более ненасыщенный фрагмент С3Н4 всегда входит в состав аддуктов С10Н12, в то время как фрагмент С3Н6 может находиться как в связанном состоянии (С10Н14), так и в виде пропилена. Суммарное количество пропилена и соединения С10Н14 эквимолярно сумме продуктов с брутто-формулой С10Н12.
Анализируя зависимость выхода продуктов I-III от мольного отношения НБД/NiA112, видно, что увеличение отношения до 10: 1 способствует образованию продукта восстановительного аллилирования. Дальнейший рост отношения практически не влияет на его выход, максимальное значение которого при данной температуре определяется природой комплекса. Прослеживается увеличение выхода I-III за счет С3Н6 (С4Н8) с ростом эффективного положительного заряда на никеле: Ni(2-CH3C3H4) 2> Ni(C3H5) > Ni(l-CH3C3H4) 2.
Температура в меньшей степени влияет на образование продуктов восстановительного аллилирования. Их выход незначительно падает с повышением температуры.
При исследовании влияния концентрации НБД на соотношение Сва/СAll+H было выяснено, что эта зависимость для всех комплексов никеля носит линейный характер, этот факт свидетельствует о более высоком кинетическом порядке по НБД для продуктов восстановительного аллилирования по сравнению с пропиленом или бутенами.
Общий характер диспропорционирования водорода между η3-аллильными лигандами подтвержден для комплексов различных переходных металлов Со, Fe, Ni, Rh, Pd и Pt. Из данных таблицы видно, что строение аддуктов определяется закономерностями, присущими и другим процессам циклоприсоединения с участием НБД 12313131. Так, при использовании комплексов никеля, палладия и платины образуются соединения, имеющие двойную связь в норбоненовом кольце. Этот факт предполагает монодентатный характер координации НБД в комплексах переходных металлов подгруппы никеля. Близость соотношений продуктов для этих металлов указывает на сходство их координационных возможностей. Однако активность комплексов в изучаемой реакции существенно уменьшается от никеля к платине, что связано с возрастанием эффективного положительного заряда металла в этом ряду.
Крайне неустойчивые комплексы Fе(С3Н5) 3 и Со(С3Н5) 3 активно взаимодействуют с НБД уже при температуре его плавления (-19°С). Помимо продуктов с НБН-фрагментом I – II в значительных количествах образуется соединение с нортрициклановой структурой III. Такой набор продуктов обусловлен большими координационными возможностями железа и кобальта по сравнению с переходными металлами подгруппы никеля. Подобным образом с НБД взаимодействует Rh(С3Н5) 3, однако его активность в исследуемой реакции существенно ниже.
Результаты балансовых и кинетических опытов, а также информация о строении образующихся продуктов позволяют высказать некоторые соображения о механизме взаимодействия Маlln с НБД (рис.1.1).
Механизм реакции основан на известных свойствах η3-аллильных комплексов: η3→ η1-изомеризации аллильных лигандов, внедрении ненасыщенных молекул по η1-связи металл-углерод, стадиях β-элиминирования и гидридного переноса, а также способности молекулы НБД как к монодентатной, так и хелатной координации.
Образование продуктов восстановительного аллилирования обусловлено координацией и внедрением второй молекулы НБД. При распаде общего комплекса в результате различных направлений протекания стадии гидридного переноса происходит формирование продуктов восстановительного аллилирования и С3Н6 (C4H8).
Образующийся после внедрения второй молекулы НБД координационно ненасыщенный комплекс должен быть крайне неустойчивым. Вследствие этого в аллилнорборненовом фрагменте не успевают произойти многочисленные превращения, имеющие место при внедрении первой молекулы НБД. В результате образуется только один продукт восстановительного аллилирования (C10H14) в отличие от широкого ассортимента соединений C10H12.

Рисунок 1.1. Механизм взаимодействия Мalln с НБД
Ключевая стадия – β-гидридный перенос - подтверждается хромато-масс-спектрометрическим исследованием продуктов модельных систем: Ni(C3D5) 2 – НБД и Ni(С3Н5) 2 – НБД-D8. Их строение указывает на участие в процессе атомов водорода, принадлежащих как НБД, так и аллильному фрагменту и занимающих β-положение по отношению к металлу (рис.1.2).
Предложенный механизм объясняет строение всех продуктов аллилирования НБД. Для каждого переходного металла характерен индивидуальный набор соединений и, следовательно, определенная совокупность стадий, приводящая к их образованию.
Так для Malln подгруппы никеля характерна совокупность стадий, объединенная общим направлением (а). Для комплексов железа, кобальта и родия реализуются оба направления: (а) - связанное с монодентатной координацией НБД в комплексе и (б) - проявляющееся при хелатной его координации.
Реакции окислительно-восстановительного диспропорционирования для различных субстратов (различные классы ненасыщенных соединений, отличающиеся природой и реакционной способностью кратной связи) могут быть разделены на три группы:
Реакция не идет (А)
Ni(C3H5) 2 + ненасыщенный углеводород Гексадиен-1,5 (Б)
Продукты аллилирования (В)
А. этилен, пропилен, пентен-1, пентен-2, 2-метиопентен-2, гексадиен-1,5, винилциклопропан, метиленциклобутан, циклопентен, циклогексен;
Б. аллен, бутедиен-1,3, метиленциклопропан, циклопентадиен-1,3, трансциклооктадиен-1,5;
В. Норборнадиен, норборнен и его 5,6-производные.
В первую группу входят соединения, не взаимодействующие с бис(π-аллил) никелем. Это линейные и циклические алкены, диены с изолированными двойными связями (гексадиен-1,5), а также соединения, у которых двойная связь примыкает к умеренно напряженному углеродному кольну (метиленциклобутан).
Во вторую группу соединений входят диеновые углеводороды с кумулированными (аллен) и сопряженными (бутадиен-1,3, циклопентадиен) двойными связями, а также олефины у которых двойная связь примыкает к напряженному углеродному кольцу (метиленциклопропан). Эти соединения вытесняют из бис(π-аллил) никеля гексадиен-1,5. При этом образуется π-комплекс никеля с соответствующим соединением, способный в ряде случаев катализировать его циклическую олигомеризацию.
Наконец, в третью группу входят НБД, НБН и его многочленные 5,6-производные.
Таким образом, субстратом для реакции аллилирования являются соединения с внутрициклической двойной связью.
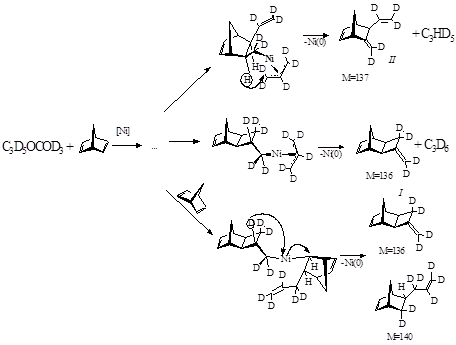 |
Анализ величин энергий напряжения двойных связей (табл.1.1) в циклоалкенах приводит к выводу, что уникальная реакционная способность двойных связей в НБД - и НБН-производных связана с внутримолекулярным напряжением углеродного каркаса. Эта энергия, частично высвобождающаяся при координации, полностью компенсирует затраты на только одного аллильного лиганда.
Рисунок 1.2. Фрагмент механизма для модельной системы Ni(C3D5) 2 – НБД.
Таблица 1.1. Энергия напряжения двойной связи в некоторых циклоалкенах и метиленциклоалканах.
| Субстрат | Напряжение двойной связи, кДж/моль | Субстрат | Напряжение двойной связи, кДж/моль |

| 58,2 (две связи) | 
| 34,8 |

| 25,1 | 
| 12,6 |
Продолжение.

| 15,5 | 
| 11,4 |

| 9,6 | 
| 8,1 |

| 0,8 |
Это условие, видимо, играет важнейшую роль для дальнейшего протекания процесса по пути окислительно-восстановительного диспропорционирования. Энергия напряжения двойной связи должна находиться в пределах 25-30 кД ж/связь. Следовательно, в реакции аллилирования могут вступать непредельные углеводороды имеющие напряженную внутрицеклическую двойную связь.
Таким образом, стехиометрическое взаимодействие может служить своего рода индикатором, указывающим на принципиальную возможность того или иного соединения вступать в реакцию каталитического аллилирования.
Гомогенно – каталитическое аллилирование НБД и НБН - производных.
Аллилирование норборнена.
Катализируемое аллильное алкилирование норборненовых (НБ) производных позволяет в одну технологическую стадию получить сложные полициклические углеводороды, содержащие метиленциклобутеновый фрагмент или метиленовую и винильную группы (реакция 4) 1:
 |
(4)
Катализаторами этой и родственных реакций являются системы на основе комплексных соединений никеля и палладия. Аллилирующими агентами служат сложные аллиловые эфиры органических кислот, среди которых наиболее часто используется аллилацетат. Аналогичные результаты могут быть полученны при использовании аллилпропионата, аллилбутирата или аллилбензоата [2,3]. При 80 0С суммарный выход продуктов составляет 80% при их соотношении 7/5. При 20 0С соотношение продуктов равно 1/1. Необычность этой реакции заключается в характере присоединения аллиьной группы – не традиционно линейном, а циклическом, и даже, с разрывом С-С – связи 2.
Строго говоря, взаимодействие НБН и аллилацетата не является содимеризацией. Аллилацетат выступает лишь как источник фрагмента С3Н4, присоединяющегося к НБН при помощи каталитического комплекса. Эта реакция является первым примером использования аллиловых эфиров органических кислот в подобных процессах и представляется интересным методом получения полициклических соединений.
Универсальность этого метода продемонстрирована в работах Джемилева и сотр.3 4 5 6, которые осуществили масштабное исследование этой реакции применительно к широкому кругу соединений НБН-ряда. Каталитическая система –Ni(асас) 2-АlEt3-Р(ОR) 3 весьма активна и достаточно селективна при получении экзо-метиленциклобутановых производных.
Каталитическое аллилирование НБН и НБН-производных - весьма сложный многопараметрический процесс. В системе, образованной большим количеством компонентов – металлоорганическими комплексами катализатора, фосфорорганическими соединениями, субстратами – (НБД) и сложными аллиловыми эфирами, а так же продуктами, возможно протекание как желательных, так и многочисленных побочных реакций, воздействующих на каталитическую систему и снижающих ее технологические показатели.
На состав продуктов существенное влияние оказывает природа растворителя. Так содимеризация АА с НБД наиболее успешно протекает в среде толуол – алифатический спирт (исключение составляет метанол) при различных соотношениях компонентов. В среде толуол – АсОН (1: 2) наблюдается изменение направления реакции в сторону образования продукта димеризации НБД, хотя меньшие количества АсОН, образующиеся за счет самой реакции, не влияют на активность и селективность каталитической системы 3.
Реакция чрезвычайно чувствительна к природе фосфорорганического лиганда. Наиболее активные катализаторы могут быть получены при использовании в качестве лигандов (i-PrO) 3P, (втор-BuO) 3P и (C6H11O) 3P 3. Каталитические системы на их основе проявляют активность в интервале 20 – 1200С.
Низкая активность каталитических систем на основе (MeO) 3P, (EtO) 3P, (PrO) 3P, (PhO) 3P и в особенности фосфинов может быть объяснена тем, что эти лиганды образуют достаточно прочные комплексы с Ni, препятствуя тем самым подходу к центральному атому катализатора и активированию НБН и АА.
На активность каталитических систем существенное влияние оказывает также температура. В работах 3 4 5 6 отмечается, что при 200С активность проявляют лишь каталитические системы, в которых в качестве лигандов используются (i-PrO) 3P, (втор-BuO) 3P и (C6H11O) 3P. И только при 800С высокие значения конверсии НБН и выхода продуктов достигаются для КС на основе (MeO) 3P, (EtO) 3P, (PrO) 3P, (PhO) 3P.
Строение аллилирующего агента – сложного аллилового эфира – не имеет решающего значения. Так, помимо аллилиацуетата с теми же результатами использованы аллилпропионат, аллилбутират. Аллилбензоат и аллилформиат. Однако, в случае последнего не удается добится высоких конверсий реагентов из-за разрушения каталитической системы. Аллиловый спирт, аллилгалогениды, простые аллиловые эфиры и тиоэфиры в реакции с НБН в данных условиях не вступают.
Природа восстановителя мало влияет на состав продуктов. Наиболее эффективными являются AlEt3, Al(i-Bu) 3, Mg(Bu) 2, и LiAlH4.
Стерические особенности субстратов, имеющих экзо-заместители в положениях 5 и 6 относительно внутрициклической двойной связи не оказывают существенного влияния на скорость циклоприсоединения. Содимеризация АА с подобными соединениями протекает строго избирательно и затрагивает только не замещенную двойную свзь. Однако, 5,6-эндо-заместители в зависимости от размера могут существенно затруднять реакцию вплоть до полной ее остановки. Процесс полностью блокируется также при наличии заместителя непосредственно у норборненовой двойной связи.
Сравнительное изучение каталитической активности для системы – Ni – (АА) 2 –AlEt3 – P(Oi-C3H7) 3 и индивидуального комплекса Ni [P(Oi-C3H7) 3] 4 указывают на существенные различия в их поведении.
Комплекс, выделенный в ходе реакции и охарактеризованный по продуктам распада, криоскопически имеет предположительный состав [(i-PrO) 3P] 3NiEt.
По-видимому, он является одним из интермедиатов в достаточно сложной цепочке превращений, приводящих к малоустойчивым каталитически активным гидридным (Ni-H) и кластерным (Ni-Ni) комплексам.
На основании кинетических и спектральных данных проведенных В.Р. Флидом и сотр., проведенных с 1980 по 2000 год 7 8 9 10 впервые был предложен был предложен механизм каталитического аллилирования НБН аллилиацетатом в присутствии никелевого катализатора.
В его основе лежат следующие положения:
Соединения никеля (0) являются четырехкоординационными с тетраэдрическим строением полиэдра. Это относится как к гомолигандным, так и смешанным с НБН никель - фосфитным комплексам.
Аллилацетат окислительно присоединяется к никелю, образуя пяти - и шестикоординационные комплексы.
Формирование продуктов аллилирования НБН осуществляется внутримолекулярно на моноядерном никелевом центре.
1. NiP4↔NiP3 + P
2. NiP3↔NiP2 + P
3. NiP2↔NiP + P
4. NiP + НБН↔Ni(НБН) + P
5. NiP2 + НБН↔NiP(НБН) + P
6. NiP3 + НБН↔NiP2(НБН) + P
7. NiP4 + НБН↔NiP3(НБН) + P
8. NiP4 + AA↔NiP4(AA)
9. NiP3 + AA↔NiP3(AA)
10. NiP2 + AA↔NiP2(AA)
11. NiP + AA↔NiP(AA)
12. NiP3(AA) + НБН↔NiP3(AA) (НБН)
13. NiP2(AA) + НБН↔NiP2(AA) (НБН)
14. NiP(AA) + НБН↔NiP(AA) (НБН)
15. NiP3(AA) (НБН) ↔S1 + AcOH + NiP3
16. NiP3(AA) (НБН) ↔S2 + AcOH + NiP3
17. NiP2(AA) (НБН) ↔S1 + AcOH + NiP2
18. NiP2(AA) (НБН) ↔S2 + AcOH + NiP2
19. NiP(AA) (НБН) ↔S1 + AcOH + NiP
20. NiP(AA) (НБН) ↔S2 + AcOH + NiP
21. P(O-iC3H7) 3 + AcOH↔H(O) P(O-iC3H7) 3 + C3H7Oac
Схема 1.2. Механизм каталитического аллилирования НБН.
P ≡ P(O-iC3H7) 3; НБН ≡ норборнен; АА ≡ аллилацетат; S1, S2 ≡ продукты аллилирования НБН.
К наиболее кинетически значимым стадиям меанизма следует отнести:
формирования в реакционном растворе комплексов (C3H5) PnNi(OAc), где n=2 или3. Эти комплексы доминируют в условиях реакции;
присоединение молекулы НБН к комплексу (C3H5) PnNi(OAc), сопровождающееся η3 – η1 – изомеризацией аллильного лиганда;
внедрение НБН по связи η1 – аллил – метал;
формирование никелациклических интермедиатов и их распад в резултате β-гидридного переноса с образованием продуктов аллилирования НБН и уксусной кислоты.

Рисунок 1.2. Заключительная часть механизма каталитического аллилирования НБН аллилиацетатом.
В реакции образуются изомеры исключительно экзо-строения, что связано с экзо-координацией молекул НБН-в комплексе.
β-гидридный перенос является завершающей и, как показывают проведенные исследования, лимитирующей стадией каталитического процесса. Следует отметить, что в стадии гидридного переноса могут участвовать атомы водорода как из аллильной группы аллилацетата, так и молекулы НБН.
Таким образом, в механизме протекания заключительного этапа наблюдается полная аналогия со стехиометрическими процессами, описанными в разделе 1.1.
Анализ изученных литературных данных 1 3 9 10 свидетельствует, что образование индивидуальных продуктов происходит из комплексов никеля, содержащих различное число фосфитных лигандов. Комплекс NiP3 ответственен за образование соединения II, а NiP2 – за продукт I. Этот факт играет важную роль при регулировании селективностию.
Серьезным препятствием на пути эффективного осуществления каталитического процесса и устойчивой работы катализатора является его дестабилизация одним из продуктов – уксусной кислотой. Образование последнего соединения происходит вэквивалентвых по отношению к продуктам аллилирования колличествах. Уксусная кислота переводит триизопрпилфосфит в неактивную форму, изменяя соотношение компонентов каталитической системы. В этой ситуации очень сложно добиться высоких технологических показателей процесса – селективности по индивидуальным продуктам и времени работы катализатора.
Проблема выведения уксусной кислоты из реакционной зоны представляется весьма непростой. Весьма перспективным в этом отношении представляется использование цеолитов типа NaA, которые являются абсолютно инертными по отношению к гомогенным никелевым комплексам 11 12. Применение цеолитов с диаметром пор 4Å позволяет весма эффективно и избирательно погощать уксусную кислоту (эффективный диаметр ≈3,8 Å).
Таким образом при использовании цеолитов количество каталитических циклов достигает 1,5 – 2 тыс.
Аллилирование соединений норборненового ряда.
Закономерности, выявленные при каталитическом аллилировании НБН, справедливы для многочисленных НБН-производных 3 10 Киузоли 85 (табл.1.2).
Варьирование двух параметров - соотношения P/Ni и температуры - позволяет получать метилен циклобутановые соединения типа I с селективностью 80-95%, а метилен-винильные производные типа II – с селективностью 75-85%.
В реакцию вступают только НБН-производные с незамещенной двойной связью. Соединения, имеющие несколько ненасыщенных связей различной природы, участвуют в реакции только с использованием двойной НБН-связи.
Пространственный фактор оказывает влияние на скорость процесса, но соотношение изомеров маю от него зависит. Наиболее активны норборнены с неэкранированной внутри циклической двойной связью, имеющие экзо-заместители в положениях 5 или 6 НБН-кольца. Активность эндо-замещенных производных в реакции несколько ниже.
Соединения, имеющие две изолированные НБН-двойные связи последовательно аллилируются по каждой из них, причем активность в каждой из стадий практически неизменна. Здесь возможно образование большого количества изомеров, но варьирование вышеуказанных параметров позволяет преимущественно получать два из них.
Сопоставляя закономерности протекания стехиометрического (раздел 4.6) и каталитического аллилирования, можно отметить ряд качественных аналогий по составу и строению продуктов.
Как правило, в обеих реакциях образуются одни и те же соединения. В каталитическом процессе полностью отсутствуют изомеры эндо-строения, тогда как в стехиометрическом варианте такие соединения образуются, хотя и в незначительных количествах.
Каталитический вариант в отличие от стехиометрического позволяет направленно воздействовать на соотношение изомеров.
Механизм протекания ключевых стадий полностью аналогичен.
Таблица 1.2
Продукты аллилирования замещенных норборненов.
| Исходное соединение | Продукты |

| 
|

| 
|

| 
|

| 
|

| 
|

| 

|

| 
|
Каталитическое аллилирование норборнадиена.
Использование в этой реакции норборнадиена (НБД) существенно расширяет ее синтетические возможности (реакция 5). Впервые возможность проведения реакции аллилирования НБД была показана У.М. Джемилевым и сотр. в статье 5. Реакция НБД с аллилацетатом (1: 1) в присутствии каталитической системы Ni – (acac) 2 –AlEt3 – P(Oi-C3H7) 3 (1: 3: 4) в отличее от норборнена протекает более сложно и сопровождается образованием трех изомерных продуктов (I – III).
Аллилирование НБД во многом напоминает аналогичную реакцию для НБН - производных. Существенное отличие заключается в способности молеулы НБД к хелатной координации на атоме катализатора. Следствием этого является разнообразное, чем для НБН, строение возможных продуктов. В ходе реакции, кроме уже известных продуктов, могут образовываться так же продукты двойного аллилирования 5.
Набор продуктов в реакции 5 для никелевого катализатора несколько иной, чем при стехиометрическом взаимодействии. Следует отметить отсутствие норборненовых продуктов эндо-строения и образование квадрацикленовых производных III.
Кинетика реакции качественно напоминает аллилирование НБН 10. Совокупность спектральных и кинетических исследований дает представление о механизме процесса.
 |
Механизм реакции аллилирования НБД аллтлацетатом в присутствии комплексов никеля включает 24 стадии:
Схема 1.3. Механизм каталитического аллилирования НБД
1. NiP4↔NiP3 + P
2. NiP3↔NiP2 + P
3. NiP2↔NiP + P
4. NiP + НБД↔Ni(НБД) + P
5. NiP2 + НБД↔NiP(НБД) + P
6. NiP3 + НБД↔NiP2(НБД) + P
7. NiP4 + НБД↔NiP3(НБД) + P
8. NiP4 + AA↔NiP4(AA)
9. NiP3 + AA↔NiP3(AA)
10. NiP2 + AA↔NiP2(AA)
11. NiP + AA↔NiP(AA)
12. NiP3(AA) + НБД↔NiP3(AA) (НБД)
13. NiP2(AA) + НБД↔NiP2(AA) (НБД)
14. NiP(AA) + НБД↔NiP(AA) (НБД)
15. NiP3(AA) (НБД) ↔S1 + AcOH + NiP3
16. NiP3(AA) (НБД) ↔S2 + AcOH + NiP3
17. NiP3(AA) (НБД) ↔S3 + AcOH + NiP3
18. NiP2(AA) (НБД) ↔S1 + AcOH + NiP2
19. NiP2(AA) (НБД) ↔S2 + AcOH + NiP2
20. NiP2(AA) (НБД) ↔S3 + AcOH + NiP2
21. NiP(AA) (НБД) ↔S1 + AcOH + NiP
22. NiP(AA) (НБД) ↔S2 + AcOH + NiP
23. NiP(AA) (НБД) ↔S3 + AcOH + NiP
24. P(O-iC3H7) 3 + AcOH↔H(O) P(O-iC3H7) 3 + C3H7Oac
P ≡ P(O-iC3H7) 3; НБД ≡ норборнадиен; АА ≡ аллилацетат; S1, S2 и S3 ≡ продукты аллилирования НБД.
Ключевой стадией является формирование каталитически активного комплекса никеля, где образуется аллильный фрагмент. Формирование подобных комплексов описано в работах Ямамото и сотр 15. В процессе окислительного присоединения оргонических вществ, имеющих связь С-О, происходит встраивание металла с образованием аллильного комплекса:
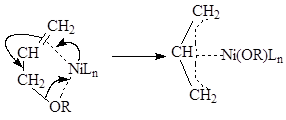
Рисунок 1.3. Механизм образования аллильного комплекса никеля.
Далее молекула НБД координируется на атоме металла, вызывая η3 – η1 – изомеризацию аллилиьного лиганда, а затем внедряется по связи η1 – металл.
Анализ данных позволил авторам утверждать, что образование индивидуальных продуктов I – III связано с наличеем в каталитической системе комплексов никеля, содержащих различное число фосфитных лигандов 7 9 10.
В зависимости от количества фосфорорганических заместителей реализуются различные направления циклизации, которые завершаются β-гидридным переносом, образованием продуктов аллилирования и регенерацией NiPn:

Рисунок 1.4. Зависимость направления реакции аллилировани НБД от соотношения P(O-iC3H7) /Ni.
Совокупность литературных и экспериментальных данных 7 9 10 позволили авторам предложить механизм каталитического аллилирования НБД (рис 1.4) В соответствии с ним комплексы allNiPnOAc доминируют в реакционной среде. Молекула НБД, координируясь на атоме никеля вызывает η3 – η1 – изомеризацию аллилиьного лиганда, а затем внедряется по связи η1 – аллил – металл. Затем, в зависимости от колличества фосфорорганического заместителя, осуществляются различные направления циклизации, которые завершаются β – гидридным переносом, образованием продуктов и регенирацией NiPn, к которому быстро окислительно присоединяется молекула аллилацетата из раствора. При n=1 происходит хелатная координация НБД в комплексе, что вызывает образование продукта III, имеющего нортрициклическое строение 10.

Рисунок 1.5. Заключительная часть механизма каталитического аллилирования НБД аллилацетатом.
Стадия гидридного переноса, очевидно, лимитирует процесс. Протекание такой стадии с участием β – углеродного атома подтверждено при использовании модельной системы C3D5OCOCD3.
 |
Рисунок 1.6. Фрагмент мехпнизма каталитического аллилрования НБД аллилацетатом для модельной системы C3D5OCOCD3 – НБД.
Малекулярные массы продуктов I и II различаются, что подтверждает возможность отрыва атома водорода как из НБД – кольца, так и аллильного фрагмента.
Уксусная кислота как и в случае НБН, дестабилизирует каталитическую систему. По этой причине в статическом реакторе количество оборотов катализатора, как правило, не превышает 150 – 200.
Применение цеалитов 11 12 позволяет существенно повысить время жизни катализатора и увеличить число каталитических циклов до 2000.
Влияние соотношения реагентов – НБД и аллилиацетата – на закономерности процесса.
Выше было показано, что максимальный выход продуктов аллилирования НБД I – III наблюдается при эквимолярном соотношении реагентов. При избытке НБД образуется незначительное количество его димеров и падает суммарная скорость процесса 5.
Если взаимодействие НБД проводить с двукратным мольным избытком аллилацетата (200С, НБД: Ni(acac) 2, 10-15: 1), то в реакционной смеси на ряду с продуктами I – III, появляется продукт IV, образование которого представлено авторами как присоединение к НБД 2 молей аллилацетата. Позднее было показано 9 10, что в этих условиях наблюдается вторичное аллилирование соединений с норборненовыми структурами I и II, приводящее к большому количеству изомерных продуктов (реакция 6):
 |
(6)
Строение и соотношение продуктов двойного аллилирования НБД зависит от условий – температуры и соотношения P/Ni. Скорость аллилирования двойной связи НБД в несколько раз превышает скорость стадии повторного аллилирования.
Аллилирование НБД комплексами палладия.
Модель единичного каталитического цикла, описанная в разделе 1.2.1, оказалась очень удобной для изучения для изучения основных направлений циклоприсоединения аллильного фрагмента к НБД и установления деталей механизма. В работе Берселлини и сотр.15 показано, что в этой стехиометрической реакции помимо соединений никеля могут быть использованы аллильные комплексы других металлов – железа, родия, палладия и платины. На основании совокупности литературных данных в 1991 году была высказана гипотеза о возможности разработки каталитических систем с участием широкого круга переходных металлов 7. В 2000 году появилось сообщение об использовании палладиевого катализатора для аллилирования НБН 16.
Строение продуктов аллилирования НБД, образующихся в присутствии комплексов палладия 17 18, аналогично строению продуктов никель-катализируемой реакции 5. При этом для различных исходных палладиевых систем наблюдается примерно одинаковая активность и близкие соотношения продуктов реакции. Что свидетельствует о генерировании одних и тех же каталитически активных комплексах. В качестве предшественников каталитически активных частиц реакции 5 использовались Pd(dba) 2+2PPh3, Pd(OAc) 2+2PPh3, PdCl2(PPh3) 2, [(C3H5) Pd] NO3+2PPh3. В качестве аллилрующего агента использовали аллилацетат.
Палладиевые катализаторы проявляют активность как на воздухе, так и в инертной атмосфере, тогда как никелевые системы активны только в условиях полного отсутствия кислорода. Однако, несмотря на то, что присутствие воздуха не приводит к разрушению палладиевой каталитической системы, скорость реакции в этих условиях низкая. Причиной дезактивации катализатора является побочная реакция окисления трифенилфосфина.
Соотношение продуктов аллилирования НБД зависит от температуры. При 25 – 60 0С преимущественно образуются продукты I и II, в которых сохраняется норборненовая двойная связь. При более высокой температуре (80 0С) наблюдается рост относительного количества соединения III, являющегося [2+4] -циклоаддуктом.
Проведение реакции в спиртовых средах способствует незначительному увеличению относительного количества соединения I.
При мольном соотношении АА/НБД более единицы происходит вторичное аллилирование незамещенной норборненовой двойной связи в соединения содержащих метилен циклобутановый фрагмент (I) или винильную г и метиленовую группу(II) (реакция 7) 17.

(7)
Общий характер диспропорционирования водорода между η3-аллильными лигандами подтвержден для комплексов различных переходных металлов Со, Fe, Ni, Rh, Pd и Pt 19 20 21. Таким образом, в работе Берселлини и сотрудников 15 показана η3 – η1 – изомеризацию аллилиьного лиганда в комплексах палладия в присутствии непредельных углеводородов.

R ≡ непредельный углеводород.
Сравнивая каталитические системы на основе на основе комплексов никеля и палладия, следует отметить, что никелевые катализаторы более активны, а оптимизация ряда параметров каталитического процесса (температуры, соотношение фосфит-никель, удаление образующейся кислоты) позволяет повысить селективность по каждому из продуктов до 80 – 95%. Палладиевые катализаторы проявляют меньшую удельную активность, но более стабильны в присутствии кислорода и легко регенерируются.
Аллилирующие агенты в реакциях циклоприсоединения НБД и НБН – производных.
Аллилирующими агентами служат сложные аллиловые эфиры органических кислот, среди которых наиболее часто используется аллилацетат. Аналогичные результаты могут быть полученны при использовании аллилпропионата, аллилбутирата или аллилбензоата 3 22. В ряде работ в качестве источника аллильных фрагментов упоминается аллилформиат, но конкретные данные, связанные с его использованием в реакциях аллилирования с НБД и НБН-производными в литературе отсутствуют.
Циклосодимеризация аллилформиата с НБН лает возможность получать циклический продукт аллилирования I с селективностью 100%, однако общий выход содимера в этих опытах намного ниже, чем с АА 3. Как было выяснено авторами, причиной разрушения катализатора в опытах с аллилформиатом является образующаяся в ходе реакции НСООН. Муравьиная кислота образуется в больших каллилчествах в реакционной среде и в данных условиях накапливается без разложения.
Этими же авторами было показано, что участие в реакции аллилирования НБН других аллиловых производных – аллиловый спирт, диаллиловый эфир, аллилгалогениды – в данных условиях невозможно.
В качестве других классов органических соединений способных участвовать в реакции аллилирования в работах Киузоли упоминаются аллилигалагениды и потенциально – аллиловый спирт и диалллиловый эфир 13.

X ≡ Cl, Br, I, OH и OR;
M ≡ Ni0, Pd0.
В этой работе показано, что реакции цикклоприсоединения с участием аллилгалогенидов протекает в атмосфере монооксида углерода, молекула которого, встраиваясь по связи С – М, облегчает η3 – η1 – изомеризацию и формирование аллильного фрагмента. В этих условиях возможно формирование аллильного фрагмента и каталттически активного комплекса металла. В присутствии непредельного углеводорода происходит его координация на активном атоме, а затем образование продуктов присоединения. В качестве побочных продуктов образуется кислота.
Выводы
Из анализа литературных данных следует, что в настоящее время известны многочисленные каталитические системы для реакции аллилирования НБД и НБН – производных.
Имеющиеся в литературе данные позволяют выявить основные закономерности, присущие процессам с участием НБД и катализируемые никелевыми катализаторами. Факторы и тенденции, определяющие образование продуктов определенного строения и регулирования селективности процесса, недостаточно изучены.
Имеются лишь отдельные работы, посвященные исследованию механизма каталитического аллилирования НБД и НБН – производных, выявлению природы и строения каталитически активных комплексов, определяющих структуру образующихся соединений и ответственных за селективность процесса, а также позволяющих целенаправленно проводить синтезы продуктов заданного строения.
Только незначительное количество работ посвящено