1. Все три конечных продукта представляют собой циклические кетали, причем в двух случаях последней стадией, очевидно, является образование кеталя внутримолекулярной циклизацией дигидроксикетона (или его реакционноспособного производного, например, дигидроксикеталя).
Начнем расшифровку схемы с синтеза соединения F. С учетом приведенного метода синтеза, эту молекулу можно разделить на три составляющих:

Действительно, последняя стадия синтеза F представляет собой взаимодействие между веществом Е и акролеином. Образующийся продукт содержит шестичленный цикл, составной частью которого является акролеин. Видно, что F – продукт реакции Дильса-Альдера между акролеином (выступающим в качестве диеновой компоненты) и соответствующим алкеном Е. Отсюда можно определить структуру Е:
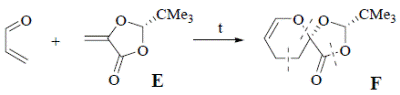
Алкен Е был получен из А с использованием последовательности реакций бромирование-дегидробромирование. Это позволяет определить формулы А и D:

Соединение А (разновидность кеталя) было получено из Х в результате кислотно-катализируемой реакции с пивалевым альдегидом Me3CCHO. Отсюда определяем, что исходное соединение Х представляет собой D- или L-форму 2-гидроксипропионовой (молочной) кислоты СН3СН(ОН)СООН. В природе образуются оба энантиомера молочной кислоты, хотя более известно образование D-изомера из D-глюкозы.
Обратимся теперь к синтезу фронталина. При обработке А диизопропиламидом лития и алкилировании енолят-иона образуется соединение В, восстановление которого алюмогидридом лития приводит к расщеплению сложноэфирной связи с образованием молекулы С, являющейся дигидроксикеталем.
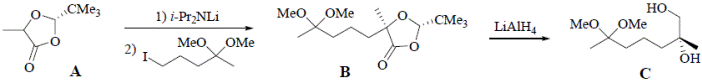
Обработка С п -толуолсульфокислотой приводит к расщеплению исходного кеталя и образованию нового (равновесие сдвигается в нужном направлении в результате отгонки относительно легко кипящего метанола и предпочтительности образования пяти- и шестичленных циклов).

Стереохимию нового хирального центра в молекулах В и С можно однозначно вывести из структуры фронталина (при получении его из С стереохимия хирального центра не меняется). Эта стереохимия определяется хиральным центром, несущим трет -бутильную группу, но не исходной стереохимией молекулы молочной кислоты, т.к. при образовании енолят-иона возможна изомеризация хирального центра. Поэтому для определения точной стереохимии этого центра необходимо рассмотреть синтез (-)-сордидина, молекулу которого можно разделить на две составляющие – фрагмент молочной кислоты и углеродный скелет виниллитиевого реагента, использовавшегося для превращения J в К:

Расшифруем схему синтеза сордидина:

В ходе этих превращений стереохимия хирального центра в молекуле Х и стереохимия вновь образованного хирального центра не изменяются. Поскольку абсолютная стереохимия хиральных центров в молекуле (-)-сордидина известна (S для центров, отмеченных звездочкой), получаем, что Х – (S)-молочная кислота; хиральный центр, образующийся при эпоксидировании, также имеет (S)-конфигурацию. Теперь мы можем написать структуры соединений A, G-O, X (структуры B-E были определены нами ранее):
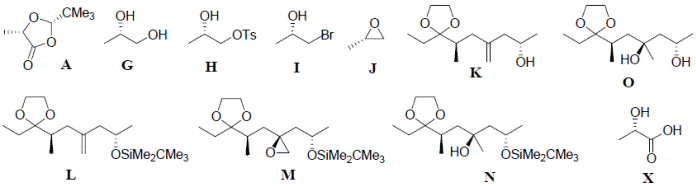
2. Х – (S)-молочная кислота.
Система оценивания:
1. Структурные формулы по 1,5 балла. Всего 22,5 балла.
За правильное указание конфигурации в соединениях X и G - O – 1,5 балла.
2. 1 балл
Всего 25 баллов.