1. Для определения размерностей констант необходимо вывести уравнение, приведенное в условии. Запишем скорость ферментативной реакции как скорость накопления ее продукта: v = d[P]/dt = K2[ES]. Реакция быстро приходит к стационарному режиму (концентрация ES постоянна): d[ES]/dt = 0 = k1[E][S]-k2[ES]-k-1[ES], откуда [ES] = k1[E][S]/(k2+k-1). С учетом уравнений материального баланса: [E]0 = [E] + [ES] и [S]0 = [S] + [ES] + [P],

При фиксированной концентрации Е в начальный период времени имеем:

С 1 имеет размерность скорости химической реакции (М/с), а С 2 – концентрации (М).
2. При малых концентрациях S скорость прямо пропорциональна его содержанию ([S]0 << C2 ⇒ v0 = C1[S]0/C2). При большом избытке S практически весь фермент связан в ES, и скорость равна предельному значению([S]0 >> C2 ⇒ v0 = C1[S]0/[S]0 = C1).

3.

4. В присутствии I скорость реакции при любой концентрации S падает вдвое:

Поскольку в зависимости от типа ингибирования меняется только одна константа, то равенство при любой концентрации субстрата выполняется только при изменении С 1 (в 2 раза). Т.е. ингибирование неконкурентное. Отсюда С 1 i = 3.5 М/мин, С 2 i = 1.0·10–5 М.
5. После приема препарат начинает всасываться в кровь и одновременно метаболизироваться и выводиться: dC/dt = kin-koutC (*). После завершения всасывания концентрация препарата будет уменьшаться по кинетике первого порядка: dC/dt = -koutC. Всасывание происходит много быстрее, чем выведение, что позволяет моделировать ситуацию «мгновенным» попаданием препарата в кровь с последующим медленным удалением. Системного кровотока достигает 0.5 · 0.9 = 0.45 г парацетамола, что соответствует начальной концентрации препарата 100 мг/л. Из кинетического уравнения первого порядка 15 = 100⋅(½)t/2следует, что концентрация вещества упадет ниже терапевтического порога за 5.5 ч. В реальной практике это означает, что парацетамол необходимо назначать по 0.5 г каждые 6 ч, то есть 4 раза в сутки.
Чтобы убедиться в правомерности предложенного подхода, сопоставим полученные результаты с точным решением задачи. Трудности связаны с дифференциальным уравнением (*), его решение:

Подстановка численных значений к моменту завершения всасывания (t = 10 мин) дает С = 97.2мг/л, а значит, концентрация упадет ниже терапевтического порога через 5.4 часа. Это подтверждает правомерность сделанных выше приближений.
6. Для оценки пороговой токсической дозы можно ограничиться рассмотрением всасывания (выведение протекает много медленнее). Пусть искомая доза – m г, тогда 0.9 m /4.5 = 0.3, откуда m = 1.5 г. С учетом выведения одновременно с всасыванием реальная доза чуть выше – прием более 3 таблеток ведет к отравлению.
7. Молярная масса А1 100·14.01·n/9.40 = 149.0·nг/моль, где n – число атомов N. При n = 1 данное значение на 2 г/моль меньше, чем для I, что свидетельствует о потере двух атомов водорода при окислении парацетамола молекулярным кислородом. А1 не содержит ароматического кольца и является электрофильным соединением. Тогда:

Для определения структуры A2 определим молекулярную массу глутатиона. Так как этот пептид ациклический, то M(G–SH) = M(Glu) + M(Cys) + M(Gly) – 2M(H2O) = 147.1 + 121.1 + 75.1 – 2 · 18 = 307.3 г/моль. Молекулярная масса A2 равна 100 · 32.07 / 7.03 = 456.3 г/моль. Молекулярные массы соединения А1 и разности 456.3 – 307.3 = 149.0 г/моль совпадают. Отсюда A2 – продукт нуклеофильного присоединения глутатиона к А1 (с учетом стерического фактора):

Молекулярная масса A3 составляет 100 · 32.07 / 13.88 = 231.2 г/моль, а разность между массами I и A3 равна 80 г/моль. А3 – сильная одноосновная кислота, образующаяся из I в одну стадию. С учетом наличия серы и сохранения двух дублетов в спектре:

8. Молекулярная масса N 100 · 14.01 / 8.59 = 163 г/моль, что позволяет рассчитать массу ацильного остатка в N для всех трех возможных аминокислот: 17 г/моль (Glu),43 г/моль (Cys) и 89 г/моль (Gly). Glu отпадает, так как масса формила равна 29 г/моль; в случае Gly ацильный остаток должен иметь формулу С5НСО, что невозможно. Остается Cys, которому соответствует ацетильный остаток. Положение ацетильной группы определяется, исходя из анализа реакций Cys и N с HNO2:

При отравлении парацетамолом запасы глутатиона как эндогенного противоядия быстро заканчиваются, что диктует необходимость биосинтеза этого трипептида изаминокислот. Чтобы восполнить пул цистеина в печени используется N -ацетилцистеин, образующий необходимую аминокислоту по рассмотренной в условии реакции (сам цистеин плохо всасывается в желудочно-кишечном тракте, что делает его использование в качестве лекарственного средства нерациональным).
Система оценивания:
1. Размерности констант по 1 баллу. Всего 2 балла.
2. График 1,5 балла.
3. Уравнение для двойных обратных координат 1,5 балла.
4. Тип ингибирования 2 балла. Значения констант по 1 баллу. Всего 4 балла.
5. Ответ 4 балла.
6. Ответ 2 балла.
7. Структуры A1 - A3 по 2 балла. Всего 6 баллов.
8. Структура N 2 балла. Уравнение реакции 2 балла. Всего 4 балла.
Всего 25 баллов.
Задача №ХЖ-2 (автор С.Г. Бахтин)
1. При озонировании А получили 1 + 2 + 4 = 7 молекул продуктов, значит А содержит 6 двойных связей. Формула алканов – C n H 2n+2, а каждая двойная связь уменьшает число атомов Н на два. Тогда формула класса полиенов, к которому относится А – C n H 2n-10.
2. Для C n H 2n-10 ω(C) = 87.8 %, отсюда n = 30, формула сквалена С30Н50. Исходя из элементного состава, получаем следующие формулы продуктов озонирования: B – (C2H3O2) a, C – (C3H6O) b, D – (C5H8O2) c. Сразу можно видеть, что а ≥ 2, ведь вещества с формулой C2H3O2 не существует. Из мольного соотношения продуктов, C 2a + 2 C 3b + 4 C 5c = C30. С учетом ограничений, наложенных на а, единственно возможный вариант, когда а = 2, b = 1, c = 1. Йодоформная проба говорит о наличии в веществе CH3C=O группы, реакция серебряного зеркала – о наличии в веществе альдегидной группы. Все продукты, согласно условию, неразветвленные. Итак:

вещество В образуется в количестве 1 моль, значит фрагмент =СH–CH2–CH2–CH= находится в центре молекулы A. Поскольку ацетон имеет только одну карбонильную группу, то фрагмент (CH3)2C= находится «на краю» молекулы А, с двух сторон (т. к. получили 2 моль C). Предварительная структура А:

Поскольку молекула симметрична, то оставшиеся четыре фрагмента из D (=C(CH3)–CH2–CH2–CH=) следует поместить по два на место каждого вопросительного знака «? ». Существует только один способ такого сочленения фрагментов, чтобы вся молекула содержала только одинаково замещенные двойные связи:

Все двойные связи тризамещенные, имеют транс -конфигурацию (самый стабильный геометрический изомер).
3.

4.

Согласно условию, протонирование F дает катион, отличный от II:

Для него есть только один вариант миграции Н+, чтобы получился новый третичный катион:

Миграция двух метильных групп:
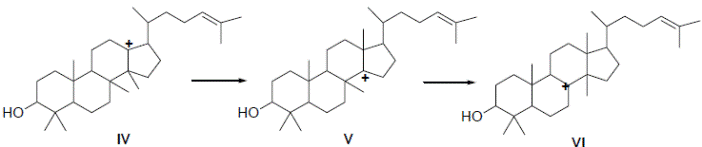
Отщепление Н+ из VI и дает искомый продукт G, то есть ланостерин:

5. а) Гидрофильной частью молекулы холестерина является ОН-группа.
б) Холестерин, в связи с высокой температурой плавления, обладает меньшей подвижностью и будет уменьшать «текучесть» мембраны, то есть будет уменьшать подвижность цепей жирных кислот, из которых состоит гидрофобная часть мембраны. Следовательно, чем больше холестерина в составе мембраны, тем меньше ее проницаемость.
Система оценивания:
1. Расчет числа двойных связей, содержащихся в молекуле А – 2 балла. Общая формула класса полиенов, к которому принадлежит А – 2 балла. Всего 4 балла.
2. Структурные формулы соединений A – D – по 2 балла. Всего 8 баллов.
3. Структурная формула сквалена – 3 балла.
4. Структурные формулы соединений E, G, I – VI – по 1 баллу. Всего 6 баллов.
5. а) 2 балла, б) 2 балла.
Итого – 25 баллов.