МОДУЛЬ 1
Элементы количественного анализа. Способы выражения концентрации растворов. Химическая термодинамика и кинетика.
Занятие № 3
I. Тема: Энергетика химических реакций.
II.Актуальность темы: Все химические реакции сопровождаются энергетическими эффектами: выделением или поглощением тепла, света, энергии.Термодинамика изучает взаимные превращения различных видов энергии, отвечает на вопрос о возможности и направлении процессов, рассчитывает их тепловые эффекты. Полученные знания способствуют более глубокому усвоению многих разделов неорганической химии (химическая кинетика, химическое равновесие, учение о растворах), а также других химических и профильных дисциплин.
III. Цель:
- научиться производить термохимические расчеты, используя термодинамические свойства химических веществ;
- уметь прогнозировать направление химических процессов;
- научиться экспериментально определять энтальпии реакции нейтрализации.
IV. Исходный уровень:
Для усвоения материала темы нужно знать:
1. Типы химических реакций: реакции соединения, разложения, обмена.
2. Тепловой эффект химических реакций.
3. Тепловой эффект при растворении.
4. Электролитическая диссоциация кислот, оснований, солей. Сильные и слабые электролиты.
5. Ионные уравнения.
V.Учебно-целевые вопросы:
1. Основные понятия химической термодинамики.
2. Внутренняя энергия и энтальпия индивидуальных веществ и многокомпонентных систем.
3. Теплота и работа. Теплоты химических реакций при постоянной температуре или P и V.
4. Термохимические уравнения.
5. Закон Гесса. Расчеты изменения стандартных энтальпий химических реакций и физико-химических превращений на основе закона Гесса.
6. Энтропия как мера неупорядоченности системы (уравнение Больцмана)
7. Энергия Гиббса как критерий самопроизвольного протекания процесса. Энтальпийный и энтропийный факторы.
VI. После изучения темы студент должен
знать:
основные начала термодинамики, термохимия; значения термодинамических потенциалов (энергий Гиббса и Гельмгольца); следствия из закона Гесса;
уметь:
- интерпретировать термодинамические понятия: система, состояние, свойства, параметры и функции состояния, термодинамические процессы;
- интерпретировать законы термодинамики и термохимии (I, II законы, закон Гесса);
- рассчитывать термодинамические функции состояния системы, тепловые эффекты химических процессов;
- интерпретировать рассчитанные значения термодинамических функций с целью прогнозирования возможности осуществления и направление протекания химических процессов;
- трактовать роль химической термодинамики и энергетики в биологических системах и медицинской практике.
Литература:
1. Ю.А.Ершов, В.А.Попков, А.С. Берлянд. Общая химия. Биофизическая химия. Химия биогенных элементов. Под ред. Ершова Ю.А. 10 –е изд. перераб. и доп. 2014 г.560 с.
2. Попков В. А. Общая химия: учебник/ В. А. Попков, С. А. Пузаков. -М.: ГЭОТАР-Медиа, 2009. -976 с.: ил.
3.Учебное пособие по общей и неорганической химии для самостоятельной работы студентов 1 курса фармацевтического факультета. Оренбург, 2009.- с. 74 – 84.
Эталоны решения задач
1. Некоторая реакция протекает с уменьшением энтропии. Определить, при каком условии возможно самопроизвольное протекание данной реакции.
Решение.
Условием самопроизвольного протекания реакции является уменьшение свободной энергии Гиббса, т.е. DG < 0. Изменение DG можно рассчитать по формуле:
DG =DH - T×DS
Так как в ходе реакции энтропия уменьшается (DS < 0), то энтропийный фактор препятствует самопроизвольному протеканию данной реакции. Таким образом, самопроизвольное протекание данной реакции может обеспечить только энтальпийный фактор. Для этого необходимо выполнение следующих условий:
1) DH < 0 (реакция экзотермическая);
2) 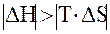 (процесс должен протекать при низких температурах).
(процесс должен протекать при низких температурах).
2. Эндотермическая реакция разложения протекает самопроизвольно. Оценить изменение энтальпии, энтропии и величины свободной энергии Гиббса.
Решение.
1) Так как реакция эндотермическая, то DH > 0.
2) В реакциях разложения энтропия возрастает, следовательно DS > 0.
3) Самопроизвольное протекание реакции свидетельствует о том, что DG < 0.
3. Вычислить стандартную энтальпию хемосинтеза, протекающего в бактериях Thiobacillus denitrificans:
6KNO3(тв.) + 5S(тв.) + 2CaCO3(тв.) = 3K2SO4(тв.) + 2CaSO4(тв.) + 2CO2(газ) + 3N2(газ)
по значениям стандартных энтальпий образования веществ:
| K2SO4 | CaSO4 | CO2 | KNO3 | CaCO3 | |
 , кДж/моль , кДж/моль
| -1438 | -1432 | -393,5 | -493 | -1207 |
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
Решение.
Запишем выражение первого следствия из закона Гесса с учетом того, что стандартные энтальпии образования серы и азота равны нулю:
 = (3×
= (3×  K2SO4+ 2×
K2SO4+ 2×  CaSO4+ 2×
CaSO4+ 2× 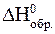 CO2) -
CO2) -
- (6×  KNO3+ 2×
KNO3+ 2×  CaCO3).
CaCO3).
Подставим значения стандартных энтальпий образования веществ:
 = 3×(-1438) + 2×(-1432) + 2×(-393,5) - (6×(-493) + 2×(-1207)).
= 3×(-1438) + 2×(-1432) + 2×(-393,5) - (6×(-493) + 2×(-1207)).
Получим:
 =-2593 кДж.
=-2593 кДж.
Так как  < 0, то реакция экзотермическая.
< 0, то реакция экзотермическая.
4. Вычислить стандартную энтальпию реакции:
2C2H5OH(жидк.)= C2H5OC2H5(жидк.)+H2O(жидк.)
по значениям стандартных энтальпий сгорания веществ:
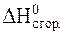 C2H5OH=-1368 кДж/моль;
C2H5OH=-1368 кДж/моль;
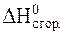 C2H5OC2H5=-2727 кДж/моль.
C2H5OC2H5=-2727 кДж/моль.
Решение.
Запишем выражение второго следствия из закона Гесса с учетом того, что стандартная энтальпия сгорания воды (высший оксид) равна нулю:
 = 2×
= 2× 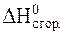 C2H5OH -
C2H5OH - 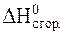 C2H5OC2H5.
C2H5OC2H5.
Подставим значения стандартных энтальпий сгорания веществ, участвующих в реакции:
 = 2×(-1368) -(-2727).
= 2×(-1368) -(-2727).
Получим:
 =-9 кДж.
=-9 кДж.
Следствия из закона Гесса позволяют вычислять не только стандартные энтальпии реакций, но и величины стандартных энтальпий образования и сгорания веществ по косвенным данным.
5. Определить стандартную энтальпию образования оксида углерода (II) по следующим данным:
| (1) | C(тв.)+ О2(газ)= СО2(газ); |  =-393,5 кДж/моль; =-393,5 кДж/моль;
|
| (2) | СО(газ)+  О2(газ)= СО2(газ); О2(газ)= СО2(газ);
|  =-283 кДж/моль. =-283 кДж/моль.
|
Решение.
Из уравнения (1) видно, что стандартное изменение энтальпии данной реакции соответствует стандартной энтальпии образования CO2.
Запишем выражение первого следствия из закона Гесса для реакции (2):
 =
=  CO2-
CO2-  CO.
CO.
Отсюда:
 CO =
CO =  CO2-
CO2-  .
.
Подставим значения и получим:
 CO =-293,5 -(-283) =-110,5 кДж/моль.
CO =-293,5 -(-283) =-110,5 кДж/моль.
Эту задачу можно решить и другим способом.
Вычитая из первого уравнения второе, получим:
| (1) - (2) | C(тв.)+  О2(газ)= СО(газ); О2(газ)= СО(газ);
|  CO =-110,5 кДж/моль. CO =-110,5 кДж/моль.
|
6. Вычислить стандартную энтропию реакции:
CH4(газ)+Cl2(газ)= CH3Cl(газ)+HCl(газ),
по значениям стандартных энтропий веществ:
| CH3Cl | HCl | CH4 | Cl2 | |
 , Дж/(моль×K) , Дж/(моль×K)
|
Решение.
Стандартную энтропию реакции вычислим по формуле:
 = (
= ( CH3Cl +
CH3Cl +  HCl) -(
HCl) -( CH4+
CH4+  Cl2).
Cl2).
Подставляя табличные значения, получим:
 = 234 + 187 - (186 + 223) = 12 Дж/(моль×K).
= 234 + 187 - (186 + 223) = 12 Дж/(моль×K).
7. Вычислить стандартную энергию Гиббса реакции:
C2H5OH(жидк.)+H2O2(жидк.)=CH3COH(газ)+ 2H2O(жидк.)
по следующим данным:
| CH3COH | C2H5OH | H2O | H2O2 | |
 , кДж/моль , кДж/моль
| -129 | -175 | –237 | –121 |
Определить, возможно ли самопроизвольное протекание данной реакции при стандартных условиях.
Решение.
Стандартную энергию Гиббса реакции вычислим по формуле:
 = (
= ( CH3COH + 2×
CH3COH + 2×  H2O) - (
H2O) - ( C2H5OH +
C2H5OH +  H2O2).
H2O2).
Подставляя табличные значения, получим:
 =-129 +2×(-237) - ((-175) + (-121) =-307 кДж/моль.
=-129 +2×(-237) - ((-175) + (-121) =-307 кДж/моль.
Так как  < 0, то самопроизвольное протекание данной реакции возможно.
< 0, то самопроизвольное протекание данной реакции возможно.
8. Рассчитать стандартную энергию Гиббса для реакции окисления глюкозы:
С6H12O6(тв.)+ 6O2(газ)= 6CO2(газ)+ 6H2O(жидк.).
по известным данным:
| H2O | CO2 | С6H12O6 | O2 | |
 , кДж/моль , кДж/моль
| -286 | -393,5 | –1274,5 | |
 , Дж/(моль×K) , Дж/(моль×K)
|
Решение.
Значения стандартных энтальпии и энтропии реакции рассчитаем при помощи первого следствия из закона Гесса:
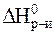 = 6
= 6  CO2+ 6
CO2+ 6  H2O -
H2O -  С6H12O6-6
С6H12O6-6  O2=
O2=
= 6×(-393,5) + 6×(-286) - (-1274,5) -6×0 =-2803 кДж;
 = 6
= 6  СО2+ 6
СО2+ 6  H2O -
H2O -  С6H12O6- 6
С6H12O6- 6  O2=
O2=
= 6×214 + 6×70 - 212 - 6×205 = 262 Дж/К = 0,262 кДж/К.
Стандартную энергию Гиббса реакции найдем из соотношения:
 =
= 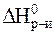 -T×
-T×  =-2803 кДж - 298,15 K×0,262 кДж/К =
=-2803 кДж - 298,15 K×0,262 кДж/К =
=-2881 кДж.
9. Вычислить стандартную энергию Гиббса реакции гидратации сывороточного альбумина при 250С, для которой DH0 =-6,08 кДж/моль, DS0 = -5,85 Дж/(моль×К). Оценить вклад энтальпийного и энтропийного фактора.
Решение.
Стандартную энергию Гиббса реакции рассчитаем по формуле:
DG0=DH0- T×DS0.
Подставив значения, получим:
DG0=-6,08 кДж/моль - 298 К×(-5,85×10-3) кДж/(моль×К) =
=-4,34 кДж/моль.
В данном случае энтропийный фактор препятствует протеканию реакции, а энтальпийный - благоприятствует. Самопроизвольное протекание реакции возможно при условии, если  , т.е., при низких температурах.
, т.е., при низких температурах.
Варианты задач для самостоятельного решения
Вариант № 1
1. Вычислить стандартную энтальпию реакции:
4NH3(газ)+ 5O2(газ)= 4NO(газ)+ 6H2O(газ),
используя значения стандартных энтальпий образования веществ:
| NH3 | NO | H2O | |
 , кДж/моль , кДж/моль
| -46,2 | 90,4 | -242 |
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
2. Вычислить стандартную энтальпию реакции:
С2H6(газ)+H2(газ)= 2CH4(газ),
используя значения стандартных энтальпий сгорания веществ:
| C2H6 | CH4 | |
 , кДж/моль , кДж/моль
| -1560 | -890 |
Вариант №2
1. Вычислить стандартную энтальпию реакции:
2NO2(газ)+O3(газ)=O2(газ)+N2O5(газ),
используя значения стандартных энтальпий образования веществ:
| NO2 | N2O5 | O3 | |
 , кДж/моль , кДж/моль
|
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
2. Вычислить стандартную энтальпию реакции:
С2H2(газ)+ 2H2(газ)=C2H6(газ),
используя значения стандартных энтальпий сгорания веществ:
| C2H2 | C2H6 | |
 , кДж/моль , кДж/моль
| -1300 | -1560 |
Вариант №3
1. Вычислить стандартную энтальпию реакции гидрирования бензола до циклогексана двумя способами, т.е., используя значения стандартных энтальпий образования и сгорания веществ:
| C6H6 | C6H12 | |
 , кДж/моль , кДж/моль
| -156 | |
 , кДж/моль , кДж/моль
| -3268 | -3920 |
2. Оценить возможность самопроизвольного протекания реакции:
Cu(тв.)+ZnO(тв.)=CuO(тв.)+Zn(тв.)
при стандартных условиях, если:
| ZnO | CuO | Zn | Cu | |
 , кДж/моль , кДж/моль
| -348 | -157 | ||
 , Дж/(моль×K) , Дж/(моль×K)
|
Вариант №4
1. Вычислить стандартную энтальпию хемосинтеза, протекающего в автотрофных бактериях Baglatoa и Thiothpix, по стадиям и суммарно:
2H2S(газ)+ O2(газ)= 2H2O(жидк.)+ 2S(тв.);
2S(тв.)+ 3O2(газ)+ 2H2O(жидк.)= 2H2SO4(жидк.),
если:
| H2S | H2O | H2SO4 | |
 , кДж/моль , кДж/моль
| -20 | -286 | -814 |
2. Вычислить стандартную энтальпию реакции:
С6H12O6(тв.)= 2C2H5OH(жидк.)+ 2CO2(газ),
используя значения стандартных энтальпий сгорания веществ:
| C6H12O6 | C2H5OH | |
 , кДж/моль , кДж/моль
| -2810 | -1368 |
Вариант №5
1. Вычислить стандартную энтальпию реакции:
2CH3Cl(газ)+ 3O2(газ)= 2CO2(газ)+ 2H2O(жидк.)+ 2HCl(газ),
используя значения стандартных энтальпий образования веществ:
| CH3Cl | CO2 | H2O | HCl | |
 , кДж/моль , кДж/моль
| -82 | -394 | -286 | -92 |
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
2. Вычислить стандартную энтальпию реакции:
С6H6(жидк.)+ 3H2(газ)=C6H12(жидк.),
используя значения стандартных энтальпий сгорания веществ:
| C6H6 | C6H12 | |
 , кДж/моль , кДж/моль
| -3302 | -3920 |
Вариант №6
1. Вычислить тепловой эффект реакции образования кристаллогидрата CuSO4×5H2O, протекающей по уравнению:
CuSO4(тв.)+ 5H2O(жидк.)=CuSO4×5H2O(тв.),
если известно:
| CuSO4×5H2O | CuSO4 | H2O | |
 , кДж/моль , кДж/моль
| -2278 | -662 | -286 |
2. Вычислить стандартную энтропию реакции:
С6H6(жидк.)+ 3H2(газ)=C6H12(жидк.),
по известным данным:
| C6H6 | C6H12 | H2 | |
 , Дж/(моль×K) , Дж/(моль×K)
| |||
| Вариант №7 |
1. Определить возможность протекания реакции:
P2O5(тв.)+ 3H2О(жидк.)= 2PH3(газ)+ 4O2(газ),
при стандартных условиях, если:
| P2O5 | PH3 | H2O | |
 , кДж/моль , кДж/моль
| -1350 | 13,4 | -237 |
2. Вычислить стандартную энтропию реакции:
3HNO2(водн. р-р)=HNO3(жидк.)+ 2NO(газ)+H2О(жидк.),
по известным данным:
| HNO2 | HNO3 | NO | H2O | |
 , Дж/(моль×K) , Дж/(моль×K)
| ||||
Вариант №7
1. Определить температуру, при которой самопроизвольно будет протекать реакция:
CO(газ)+ 2H2(газ)= CH3OH(жидк.),
если:  =-128 кДж;
=-128 кДж;  =-333 кДж/K.
=-333 кДж/K.
2. Вычислить стандартную энергию Гиббса реакции денатурации трипсина при 500С, для которой DH0= 283 кДж, DS0= 288 Дж/К). Оценить возможность протекания процесса в прямом направлении.
Вариант №8
1. Вычислить стандартную энтальпию образования MgCO3 по следующим данным:
MgO(тв.)+CO2(газ)=MgCO3(тв.)+118 кДж;
С(графит)+O2(газ)=CO2(газ)+393,5 кДж;
H2(газ)+ 0,5O2(газ)=H2O(жидк.)+286 кДж.
2. Вычислить стандартную энтропию реакции:
С2H6(газ)+H2(газ)= 2CH4(газ)
по известным данным:
| C2H6 | CH4 | H2 | |
 , Дж/(моль×K) , Дж/(моль×K)
|
Вариант №9
1. Вычислить стандартную энтальпию образования Ca3(PO4)2 по следующим данным:
3CaO(тв.)+P2O5(тв.)=Ca3(PO4)2(тв.)DH0=-739 кДж;
P4(тв.)+ 5O2(газ)= 2P2O5(тв.)DH0=-2984 кДж;
Ca(тв.)+ 0,5O2(газ)= CaO(тв.)DH0=-636 кДж.
2. Оценить возможность самопроизвольного протекания реакции:
Fe2O3(тв.)+ 3CO(газ)= 2Fe(тв.)+3CO2(газ)
при стандартных условиях, если:
| Fe2O3 | CO2 | CO | Fe | |
 , кДж/моль , кДж/моль
| -842 | -393,5 | -111 | |
 , Дж/(моль×K) , Дж/(моль×K)
|
Вариант №10
1. Вычислить стандартную энтальпию образования этанола по следующим данным:
DH0сгор.C2H5OH =-1368 кДж/моль;
С(графит)+O2(газ)=CO2(газ)+393,5 кДж;
H2(газ)+  O2(газ)=H2O(жидк.)+286 кДж.
O2(газ)=H2O(жидк.)+286 кДж.
2. Вычислить стандартную энтропию реакции:
С2H2(газ)+ 2H2(газ)=C2H6(газ),
по известным данным:
| C2H6 | C2H2 | H2 | |
 , Дж/(моль×K) , Дж/(моль×K)
|
Вариант №11
1. Вычислить стандартную энтальпию образования С2H4 по следующим данным:
С2H4(газ)+ 3O2(газ)= 2CO2(газ)+ 2H2O(жидк.)+1323 кДж;
С(графит)+O2(газ)=CO2(газ)+393,5 кДж;
H2(газ)+ 0,5O2(газ)=H2O(жидк.)+286 кДж.
2. Не производя вычислений, установить знак DS0 следующих процессов:
1) 2NH3(газ)=N2(газ)+ 3H2(газ);
2) CO2(кр.)=CO2(газ);
3) 2NO(газ)+ O2(газ)= 2NO2(газ).
Вариант №12
1. Вычислить стандартную энтальпию образования ZnSO4 по следующим данным:
2ZnS + 3O2= 2ZnO + SO2DH0=-890 кДж;
2SO2+ O2= 2SO3DH0=-196 кДж;
ZnSO4= ZnO + SO3DH0=+234 кДж.
2. Вычислить стандартную энтропию реакции:
2KClO3(тв.)= 2KCl(тв.)+ 3O2(газ)
по известным данным:
| KClO3 | KCl | O2 | |
 , Дж/(моль×K) , Дж/(моль×K)
|
Вариант №13
1. Вычислить стандартную энтропию реакции:
С6H6(жидк.)+ 3H2(газ)=C6H12(жидк.),
по известным данным:
| C6H6 | C6H12 | H2 | |
 , Дж/(моль×K) , Дж/(моль×K)
|
2. Определить возможность протекания реакции:
P2O5(тв.)+ 3H2О(жидк.)= 2PH3(газ)+ 4O2(газ),
при стандартных условиях, если:
| P2O5 | PH3 | H2O | |
 , кДж/моль , кДж/моль
| -1350 | 13,4 | -237 |
Вариант №14
1. Вычислить стандартную энтропию реакции:
3HNO2(водн. р-р)=HNO3(жидк.)+ 2NO(газ)+H2О(жидк.),
по известным данным:
| HNO2 | HNO3 | NO | H2O | |
 , Дж/(моль×K) , Дж/(моль×K)
|
2. Определить температуру, при которой самопроизвольно будет протекать реакция:
CO(газ)+ 2H2(газ)= CH3OH(жидк.),
если:  =-128 кДж;
=-128 кДж;  =-333 кДж/K.
=-333 кДж/K.
Вариант №15
1. Рассчитать тепловой эффект реакции для стандартных условий (∆Н0)
3Mn3O4 + 8Al→ 4Al2O3 + 9Mn
если известно: ∆Н0298(Mn3O4) = - 1385 кДж/моль
∆Н0298(Al2O3) = - 1675 кДж/моль
2. Определите ∆G следующего процесса:
Fe3O4(к) + 4CO(г) = 3Fe + 4CO2(г), если
∆G (Fe3O4(к)) = -1014 кДж/моль
∆G (CO(г)) = -137,2 кДж/моль
∆G (CO2(г)) = -394 кДж/моль
Возможно ли самопроизвольное протекание процесса в стандартных условиях?
Вариант №16
1.Реакция горения этана выражена термодинамическим уравнением:
C2H6(г) + 3,5 O2(г) = 2 CO2(г) + 3 H2O(ж);
 = -1559,87 кДж/моль. Вычислите энтальпию образования этана, если известны стандартные энтальпии образования:
= -1559,87 кДж/моль. Вычислите энтальпию образования этана, если известны стандартные энтальпии образования:
CO2 (г)  = -393,57 кДж/моль
= -393,57 кДж/моль
H2O(ж)  = -285,84 кДж/моль
= -285,84 кДж/моль
H2O(ж)  = -285,84 кДж/моль
= -285,84 кДж/моль
2.На основании стандартных энтальпий образования и абсолютных стандартных энтропий (таблица 1) соответствующих веществ вычислите изменение энергии Гиббса
CO(г) + 3H2(г) = CH4(г) + H2O(г), а так же определите возможность протекания данной реакции в прямом направлении при стандартных условиях.
Вариант №17
1.На основании стандартных энтальпий образования и абсолютных стандартных энтропий (таблица 1) соответствующих веществ вычислите изменение энергии Гиббса
2H2O2(ж) = 2H2O(ж) + O2(г)
а так же определите возможность протекания данной реакции в прямом направлении при стандартных условиях.
2. Вычислить стандартную энтальпию реакции:
4NH3(газ)+ 5O2(газ)= 4NO(газ)+ 6H2O(газ),
используя значения стандартных энтальпий образования веществ:
| NH3 | NO | H2O | |
 , кДж/моль , кДж/моль
| -46,2 | 90,4 | -242 |
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
Вариант №18
1. На основании стандартных энтальпий образования и абсолютных стандартных энтропий (таблица 21) соответствующих веществ вычислите изменение энергии Гиббса
N2(г) + 3H2(г) = 2NH3(г)
а так же определите возможность протекания данной реакции в прямом направлении при стандартных условиях.
2. Вычислить стандартную энтальпию реакции:
2CH3Cl(газ)+ 3O2(газ)= 2CO2(газ)+ 2H2O(жидк.)+ 2HCl(газ),
используя значения стандартных энтальпий образования веществ:
| CH3Cl | CO2 | H2O | HCl | |
 , кДж/моль , кДж/моль
| -82 | -394 | -286 | -92 |
Определить, к какому типу (экзо- или эндотермическому) относится эта реакция.
Таблица 1.
Термодинамические свойства
| Вещество | DН  ,
кДж/моль ,
кДж/моль
| S  ,
Дж/(моль.К) ,
Дж/(моль.К)
| Вещество | D Н  ,
кДж/моль ,
кДж/моль
| S  ,
Дж/(моль.К) ,
Дж/(моль.К)
|
| Ag | Ba | ||||
| AgCl | -127 | BaCO3 | -1201 | ||
| AgNO3 | -124 | BaO | -538 | ||
| Al | BaSO4 | -1458 | |||
| Al2O3 | -1675 | ВeO | -607 | ||
| Al(OH)3 | -1295 | Be(OH)2 | -905 | ||
| Al2S3 | -509 | Br2 (г) | +31 | ||
| AsH3 (г) | +171 | Br2(ж) | |||
| B | C (граф) | ||||
| В2О3 | -1272 | C (алм) | +2 | ||
| H3BO3 | -1094 | СН4(г) | -75 | ||
| B2H6(г) | +35 | С2Н6(ж) | +226 | ||
| С6Н6(ж) | +49 | Н2О (к) | -292 | ||
| С2Н5ОН (ж) | -277 | Н2О2(ж) | -187 | ||
| СН3СНO (ж) | -296 | Н2S(г) | -21 | ||
| СН3СООН (ж) | -484 | Н2Se(г) | +30 | ||
| С6Н12О6 | -1273 | Н2Te(г) | +99 | ||
| С12Н22О11 | -2221 | I2(к) | |||
| CH3-OH(ж) | -239 | I2(г) | |||
| С2Н2(г) | +227 | K2O | -363 | ||
| С2Н4(г) | +52 | KOH | -425 | ||
| CO (г) | -110 | KCl | -437 | ||
| СО2(г) | -393 | KClO3 | -399 | ||
| Ca | MgO | -601 | |||
| СаО | -635 | Mg(OH)2 | -925 | ||
| Са(OH)2 | -985 | MgCO3 | -1069 | ||
| CaCO3 | -1207 | N2(г) | |||
| Ca3(PO4)2 | -4125 | 236- | NH3(г) | -46 | |
| Cl2(г) | NH4Cl | -315 | |||
| Cl2O7(г) | +76 | (NH4)Cr2O7 | -1808 | - | |
| Cr2O3 | -1141 | NH4NO3 | -366 | ||
| Cu(NO3)2 | -310 | NO (г) | +91 | ||
| CuO | -156 | NO2(г) | +33 | ||
| FeO | -266 | N2O3(г) | +83 | ||
| Fe2О3 | -824 | N2O (г) | +82 | ||
| H2(г) | N2O5(г) | +11 | |||
| HBr(г) | -36 | Na2CO3 | -1132 | ||
| HCl(г) | -92 | NaCl | -411 | ||
| HF(г) | -271 | NaHCO3 | -914 | ||
| HI(г) | +24 | Na2O | -418 | ||
| H2O(г) | -242 | NaOH | -425 | ||
| H2O(ж) | -286 | Na2SO4 | -1388 | ||
| О2(г) | SO3(г) | -396 | |||
| О3(г) | +143 | SiO2 | -912 | ||
| Рb(NO3)2 | -447 | SnO2 | -581 | ||
| PbO | -219 | SrCO3 | -1232 | ||
| PbS | -101 | SrO | -604 | ||
| PbSO4 | -920 | Zn | |||
| S (к) | ZnO | -351 | |||
| S (г) | +128 | ZnCO3 | -812 |