"Смог" (от англ. smoke — дым, fog — туман) — это сочетание газообразных и твердых примесей с туманом или аэрозольной дымкой. Встречается "смог" Лондонского (химический смог) или Лос-Анджелеского (фотохимический смог) типа. В первом случае причиной возникновения "смога" служит сжигание угля и мазута. При высокой влажности атмосферы образуется густой туман с примесью частиц сажи и SO2. Свое название этот "смог" получил после трагедии зимой 1952 г., когда в Лондоне в результате его образования умерло 3200 человек.
Фотохимический "смог" был впервые отмечен в 1944 г. в Лос-Анджелесе, когда в результате большого скопления автомобилей была парализована жизнь одного из крупнейших городов США. Фотохимический "смог" возникает под действием солнечного света в отсутствие ветра при низкой влажности воздуха. Наблюдается сильное раздражение слизистых оболочек дыхательных путей и глаз. Сохранение "смоговой" ситуации в течение длительного времени приводит к повышению заболеваемости и смертности среди населения. Особенно сильно "смог" влияет на детей и пожилых людей. Он оказывает вредное воздействие и на растительность, вызывая увядание и гибель листьев. Кроме того, фотохимический "смог" усиливает коррозию металлов, разрушение строительных сооружений, резины и других материалов.
Фотохимические процессы в системе О3 — NOх — Н20 — RH служат основной причиной образования фотохимического смога, компоненты которого — пероксиацетилнитраты (ПАН) и озон — токсичны для человека. ПАН — название группы соединений типа
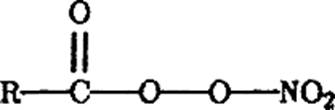
где R – СН3, С6Н5 и т.д. Эти соединения образуются в результате превращений:
·OH O2 NO O2
RCH3 ® R·CH2 ® RCH2OO· ® RCH2O· ® RC(O)H
·OH O2 NO2
® R-·С=О ® R-C(O)-O-O· ® R-C(O)-O-O-NO2
Как указывалось, окислительный характер фотохимическому "смогу" придают озон и пероксилацетилнитраты. Измерения, проведенные в 50-х годах в Лос-Анджелесе, показывают, что увеличение концентрации озона связано с характерным изменением относительного содержания N02 и NO.
Ухудшение видимости во время "смога" (появление голубоватой дымки или беловатого тумана) связано с образованием при окислении органических соединений аэрозольных частиц.
ВОДА В АТМОСФЕРЕ
Помимо поддержания теплового баланса Земли вода играет исключительную роль в миграции и трансформации различных веществ в атмосфере. Циркуляция воды в природе осуществляется в так называемом глобальном цикле (см. рис).
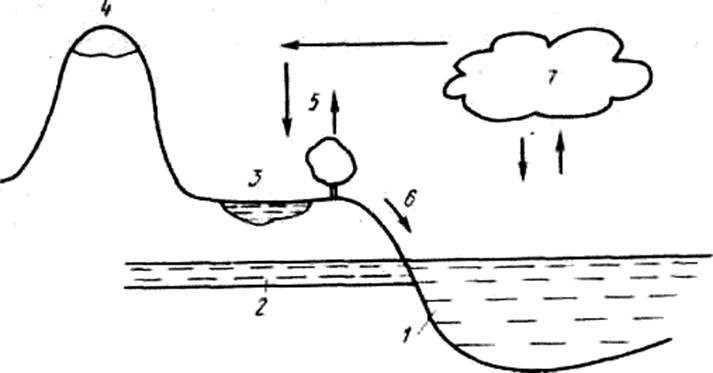
Рис. Круговорот воды в глобальном природном цикле:
1 — Мировой океан; 2 — почвенные и грунтовые воды; 3 — поверхностные воды суши; 4 — снег и лед; 5 — транспирация; 6 —речной (поверхностный) сток; 7 — вода в атмосфере в виде паров и атмосферной влаги
Вода испаряется в атмосферу с водных поверхностей, из почвы, путем транспирации. Поднимаясь в воздух, по мере охлаждения она конденсируется с образованием атмосферной влаги, переносится воздушными массами, выпадает в виде дождя или снега на поверхность суши, просачивается внутрь почвы с образованием грунтовых вод или стекает по поверхности, образуя поверхностный (речной) сток.
В среднем около 10% тропосферы Земли по эффективному объему постоянно занято облаками, хотя доля собственно жидкой.воды в ней невелика — всего 10-7— 10-6.
Облачный слой постоянно покрывает более половины поверхности Земли и имеет толщину от нескольких сотен до тысяч метров. Эффективный объем облаков увеличивается за счет потока воздуха, проходящего через слой облаков со скоростью от 0,1 до 10 м/с.
Образование жидкой воды тесно связано с наличием в атмосфере аэрозолей — твердых или жидких частиц, обладающих малыми скоростями осаждения и находящихся во взвешенном состоянии. Жидкая вода присутствует в атмосфере во многих формах, главным образом в виде дымки, тумана, облаков и дождя.
Каждая капелька влаги в атмосфере, возникающая при конденсации водяных паров, — это своего рода микроводоем с определенным химическим составом. На границе раздела воздух — вода этого микроводоема интенсивно протекают процессы газожидкостного обмена с окружающей воздушной средой.
Помимо растворенных атмосферных газов капли воды содержат также растворенные и твердые неорганические и органические загрязнители атмосферы. В результате капля атмосферной влаги представляет собой газожидкостный микрореактор со сложным и изменчивым химическим составом. В этом реакторе под действием солнечного излучения и электрических зарядов могут происходить всевозможные химические превращения, главным образом окислительного характера с участием кислорода и продуктов его активации.
Время жизни капель невелико — от нескольких минут в случае больших дождевых капель до примерно часа в каплях облаков. Время жизни частиц "смога" размером меньше 1 мкм достигает недели. В табл. 1 приведены характерные размеры капель воды, содержание влаги на единицу объема воздуха, значения рН, ионной силы и содержание оксидов железа и марганца как потенциальных катализаторов окислительно-восстановительных превращений в атмосферной влаге. В частицах дымки вода присутствует в виде тонкой пленки жидкости на твердой поверхности, а в каплях дождя — в виде гомогенной жидкой фазы.
Таблица 1. Свойства частиц атмосферной влаги
| Водная среда | Размер частиц, мкм | Массовое содержание воды, г/м3 | рН | Ионная сила, моль/л | Содержание оксидов металлов в пересчете на элемент, моль/л | |
| Fe | Mn | |||||
| Дымка Туман Облака Дождь | 0,03-0,3 200-2000 | 10-5-10-4 0,02-0,2 0,1-3 0,1-1 | 1-8 2-6 3-6 4-5 | 10-3-10-2 10-3-10-2 10-4 | 10-4-10-3 10-6-10-4 10-7-10-4 10-8-10-5 | 10-7-10-4 10-7-10-5 10-8-10-5 10-8-10-6 |
Чтобы конкурировать с газообразными процессами, химические реакции в атмосферных водных частицах должны быть весьма эффективными. Тем не менее многие процессы протекают именно в атмосферной влаге. Связано это с тем, что многие газовые компоненты обладают высокой растворимостью в воде.
Растворимость в воде тесно связана с коэффициентом Генри (табл. 2), устанавливающим пропорциональную связь между содержанием вещества в жидкой и газовой фазах в условиях термодинамического равновесия.
Таблица 2. Значения констант Генри (Н) для некоторых газов при 25°С
| Вещество | Н, моль/(л×атм) | Вещество | Н, моль/(л×атм) |
| О3 | 9,4-10-3 | H2S | 9,9-10-2 |
| О2 | 1,6-10-3 | SO2 | 1,23 |
| N0 | 1,9-10-3 | Н2О2 | 105 |
| N02 | НО2· | 105 | |
| HN02 | 48,6 | НСl | 2,0 |
| HN03 | 2,1×105 | НС(О)Н | |
| NH3 | 57,9 | Пероксиацетил-нитрат (ПАН) | 4,0 |
Как видно, многие газы растворяются в воде незначительно. В то же время вещества, участвующие в кислотно-основных или кето-енольных превращениях, могут обладать повышенной растворимостью за счет образования в растворе других химических форм. Так, в случае S02 растворимость будет повышаться вследствие взаимодействия S02 с водой с последующей диссоциацией сернистой кислоты:
S02 + Н20 ® H2S03
H2SO3 ⇄ HSO3- + Н+ и т.д.
Аналогично, повышенная растворимость N02 связана с протеканием следующих реакций:
2N02 + Н20 ® HN02 + HNO3
HN02 ⇄ N02- + Н+
HN03 ⇄ NO3- + Н+
а повышенная растворимость формальдегида — с реакцией
НС(0)Н + Н20 ® СН2(ОН)2
Вещества, для которых эффективный коэффициент Генри превышает 4×104 моль/(л×атм), будут находиться в атмосфере преимущественно в растворенной форме.
Следовательно, из табл. 2 с учетом комментария к ней можно выделить наиболее растворимые загрязняющие вещества, которые будут окисляться в жидкой фазе (S02, НC(О)H, NH3). Вопрос о количественном вкладе жидкофазных процессов окисления по сравнению с газофазными не решен, поскольку не известны коэффициенты аккомодации (захвата) радикалов каплями. Так или иначе, но с осадками на сушу и в океан возвращаются сера и азот в форме H2SO4, HNO3, (NH4)2S04, NH4NO3.
В химии облаков и капель дождя играют роль присутствующие в газовой фазе окислители О3, Н2О2 и образующиеся в результате фотохимических процессов свободные радикалы ·ОН, НО2·, а также их органические аналоги — RO2·, ROOH и др.
В силу большого коэффициента Генри у Н2О2 атмосферная влага содержит значительные концентрации пероксида водорода. Так, в дожде содержание Н2О2 в среднем около 10-5 моль/л, в грозовом дожде концентрация Н2Ог может достичь 10-4 моль/л, в снеге содержание Н2О2 несколько меньше — 10-5 моль/л.
Поскольку пероксид водорода является сильным окислителем, в присутствии ионов железа и марганца он может участвовать в жидкофазном окислении SO2:
S02 + Н202 ® H2SO4
Эта реакция служит одной из основных причин образования кислотных дождей.
Пероксокислоты и органические пероксиды обладают высокой растворимостью и в водной фазе могут играть роль окислителей типа Н2О2. Содержание органических окислителей в облаках и дождевой воде достигает 4×10-5 моль/л, что сравнимо с содержанием в дождевой воде Н2О2. Как правило, в зимнее время содержание окислителей в атмосферной влаге гораздо ниже, чем летом. Органические окислители и Н2О2 ответственны за появление в атмосферной влаге и в дождевой воде органических кислот.
Парниковый эффект.