Торможение дыхания митохондрий при исчерпании АДФ имеет очевидный положительный смысл, поскольку происходит экономия питательных веществ в условиях покоя. Однако здесь не обходится без "ложки дегтя". Дело в том, что торможение дыхания при росте ΔμH+ сопровождается тремя событиями, резко повышающими вероятность "паразитного" одноэлектронного восстановления О2.
1. Из-за снижения скорости потребления кислорода растет его концентрация, сдвигаясь из области В в область С (см. рис. 1).
2. По той же причине возрастает степень восстановления флавинов, кофермента Q (CoQ) и негемовых железопротеинов, то есть основных мишеней для "паразитных" реакций с О2.
3. Пожалуй, еще большее значение может иметь тот факт, что не только возрастает количество восстановителей кислорода, но и меняется их качество. Здесь я имею в виду прежде всего CoQ. Показано, что в состоянии активного дыхания восстановленной формой этого компонента служит CoQH2. Что касается убисемихинона (CoQ•-), он играет роль мобильного короткоживущего промежуточного соединения (интермедиата), пока ΔμH+ не слишком велика. При увеличении ΔμH+ количество CoQ•- возрастает экспоненциально. CoQ - весьма реакционноспособное подвижное соединение. Окислительно-восстановительный потенциал пары CoQ / CoQ•-, как и потенциал О2 / O2•-, сдвинут в отрицательную область. Этим CoQ отличается от CoQH2. CoQ•- чрезвычайно активен как одноэлектронный восстановитель О2.
"НЕОМИЧЕСКАЯ" УТЕЧКА ПРОТОНОВ
Как показали Боверис и Чанс, образование Н2O2 митохондриями клеток животных в условиях in vitro, вполне заметное при дефиците АДФ, становится практически неизмеримым при добавлении АДФ. Поскольку сравнительно небольшое снижение ΔμH+, вызываемое аденозиндифосфатом, оказывается достаточным, чтобы прекратилось накопление Н2О2, можно принять, что такой эффект будет достигаться при сравнительно небольшом увеличении утечки ионов Н+, не сопряженной с синтезом АТФ.
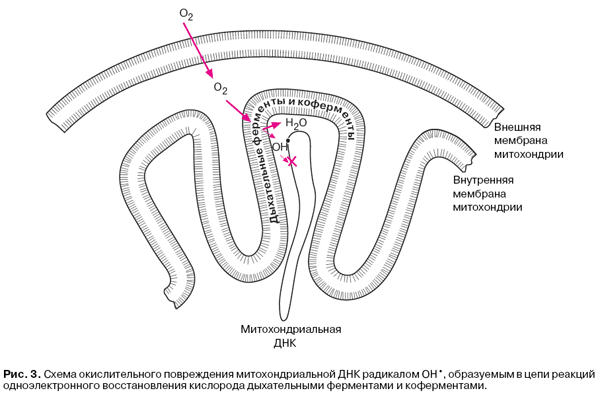
Заманчиво предположить, что митохондрии располагают специальным механизмом увеличения утечки в состоянии покоя. Этот механизм мог бы предотвратить полное торможение дыхания, сильное восстановление дыхательных ферментов и коферментов и накопление CoQ•-. Он должен включаться, когда АДФ исчерпывается, и выключаться, когда АДФ появляется вновь. В отличие от сужения капилляров, механизм утечки должен действовать на внутриклеточном, а не надклеточном уровне. Механизм такого рода может иметь отношение к явлению "неомичности" сопротивления митохондриальной мембраны. Суть его состоит в том, что при высоких ΔμH+ сопротивление резко снижается, перестав подчиняться закону Ома. Это происходит за счет роста протонной проводимости мембраны. Пороговое значение ΔμH+, выше которого включается "неомичность", лежит над тем уровнем ΔμH+, который поддерживается в условиях синтеза АТФ. Есть данные, что "неомичность" стимулируется тиреоидными гормонами и подавляется мужскими половыми гормонами и прогестероном. "Неомичность" мембраны позволяет поддерживать низкую концентрацию О2 независимо от доступности АДФ и без торможения синтеза АТФ. И, что, вероятно, еще важнее, она предотвращает накопление CoQ•-, образуемого дыхательными ферментами, которые, во-первых, ответственны за генерацию большей части Q•- в клетке и, во-вторых, локализованы во внутренней мембране митохондрий, то есть вблизи митохондриальной ДНК, находящейся в митохондриальном матриксе (рис. 3).
По-видимому, именно митохондриальная ДНК служит наиболее уязвимой мишенью для активных производных кислорода. Существует множество свидетельств, что окислительное повреждение митохондриальной ДНК играет ключевую роль в целом ряде "митохондриальных болезней", а также в процессах старения. Что касается ядерной ДНК, она находится слишком далеко от мест образования активных производных кислорода, которые, вероятно, успевают инактивироваться еще на пути к ядру.
Эффекты такого рода могли бы объяснить недавнее наблюдение на мутанте дрожжей, дефицитном по супероксиддисмутазе. Рост этого мутанта резко тормозился при повышении концентрации кислорода. Неблагоприятный эффект О2 удалось снять путем введения еще одной мутации (Rho0), приводящей к отсутствию ферментов дыхания. Описаны благоприятные эффекты увеличения супероксиддисмутазы при нормальном уровне О2. Например, одновременная повышенная экспрессия супероксиддисмутазы и каталазы увеличивает продолжительность жизни дрозофил.