Оксазолидиноны: линезолид. История создания, химическое строение, связь структуры и действия, способы получения, контроль качества.
Научный руководитель:
м.ф.н., старший преподаватель Лишай А.В.
Минск, 2020
ОГЛАВЛЕНИЕ
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ.. 3
ВВЕДЕНИЕ. 4
1 ИСТОРИЯ СОЗДАНИЯ.. 5
2 ХИМИЧЕСКОЕ СТРОЕНИЕ. 7
3 СВЯЗЬ СТРУКТУРЫИ ДЕЙСТВИЯ.. 8
4 МЕХАНИЗМ ДЕЙСТВИЯ.. 9
5 СПОСОБЫПОЛУЧЕНИЯ.. 11
6 КОНТРОЛЬ КАЧЕСТВА.. 19
ЗАКЛЮЧЕНИЕ. 22
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ.. 23
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ
ВЭЖХ —высокоэффективная жидкостная хроматография;
ГФ РБ — Государственная фармакопея Республики Беларусь;
ГФ РФ —Государственная фармакопея Российской Федерации;
ДМФ — диметилформамид;
ЕЭ — единицы эндотоксина;
ИК — инфракрасная спектроскопия;
ЛС — лекарственное средство;
ЛФ — лекарственная форма;
ТГФ — тетрагидрофуран;
УФ — ультрафиолет;
ЧФС — частная фармакопейная статья;
ЯМР — ядерный магнитный резонанс;
FDA— Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (подразделение Министерства здравоохранения США);
MRSA— метициллинрезистентный золотистый стафилококк;
VRE— устойчивый к ванкомицину энтерококк.
ВВЕДЕНИЕ
Актуальность темы. В конце XX века человечество столкнулось с, казалось, страшной и неразрешимой проблемой устойчивости грамположительных бактерий к антибиотикам, наиболее популярные пенициллины и цефалоспорины уже не помогали. Серьезным ударом стали нозокомиальные инфекции, требуя срочной смены тактики лечения и выбора нового класса антибактериальных средств.
С 1993 по 2003 год Национальная система надзора за внутрибольничными инфекциями Центров по контролю и профилактике заболеваний США сообщила о росте заболеваемости MRSA с 35,9% до 64,4% [1]. Даже ванкомицин, назначаемый при подобных случаях, встречал резистентность. В Европе, по результатам внутрибольничных исследований, смертность от госпитальных инфекций составила 50% от всех инфицированных, что соответствует 25000 случаям в год, треть из которых вызваны грамположительными микроорганизмами [2].
В настоящее время 90–95% клинических штаммов S. aureus, которые вызывают нозокомиальные пневмонии и инфекции мягких тканей, во всем мире устойчивы к пенициллину. При таких инфекциях распространенность резистентности к метициллину превышает 50% в больницах и 60% в отделениях интенсивной терапии, кроме того, в последние десятилетия растет заболеваемость MRSA, ассоциированных с населением. Появилась острая необходимость в разрешении сложившейся ситуации ― спасение нашли в линезолиде [3].
Цель данной курсовой работы ― изучение линезолида как первого и долгое время единственного представителя класса оксазолидинонов.
Для достижения поставленной цели были определены следующие задачи:
• познакомиться с историей открытия линезолида;
• рассмотреть его химическое строение;
• определить связь структуры и фармакологической активности линезолида;
• ознакомиться с запатентованными способами получения линезолида;
• проанализировать методы контроля качества линезолида, а также провести сравнительную характеристику указанных методов, основываясь на статьях основных фармакопей.
В курсовой работе были применены следующие методы: изучение учебных пособий, электронных ресурсов, научных статей по данной теме, сравнительный анализ фармакопей различных государств.
ИСТОРИЯ СОЗДАНИЯ
Оксазолидиноны были синтезированы в качестве ингибиторов МАО-В для лечения депрессиив Каламазу, штат Мичиган. Антимикробные свойства это класса соединений были обнаружены в 1970-х годах EI DuPont de Nemours and Company, а с 1978 г. оксазолидиноны рекомендованы в борьбе с бактериальными и грибковыми заболеваниями растений (исследовались на листьях томатов). В 1984 г. описаны антибактериальные свойстваDuP-105 и DuP-721in vitro, включая грамположительные бактерии, некоторые анаэробы иMycobacterium tuberculosis, затем подтверждены на моделях млекопитающих, однако выявлена летальная токсичность DuP-721 (предположительно миелосупрессия) и разработки были завершены [4, 5].
Ученые изPharmacia & Upjohn (сегодня часть Pfizer) во главе с докторомSt. Brickner рассмотрели перспективу нового класса и начали собственную программу исследований оксазолидинонов в 1990-х годах. Изменив строение веществ с учетом анализа «структура-активность» и добившись успешных модификаций, были открыты эперезолид (PNU-100592) и линезолид (PNU-100766). Результаты доклинических исследований показали вещества схожими по эффективности и безопасности и были переведены на клинические испытания для выявления различий фармакокинетики. Ввиду большей продолжительности периода полувыведения линезолида (прием дважды в день, в то время как у эперезолида трижды для достижения аналогичного эффекта), первый был отобран для дальнейших испытаний [2, 4, 6].
Линезолид показал устойчивую эффективность и спектр в отношении
• грамположительных бактерий: устойчивых к ванкомицину E. faecium и E. faecalis ― VRE,с множественной лекарственной устойчивостью штаммов S. pneumoniae для лечения госпитальной и внебольничной пневмонии (чувствительность 99,64%);
• устойчивых к метициллину штаммов S. aureus ― MRSA (чувствительность 99,5%) [2].
Сегодня он показан при лечении нозокомиальной пневмонии и инфекций кожи и мягких тканей, вызванных аэробными и анаэробными грамположительными бактериями.Линезолид на 100% биодоступен, его вводят в равных дозах перорально или парентерально.При приёме внутрь относительно безопасен, вызывая лишь диспепсию, но при курсе свыше 2 недельможет вызвать обратимое подавление функции костного мозга и тромбоцитопению (требует мониторинга анализа крови), периферическую невропатию, гипогликемию, поражение зрительного нерва и лактатацидоз, что возникает в связи с токсическим поражением митохондрий. Не принимают с ингибиторами МАО А и В, трициклическими антидепрессантами, дети до 12 лет[3].
В 2000 г. линезолид был одобрен к применению FDA, в 2014 ― тедизолид, ведутся разработки посизолида, ранбезолида, торезолида, радезолида [7].
На фармацевтическом рынке РБ представлен Линезолидом в таблетках по 300мг и 600мг, покрытых оболочкой, Белмедпрепаратов (РБ) и Тева (Израиль). В РФ также зарегистрированы Амизолид, бактолин, зеникс, зивокс, инфилинез, линеген, роулин-роутек. Также Белмедпрепаратами производится и иная ЛФ ― 0,2% раствор для инфузий по 100, 200 и 300мл бесцветного или слегка желтоватого раствора, чаще применим в стационарах. В 2020 г. предприятием зарегистрированы гранулы для приготовления суспензии для внутреннего применения 100мг/5мл [8,9].
ХИМИЧЕСКОЕ СТРОЕНИЕ
ИЮПАК: (S)-N-({3-[4-морфолин-3-фторфенил]-2-оксо-1,3-оксазолидин-5-ил}метил)ацетамид.
МНН: Линезолид (рус.), Linezolid (англ.).
Брутто-формула: C16H20FN3O4.
Является производным оксазолидинона, полностью синтетическим соединением и более простым по строению в сравнении с натуральными антибиотиками. Молекулярный масса его невелика (337.346 г/моль), имеет единственный хиральный центр. При физиологических показателях pH=7,4 находится в незаряженном состоянии [2, 10].
СВЯЗЬ СТРУКТУРЫИ ДЕЙСТВИЯ
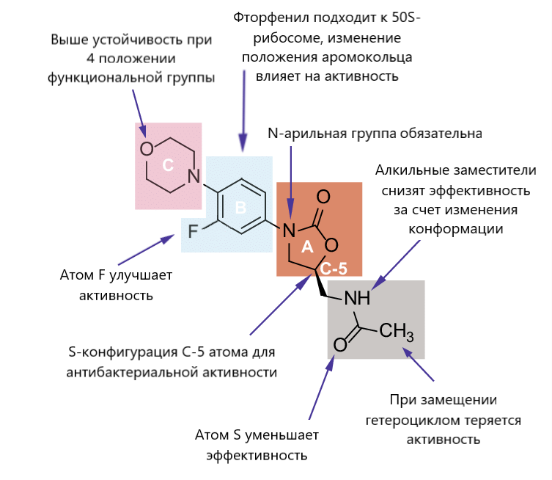
Оксазолидиноны считают относительно новым классом антибактериальных средств, их структура изучалась и модифицировалась компаниями DuPont и Pharmacia со следующими результатами в отношении наиболее успешного средства ― линезолида:
Рисунок 3.1 – Связь структуры и действия линезолида
· 5-ациламинометильная группа обязательна;
· 5-S конфигурация необходима для антибактериальной активности, R-конфигурация приводит к ее потере;
· N-арильная группа также необходима для антибактериальной активности, О- или S-арильные группы снижают активность;
· Фтор оптимален для обеспечения действия, хотя и необязателен (электроноакцепторная группа в арильном кольце улучшает эффективность);
· Заместители в пара-положении ароматического кольца не влияют на антибактериальную активность, но могут изменять растворимость и фармакокинетику ― морфолин усиливает их;
· Заместители в орто-арильном положении оказывают пагубное или индифферентное воздействие на антибактериальную активность [4, 6, 11, 12].
МЕХАНИЗМ ДЕЙСТВИЯ
Ранние работы по изучению механизма действия оксазолидинонов предполагали ингибирование синтеза белка. Проводившиеся в то же время исследования показали отсутствие перекрестной резистентности с известными противомикробными средствами, что дало возможность предугадать уникальность влияния оксазолидинонов на трансляцию. Это было подтвеждено экспериментами по конкурентному связыванию с хлорамфениколом и линкомицином, которые продемонстрировали, что удлинение полисома, взаимодействие мРНК с рибосомами и прекращение трансляции не ингибируются оксазолидинонами [5, 11].
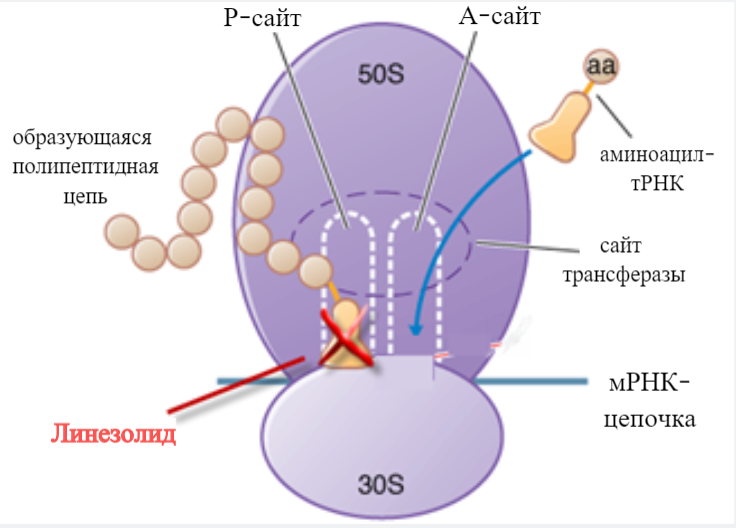
Рисунок 4.1 – Механизм действия линезолида в центре рибосомы [13]
Дальнейшее изучение с помощью лабораторных мутантов, устойчивых к влиянию оксазолидинонов, в результате последовательного пассажа помогло выделить центральную петлю домена V 23S рРНК ― данный участок входит в пептидилтрансферазный центр 50S-рибосомы. Эксперименты с радиоактивно меченными производными, ЯМР и молекулярное моделирование показали связывание в сайте A пептидилтрансферазного центра, где вещество занимает область аминоацильного остатка аминоацил-тРНК [14].
Таким образом, оксазолидиноны связываются с 50S-рибосомой прокариотов, предотвращают образование комплекса с 30S-субъединицей, мРНК, fMet-тРНК и факторами инициации, делая невозможным инициацию синтеза белка. Принципиально иной механизм действия сравнительно с ингибиторами синтеза белка, как хлорамфеникол, макролиды, линкозамиды и тетрациклины, влияющими на элонгацию, позволяя начало трансляции мРНК, имеет ряд преимуществ:
1) активность оксазолидинонов не блокируется метилазами рРНК, нет конкуренции с мишенями существующих ингибиторов синтеза белка;
2) предотвращение синтеза стрептококковых и стафилококковых факторов вирулентности, как гемолизины, коагулаза, протеин А [6, 15].
Рисунок 4.2 – Сравнение механизмов действия ингибиторов
синтеза белка[16]
СПОСОБЫПОЛУЧЕНИЯ
На сегодняшний день запатентовано несколько способов получения линезолида, их считают относительно простыми. Требование к S-стереоизомеру в C5–положении было установлено еще в ходе ранних этапов разработки компанией DuPont и было разрешено с помощью энантиомерно чистого исходного материала.
Способ 1. Одним из самых известных стал результат оптимизации первоначального промышленного синтеза разработокUpjohn и Pharmacia (Brickner et al., 2008), которыйдает линезолид с общим выходом 65%.Недостатком данного метода являются дорогостоящие реагенты, как палладий на древесном угле, что приводит к высокой стоимости линезолида, сформированной преимущественно затратами на синтез [15].
Три первых этапа синтеза являются стандартными для всех способов, и одновременно эффективными:
1) нуклеофильное ароматическое замещение 4-фторгруппы в 3,4-дифторнитробензоле(II) на морфолин(I);
2) восстановление ароматической нитрогруппы(III), катализируемое палладием, с получением ароматического амина(IV);
3) Добавление карбобензилоксигруппы к амину(IV) с использованием бензилхлорформиата дает карбамат(V);
4) депротонирование третичным бутоксидом лития (сильное основание) и взаимодействие с хиральным реагентом (S)-3-хлорпропандиола-1,2;
5) Промежуточное соединение(VI) не выделяется, а спонтанно циклизуется с потерей бензилового спирта и образованием пятичленного оксазолидинонового кольца(VII);
6) Получение с 3-нитрофенилсульфонилхлоридом эфира сульфоната(VIII);
7) нуклеофильное замещение сульфонатного эфира(VIII) аммиаком, высвобождаемого из гидроксида аммония, с последующим ацетилированием и получением линезолида(X).
Исходные вещества и продукты реакций в схеме синтеза линезолида:
I. морфолин;
II. 3,4-дифторнитробензол;
III. 4-морфолин-3-фторнитробензол;
IV. 4-морфолин-3-фторанилин;
V. 4-морфолин-3-фторамид бензойной кислоты;
VI. бензил(2,3-дигидроксипропил)(4-морфолин-3-фторфенил)карбамат;
VII. 5-(гидроксиметил)-3-(4-морфолин-3-фторфенил)-1,3-оксазолидин-2-он;
VIII. [3-(4-морфолин-3-фторфенил)-1,3-оксазолидин-2-онил]-метил-3-нитробензсульфонат.
Рисунок5.1 - Промышленный энантиоселективный синтез линезолида 2008г. [15]
Сперва вызывает настороженность, что стереохимия меняется с S в (S)-3-хлорпропандиоле-1,2 на R в промежуточном соединении (VI), оксазолидиноне (VII) и сульфонатном эфире(VIII), а позже вновь на S в линезолиде без реакций на хиральном атоме углерода. Внимательное рассмотрение превращений демонстрирует, что это связано с изменением приоритета групп вокруг хирального углерода (в зависимости от присутствия Cl, O или N относительно центра хиральности) в то время, как абсолютная конфигурация хирального углерода не изменяется на протяжении всей последовательности реакций [6,12, 15]
Способ 2. Тем самым первоначальным синтезом является данный метод, запатентованный в США в 1998г. компанией Pharmacia & Upjohn (Pearlman et al., 1998). Такой путь получения чистого линезолида трудно реализовать на коммерческом уровне, притом дает крайне низкий выход [12, 17].
Различия синтеза прослеживаются от реагентов для образования ключевого промежуточного соединения в сравнении с раннее рассмотренным синтезом, первые три реакции являются общими:
4) взаимодействие карбамата(V) с (R)-глицидилбутиратом в присутствии н-бутиллития с замещением карбобензилоксигруппы на метанольный остаток(VII);
6) тозилирование его(X) и взаимодействие с азидом натрия(XI);
7) Восстановление азида(XI) в присутствии палладия на угле в этилацетатном растворителе с получением амина, который требует дополнительной обработки уксусным ангидридом в присутствии пиридина с получением линезолида.
Процесс очистки включает хроматографию и отделение необходимой фракции с последующим выпариванием и растиранием продукта для получения чистого линезолида.
Недостаток способа заключается в использовании н-бутиллития, который сложен в обращении в заводских масштабах из-за своей взрывоопасной природы. Кроме того, указанную реакцию проводят при температуре -78 °C, что практически трудно достичь при промышленном производстве. Промежуточное соединение требует очистки с помощью колоночной хроматографии ― это громоздкий метод для производства [17].
Ни один из вышеупомянутых предшествующих уровней техники не предлагает простой и экономичный способ получения конечного линезолида из его амина. Следовательно, появилась потребность в разработке эффективного метода, который является простым, экономичным и коммерчески масштабируемым для получения промежуточных продуктов, что и было решено энантиоселективным синтезом [15] и синтеза линезолида из его амина.
Рисунок 5.2 – Первоначальный синтез компании Pharmacia & Upjohn1998г. [17]
X. [3-(4-морфолин-3-фторфенил)-1,3-оксазолидин-2-онил]-метилметансульфонат;
XI. 5-азидометил-3-(4-морфолин-3-фторфенил)-1,3-оксазолидин-2-он.
Способ 3. Данную задачу также удалось разрешить индийским ученым с помощью R-эпихлоргидрина в 2013г.:
3) Взаимодействие R-эпихлоргидрина с производным анилина(IV) в метаноле;
4) Неочищенный аддукт обрабатывают карбонилдиимидазолом в дихлорметане, чтобы получить хлорметилоксазолидинон(XIII);
5) Конденсация с фталимидом калия в диметилформамиде с образованием фталимида оксазолидинона(XIV);
6) Обработка гидразингидратом, ангидридами и хлорангидридами с выходом линезолида и его производных.
XII. (R)-3-(4-морфолин-3-фторфенил)-1-хлорпропан-2-ол; 3-(4-морфолин-3-фторфенил)-5-хлорметилоксазолидин-2-он;
XIII. {[3-(4-морфолин-3-фторфенил)-2-оксазолидин-5-ил]метил}изоиндолин-1,3-дион;
XIV. 5-аминометил-3-(4-морфолин-3-фторфенил)оксазолидин-2-он.
Таким образом, был достигнут надежный синтез не только линезолида, но и его производных через хиральные материалы, исходя из 4-морфолин-3-фторанилина с дешевым и легко доступным (R)-эпихлоргидрином при достаточно высоких выходах (для линезолида=87%). Структуры всех промежуточных соединений подтверждены данными ИК, ЯМР и масс-спектрометрии [18].
Способ 4. В 2019 г. был разработан семиступенчатый непрерывный проточный синтез линезолида без предварительной очистки, общее время которого составляет 27 минут, что значительно меньше, чем заявленные ранее методы (> 60 часов). E-фактор процесса (отношение массы отходов к массе продукта) оказался равен 25, при средних показателях промышленных фармацевтических предприятий между 25-100. Примечательно, что химические превращения достигаются полностью непрерывным способом без изменения растворителя или перерывов для промежуточных работ и очистки. Это стало возможно благодаря продуманному планированию последовательности реакций таким образом, чтобы извлекать выгоду из свойств потока, а также путем выбора реагентов и растворителей, которые были бы совместимы и приводили к минимальному образованию побочных продуктов в совокупности с надлежащим контролем условий синтеза, таких как температура, стехиометрия и время реакций.
Синтез линезолида проводится в трех зонах, задачами которых являются:
1) Получение амида с помощью реакции Риттера между эпихлоргидрином и ацетонитрилом, используя в качестве кислоты Льюиса BF3·OEt2 и образуя ион нитриллия, взаимодействием с пропанолом-2 для получения имидата и восстановлением трет-бутоксидом лития в смеси 1:1 ТГФ:1,2-дихлорэтан;
2) Образование анилина(IV) с помощью нуклеофильного ароматического замещения и последующего гидрирования ― классический прием в синтезе оксазолидинонов, однако примечателен тем, что газообразный водород проходит через компактно упакованный слой палладия, а избыток водорода повторно вводится в систему при объединении продуктов зон 1 и 2 в зоне 3, обеспечивая реакцию без какого-либо дополнительного активирующего агента;
3) Окончательное получение линезолида с общим выходом 73%, что соответствует пропускной способности 816 мг/ч. Анализ ВЭЖХ подтверждает, что энантиообогащение продукта сохраняется на протяжении всей последовательности.
XVI. N-[3-(4-морфолин-3-фторфенил)амино-2-гидроксипропил]ацетамид.
Инновационный подход состоит в том, чтобы ввести эпоксид через региоселективную реакцию размыкания кольца с анилином. После образования спирта-предшественника(XVI) получен сам линезолид. Следует также отметить, что аминоспирт и анилин не могли быть выделены из сырых реакционных смесей из-за быстрого окисления. Используя технологию непрерывного потока и проектируя синтез таким образом, чтобы он был полностью непрерывным, вредное окисление было сведено к минимуму за счет быстрого потребления этих промежуточных продуктов [19].
Рисунок 5.2 – Индийский синтез с R-эпихлоргидрином 2013г. [18]
Рисунок 5.4 – Семиступенчатый непрерывный проточный синтез 2019г. [19]
КОНТРОЛЬ КАЧЕСТВА
При определении контроля качества линезолида были проанализированы ведущие и наиболее значимые фармакопеи мира: ГФ РБ, ГФ РФ, Европейская (8.0), Международная, Японская, Китайская, Французская, Британская, Немецкая фармакопеи [20-28]. Однако ЧФС на искомое вещество указана лишь в фармакопеи США [29].
v Определение
Содержание: не менее 98,0% и не более 102,0% в пересчете на сухое вещество.
v Идентификация
А. ИК-спектрометрия. Если появляется разницав ИК-спектрах анализируемого вещества и стандарта, то растворяют равные части испытуемого образца и эталонного стандарта в равных объемах метанола. Выпаривают растворы до постоянной массы и проводят испытание.
В. ВЭЖХ. Время удерживания основного пикараствора образца соответствует времени удерживания стандартного раствора, полученного в ходе анализа. (см. Количественное определение).
v Количественное определение
ВЭЖХ.
МЕТОДИКА
Буфер:1,4 г/л калия фосфат однозамещенный;
Раствор А: метанол, ацетонитрил и буфер (15:5:80);
Раствор В: метанол и буфер (50:50);
Растворитель: ацетонитрил и вода (35:65);
Стандартный раствор: 0,08 мг/мл USP Linezolid RS в растворителе;
Испытуемый образец раствора: 0,08 мг/мл Linezolid в растворителе.
Хроматографические условия:
o Детектор: УФ = 254 нм;
o Колонка: 4,6 мм х 7,5 см; 3-4м;
o Температура: Автосамплер = 15°; Колонка = 30°;
o Скорость потока: 1,5 мл/мин;
o Объем пробы: 10 мкл.
Процентное содержание линезолида:
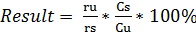 , где
, где
ru = пик раствора образца;
rs = пик стандартного раствора;
Cs = концентрация USP Linezolid RS в стандартном растворе (мг/мл);
Cu = концентрация Линезолида в анализируемом растворе (мг/мл).
Удовлетворительными являются результаты: 98,0%-102,0% в пересчете на безводный линезолид.
v Примеси
Сульфатная зола: не > 0,2%
Органические примеси: (таблица 1)
Таблица 6.1 - Показатели при определении органических примесей методом ВЭЖХ
| Название | Относительное время удерживания | Показатели в %, (не менее чем) |
| Линезолид N-оксид | 0.20 | 0.3 |
| Линезолид-амин | 0.31 | 0.2 |
| Дефторир. Линезолид | 0.63 | 0.3 |
| Линезолид | 1.0 | - |
| Неспецифические примеси | - | 0.1 |
Энантиомерная чистота: R-изомер не > 0,3%, методом ВЭЖХ.
v Специальные тесты
Потеря в массе при высушивании: не > 0,5%.
v Дополнительные требования
Упаковка и хранение: хранить в герметичных контейнерах при комнатной температуре.
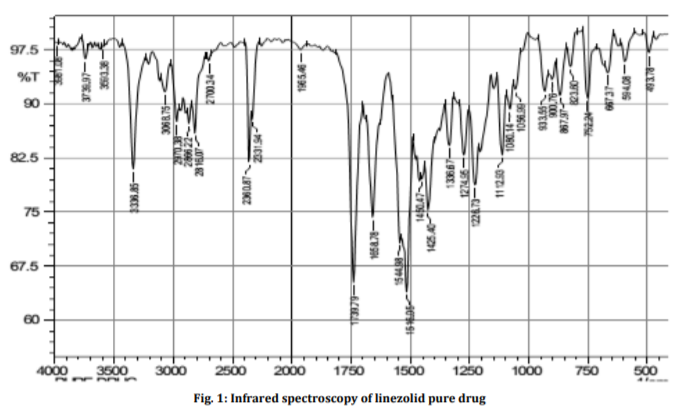
При проведении идентификации линезолида получают ИК-спектр, регистрируемый спектрофотометром в области от 4000 до 400 см-1, соответствующий следующему:
Рисунок 6.1 – ИК-спектр чистого линезолида[30]
По ФС, утвержденной Российским Министерством Здравоохранения, к уже указанным разделам ЧФС США добавлены следующие [31]:
o Описание. Белый или почти белый кристаллический порошок с характерным запахом.
o Растворимость. Умеренно растворим в метаноле и ацетоне, мало растворим в воде и спирте 96 %.
o Прозрачность раствора. Раствор 0,1 г субстанции в 50 мл воды должен быть прозрачным.
o Цветность раствора. Раствор, полученный в испытании «Прозрачность раствора», должен выдерживать сравнение с эталоном В5.
o Тяжелые металлы. Не более 0,002 %.
o Бактериальные эндотоксины. Не более 0,3 ЕЭ на 1 мг субстанции.
o Остаточные органические растворители; Микробиологическая чистота. В соответствии с общей фармакопейной статьей.
o Хранение. В защищённом от света месте при температуре от 2 до 8 °С.
К сожалению, линезолид редко встречается в мировых фармакопеях, хоть и не требует многочисленных испытаний и дорогостоящих реактивов и является первым представителем перспективного класса соединений при нозокомиальных инфекциях.
ЗАКЛЮЧЕНИЕ
На основании проделанной работы по изучению линезолида можно сделать следующие выводы:
ü Линезолид, будучи разработанным как ингибитор МАО В в 1970-х годах в США,является представителем противомикробных средств для лечения госпитальных и внебольничных пневмоний, инфекций кожи и мягких тканей;
ü На сегодняшний день включен в Список основных ЛС ВОЗ и признан критически важным для медицины, несмотря на цену единицы ЛС, однако при оценке стоимости курса лечения может конкурировать со средствами аналогичного действия;
ü Обладает довольно простым химическим строением, поскольку полностью синтетический;
ü Фармакологическую активность преимущественно обеспечивают N-ациламинометильная группа, S-конфигурация оксазолидинона и N-арильный радикал, прочие заместители потенцируют эффект и обуславливают фармакокинетику;
ü Линезолид отличается от известных ингибиторов синтеза белка сайтом связывания и влиянием на стадию инициации, а не элонгации, что исключает перекрестную резистентность;
ü Способы получения данного ЛС объединены общими начальными стадиями и энантиомерно чистыми исходными веществами;
ü Беспрерывно ведутся разработки наиболее экономически выгодного синтеза, поскольку основную стоимость линезолида определяют затраты при производстве;
ü Частная фармакопейная статья на линезолид редко встречается в наиболее авторитетных фармакопеях, содержится в фармакопеи США и описывает высокотехнологичные и немногочисленные методы контроля качества и количества как ИК и ВЭЖХ;
ü Линезолид так же не указан и в ГФ РБ ― рекомендовано включить его в следующую редакцию ГФ РБ, учитывая во внимание высокую мировую оценку и исключительное значение для медицины человечества.