Современные классификация и номенклатура ферментов разработаны Комиссией по ферментам Международного биохимического союза и утверждены на V Международном биохимическом конгрессе в 1961 г. в Москве.
В основу классификации легли 3 принципа: химическая природа фермента; химическая природа субстрата, на который действует фермент; тип катализируемой реакции.
Согласно современной классификации, ферменты делят на шесть классов.
1. Оксидоредуктазы – катализируют окислительно-восстановительные реакции:
Наиболее распространены следующие рабочие названия подкласов оксидоредуктаз:
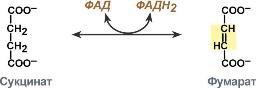 1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. Наиболее распространены дегидрогеназы, содержащие в качестве активной группы никотинамидадениндинуклеотид (НАД+), никотинамидадениндинуклеотидфосфат (НАДФ), флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД).
1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода. Наиболее распространены дегидрогеназы, содержащие в качестве активной группы никотинамидадениндинуклеотид (НАД+), никотинамидадениндинуклеотидфосфат (НАДФ), флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД).
 |
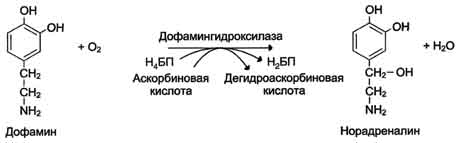 2. Оксидазы – оксидоредуктазы, катализирующие окисление, в результате которого в молекуле продукта появляется новый атом кислорода.
2. Оксидазы – оксидоредуктазы, катализирующие окисление, в результате которого в молекуле продукта появляется новый атом кислорода.
2. Трансферазы – ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов.
Фосфотрансферазы- перенос остатка фосфорной кислоты. Фосфорные эфиры органических соединений обладают повышенной химической активностью. Донором фосфатных остатков в большинстве случаев является АТФ.

 Аминотрансферазы ускоряют реакцию переноса аминогруппы от аминокислоты на a-кетокислоту (реакции трансаминирования).
Аминотрансферазы ускоряют реакцию переноса аминогруппы от аминокислоты на a-кетокислоту (реакции трансаминирования).
Протеинкиназы ускоряют перенос остатка фосфата с АТФ на белки,изменяя их биологическую активность. Реакция фосфорилирования широко используется для регуляции активности ферментов. Например, фосфорилированная молекула фермента может быть активна, а дефосфорилированная – нет.
Ацилтрансферазы катализируют перенос ацилов (остатков кислот).
3. Гидролазы – ускоряют реакции гидролиза (при участии воды). При этом продукты реакции имеют более простое строение, чем субстрат. Подклассы гидролаз: эстеразы, фосфатазы, гликозидазы, пептидазы.
Эстеразы катализируют гидролиз сложных эфиров спиртов с органическими и неорганическими кислотами. Например, липаза ускоряет гидролиз триацилглицеринов (жиров):
 |
Фосфатазы катализируют гидролиз фосфорных эфиров:
глюкозо-6-фосфат + Н2О ® глюкоза + Н3РО4
 Гликозидазы катализируют гидролиз гликозидов. Из гликозидаз, действующих на полисахариды (крахмал, гликоген), наиболее известны амилазы, сахарозу гидролизует сахараза, лактозу – лактаза,
Гликозидазы катализируют гидролиз гликозидов. Из гликозидаз, действующих на полисахариды (крахмал, гликоген), наиболее известны амилазы, сахарозу гидролизует сахараза, лактозу – лактаза,
мальтозу – мальтаза.
Пептидгидролазы (пептидазы) ускоряют гидролиз пептидных связей в белках и пептидах: пепсин, трипсин, химотрипсин, эластаза, карбоксипептидаза.
 4. Лиазы – ферменты, катализирующие разрыв связей С–О, С–С, С–N и других, а также обратимые реакции отщепления - присоединения различных групп от субстратов негидролитическим путем. Эти реакции сопровождаются образованием двойной связи и выделением таких простейших продуктов, как СО2, H2O, NH3 и т.д. Реакции декарбоксилирования катализируют декарбоксилазы; дезаминирования – дезаминазы.
4. Лиазы – ферменты, катализирующие разрыв связей С–О, С–С, С–N и других, а также обратимые реакции отщепления - присоединения различных групп от субстратов негидролитическим путем. Эти реакции сопровождаются образованием двойной связи и выделением таких простейших продуктов, как СО2, H2O, NH3 и т.д. Реакции декарбоксилирования катализируют декарбоксилазы; дезаминирования – дезаминазы.
 |
 5. Изомеразы - ферменты, катализирующие взаимопревращения структурных, оптических и геометрических изомеров.
5. Изомеразы - ферменты, катализирующие взаимопревращения структурных, оптических и геометрических изомеров.
6. Лигазы (синтетазы) - ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ либо других веществ.
Одной из важнейших карбоксилаз является пируваткарбоксилаза:
 |
Отличия ферментов от небиологических катализаторов заключаются в том, что скорость и селективность ферментативных реакций выше; ферменты обладают высокой специфичностью; скорость ферментативной реакции может регулироваться.
Активность ферментов в клетке непостоянна во времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри. Главная цель такой чувствительности ферментов – отреагировать на изменение окружающей среды, дать должный ответ на гормональные и иные стимулы.
В клетке имеется несколько способов регуляции активности ферментов – одни способы подходят для любых ферментов, другие более специфичны.
1. Ограниченный (частичный) протеолиз проферментов подразумевает, что синтез некоторых ферментов осуществляется в виде более крупного предшественника и при поступлении в нужное место этот фермент активируется через отщепление от него одного или нескольких пептидных фрагментов. Подобный механизм защищает внутриклеточные структуры от повреждений.
Примером служит активация протеолитических ферментов желудочно-кишечного тракта (трипсиноген, пепсиноген, прокарбоксипептидазы), факторов свертывающей системы крови и т.д. Секреция ряда ферментов за пределы клетки в неактивном состоянии позволяет предохранить клетки от повреждения (пищеварительные ферменты) или сохранить белок до наступления определенного момента (протромбин, фибриноген, белки комплемента).
Аллостерическая регуляция – присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы.
В качестве аллостерического ингибитора может выступать конечный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи: чем больше накапливается продукта, тем ниже активность фермента, который катализирует синтез этого продукта.
Белок-белковое взаимодействие – ситуация, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент. К примеру, панкреатическая липаза активируется белком колипазой.
4. Ковалентная (химическая) модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы.
Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, в мышцах ферменты гликогенфосфорилаза и гликогенсинтаза
– при нагрузке фосфорилируются, при этом гликогенфосфорилаза становится активной и начинает расщепление гликогена и сжигание глюкозы, а гликогенсинтаза при этом неактивна;
– во время отдыха при синтезе гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.
Оптимальная температура действия ферментов 37 °С, при повышении температуры скорость ферментативной реакции начинает снижаться из-за денатурации фермента. При понижении температуры активность ферментов снижается, но не исчезает совсем (например, у животных, впадающих в спячку).
Повышение температуры до определенных пределов оказывает влияние на скорость ферментативной реакции подобно тому, как влияет температура на любую химическую реакцию: с увеличением температуры повышается скорость ферментативной реакции. Однако скорость ферментативной химической реакции имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, что связано с термической денатурацией белковой молекулы (рис. 4). Для большинства ферментов человека оптимальной температурой является 37-38 °С.

Рисунок 4. Зависимость скорости ферментативной реакции (V) от температуры
Активность ферментов зависит от рН раствора, при котором протекает ферментативная реакция. Влияние рН на активность ферментов обусловлено изменением ионизации функциональных групп аминокислотных остатков данного белка и субстрата, обеспечивающих оптимальное образование фермент-субстратного комплекса. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность (рис. 5).

Рисунок 5. Зависимость скорости ферментативной реакции (V) от рН среды
Широкое применение в медицинской практике ферменты находят в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. Ферменты также используются в качестве специфических реактивов для определения ряда метаболитов. Например, фермент глюкозооксидазу применяют для количественного определения глюкозы в моче и крови; фермент уреазу используют для оценки содержания в биологических жидкостях мочевины; с помощью различных дегидрогеназ выявляют наличие соответствующих субстратов, например пирувата, лактата, этилового спирта и т.д.
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека.
Принципы энзимодиагностики основаны на следующих закономерностях:
- в норме в сыворотке крови содержатся ферменты, выполняющие специализированные функции, например, участвующие в свертывающей системе крови. Клеточные ферменты практически не проникают из неповрежденных клеток в кровь. В минимальных количествах некоторые ферменты клеток могут определяться в крови;
- при повреждениимембран клеток (воспаление, некроз) в крови или других биологических жидкостях (например, в моче) увеличивается количество внутриклеточных ферментов поврежденных клеток, активность которых можно зарегистрировать специальными биохимическими тестами;
- для энзимодиагностики используют ферменты, имеющие преимущественную или абсолютную локализацию в определенных органах (органоспецифичность);
- количество высвобождаемого фермента должно быть пропорционально степени повреждения ткани и достаточно для определения его активности;
- активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, отличается от нормальных значений и стабильна в течение достаточно длительного времени (сутки);
- появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например некрозе.
Ферменты, катализирующие одну и ту же химическую реакцию, но с разной первичной структурой белка, называют изоферментами. Они отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента. Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты или их субъединицы. На различиях в физико-химических свойствах и основаны методы определения изоферментов. Изоферменты часто являются органоспецифичными, так как в каждой ткани содержится преимущественно один тип изоферментов. Следовательно, при повреждении органа в крови появляется соответствующая форма изофермента. Обнаружение определенных изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Энзимодиагностика используется для установления диагноза при заболеваниях различных органов. Набор анализов зависит от возможностей конкретной биохимической лаборатории и постоянно совершенствуется. Наиболее распространены следующие энзимодиагностические тесты:
- при заболеваниях сердца (инфаркт миокарда) – лактадегидрогеназа, креатинкиназа, аспартатаминотрансфераза, аланинаминотрансфераза. Одним из первых при инфаркте миокарда в крови появляется белок тропонин;
- при заболеваниях печени – аланинаминотрансфераза, аспартатаминотрансфераза, ацетилхолинэстераза, гамма-глутамилтранспептидаза. При заболеваниях поджелудочной железы – панкреатическая амилаза, липаза;
- при заболеваниях простаты – кислая фосфатаза.
Применение ферментов в качестве лекарственных препаратовактивно развивают в следующих направлениях:
– заместительная терапия – использование ферментов в случае их недостаточности;
– элементы комплексной терапии – применение ферментов в сочетании с другой терапией.
Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при гастритах со сниженной секреторной функцией. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приемом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, мезимфорте и др.).
В качестве дополнительных терапевтических средств ферменты используются при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеаза и дезоксирибонуклеаза используются в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитах.
Ферментные препараты стали широко применяться при тромбозах и тромбоэмболиях для разрушения тромба. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания спаек и рубцов после ожогов и операций.
Фермент аспарагиназа (разрушает аминокислоту Асн в крови) используется при онкологических заболеваниях крови, ограничивая поступление аминокислоты Асн в опухолевые клетки. Лейкозные клетки не способны к самостоятельному синтезу этой аминокислоты, поэтому снижение ее содержания в крови нарушает рост этих клеток.
В основе многих заболеваний лежит нарушение функционирования ферментов в клетке – так называемые энзимопатии. Различают энзимопатии первичные (наследственные) и вторичные (приобретенные).
При первичных энзимопатиях дефектные ферменты наследуются в основном, по рецессивно-аутосомному типу. При этом нарушается метаболический путь, содержащий дефектный фермент. Развитие заболевания в этом случае может происходить по одному из «сценариев»:
– нарушается образование конечных продуктов, что вызывает недостаток определенных веществ (например, при альбинизме не вырабатывается пигмент в клетках кожи);
– накапливаются субстраты-предшественники, оказывающие токсическое действие на организм (например, при алкаптонурии накапливается промежуточный метаболит – гомогентезиновая кислота, которая откладывается в суставах, вызывая в них воспалительные процессы).