Поверхностные плёнки. Поверхностное давление. Уравнение состояния поверхностной плёнки. Электрические силы при адсорбции. Взаимодействие полярных и неполярных молекул с поверхностью твёрдого тела. Роль водородной связи. Адсорбция воды и газов на поверхности разных кристаллов, пористых тел и высокодисперсных систем.
Искривленная поверхность раздела
Вслучае плоской поверхности раздела фаз внутреннее давление в обеих сосуществующих фазах одинаково. Однако на практике нередко приходится иметь дело с искривленными поверхностями. Так, поверхность капли выпукла, а поверхность жидкости в смачиваемом капилляре вогнута. Очевидно, что на выпуклой поверхности молекула жидкости будет испытывать равнодействующую силу, направленную в глубь жидкости, меньшую, чем на плоской поверхности. На вогнутой поверхности эта сила, наоборот, будет большей, чем на плоской поверхности. Поэтому если на плоской поверхности давление в обеих сосуществующих фазах одинаково, то на искривленной поверхности возникает добавочное давление, направленное в сторону той фазы, по отношению к которой поверхность вогнута. Другими словами, при равновесии давление в фазе, отделенной от другой фазы вогнутой поверхностью, больше. Разность давлений, возникающая по обе стороны искривленной поверхности жидкости, носит название капиллярного или лапласова давления. Величина капиллярного давления зависит от кривизны поверхности и от поверхностного натяжения и определяется уравнением Лапласа.
Рассмотрим элементарный участок искривленной поверхности с площадью 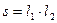 (рис. 28.1).
(рис. 28.1).

Рис. 28.1. Лапласово давление на искривленной поверхности
Если r1 и r2 - радиус кривизны криволинейных отрезков l1 и l2, то площадь s равна:
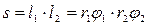 ,
,
где φ1 и φ2 - cоответствующие центральные углы. Если под действием силы, вызванной разностью давлений ∆р по обе стороны поверхности, сама поверхность сместилась на величину dr без изменения кривизны, то произошло увеличение этой поверхности на величину ds.

После несложных преобразований, пренебрегая членом (dr)2 как величиной бесконечно малой второго порядка, получим
 (28.1)
(28.1)
Затраченная на смещение работа dW может быть вычислена двумя способами - как произведение силы на путь  или как произведение поверхностного натяжения на прирост поверхности
или как произведение поверхностного натяжения на прирост поверхности  . Поэтому
. Поэтому
 .(28.2)
.(28.2)
Подставляя (28.1) в (28.2) и деля обе части уравнения на  , получим формулу Лапласа, выражающую избыток давления со стороны вогнутой поверхности
, получим формулу Лапласа, выражающую избыток давления со стороны вогнутой поверхности
 (28.3)
(28.3)
Если поверхность плоская, то r1 = r2 = ∞ и ∆ p = 0. Если поверхность сферическая, то r1 = r2 = r и лапласово давление равно:
 , (28.4)
, (28.4)
где знаки «+» и «-» отвечают положительной (выгнутой) и отрицательной (вогнутой) кривизне соответственно.
Вследствие существования лапласова давления величина давления насыщенного пара жидкости при данной температуре зависит от формы поверхности. Для установления этой зависимости обозначим через r радиус сферической поверхности раздела фаз (радиус капли); ps - давление насыщенного пара над плоской (r = ∞ ) и p - над выпуклой поверхностью. Перенесем некоторое количество жидкости dm с плоской поверхности в каплю радиуса r. Проделаем это путем обратимого изотермического испарения при давлении ps, обратимого сжатия пара от ps до р и последующей обратимой изотермической конденсации при p. Поскольку работа испарения и работа конденсации в этих условиях равны по величине и противоположны по знаку, то суммарная работа переноса dW оказывается работой сжатия пара:
 , (28.5)
, (28.5)
где М - молярная масса.
С другой стороны, при переносе dm вещества вследствие увеличения массы капли ее радиус увеличивается на dr и поверхность - на ds, что требует затрат энергии на работу против сил поверхностного натяжения (работу увеличения поверхности). Эти работы равны по абсолютной величине и противоположны по знаку:
 , (28.6)
, (28.6)
Cледует учесть, что масса капли равна m = 4/3 π r3 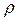 (где
(где 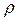 - плотность жидкости); тогда dm= 4nρr2dr. Поверхность капли s = 4πr2, поэтому ds = 8 π r dr. Кроме того, М /ρ = VМ - это молярный объем жидкости. С учетом этого уравнение (28.6) может быть преобразовано к виду:
- плотность жидкости); тогда dm= 4nρr2dr. Поверхность капли s = 4πr2, поэтому ds = 8 π r dr. Кроме того, М /ρ = VМ - это молярный объем жидкости. С учетом этого уравнение (28.6) может быть преобразовано к виду:
 , (28.7)
, (28.7)
Это уравнение называется уравнением Томсона (Кельвина), в котором знак «+» соответствует вогнутой поверхности (кривизна отрицательна), а знак «-» - выпуклой поверхности (кривизна положительна). Уравнение Томсона, как и уравнение Лапласа, является основным уравнением физической химии поверхностных явлений.
Анализ полученного уравнения приводит к ряду важных следствий:
1. Давление насыщенного пара жидкости ps над плоской поверхностью (поверхность с бесконечно большим радиусом кривизны, r =∞) меньше, чем давление пара p над каплей радиуса r (ps < pвыгн). Однако оно больше, чем давление пара над вогнутой поверхностью (ps > pвогн).
2. Чем меньше размер капли, тем больше равновесное давление ее насыщенного пара и, следовательно, тем выше значение химического потенциала жидкости, то есть тем менее устойчиво ее состояние. Если в системе одновременно присутствуют капли различных размеров, давление насыщенного пара над ними различно. Поэтому мелкие капли, обладая большим давлением пара, испаряются; испаряющееся вещество будет конденсироваться на поверхности более крупных частиц и на плоской поверхности. Такой процесс роста крупных капель за счет испарения мелких капель носит название изотермической перегонки или переконденсации.
3. Равновесие твердых частиц по отношению к жидкому раствору можно выразить уравнением, сходным с уравнением Томсона. Мерой растворимости является концентрация насыщенного раствора и в случае дисперсной системы твердая фаза - раствор может быть записано аналогичное уравнению Томсона уравнение:
 (28.8)
(28.8)
где со - концентрация насыщенного раствора (растворимость вещества); с - концентрация вещества в растворе, равновесном с кристалликами размером r.
Аналогия с каплей вызывается тем, что доля поверхностных молекул, несущих избыточную энергию, в мелкокристаллическом веществе также велика. Поэтому при растворении высокодисперсного вещества можно получить концентрацию раствора выше обычной растворимости. Термодинамическая неравновесность таких систем обуславливает перекристаллизацию вещества - рост крупных кристаллов в перенасыщенном растворе за счет растворения мелких. Уравнение (28.8) дает возможность, исследуя растворимость как функцию размеров частиц, рассчитывать значения межфазного натяжения на границе твердое тело - жидкость.
4. Повышение давления насыщенного пара над высокодисперсными частицами по сравнению с частицами крупных размеров обуславливает некоторое понижение их температуры плавления.
Особенности условий равновесия на искривленных поверхностях лежат в основе так называемых капиллярных явлений. Если поверхность раздела фаз подвижна (например, поверхность раздела фаз жидкость - газ или жидкость - жидкость), ее форма изменяется под влиянием поверхностного натяжения, стремясь к форме, отвечающей минимальной поверхности.При смачиваниижидкостью стенок капилляра в нем образуется вогнутыймениск, и уменьшение давления под ним компенсируется подъемом жидкости в капилляре (то есть наблюдается всасывание). При несмачиваниижидкостью стенок капилляра в нем образуется выпуклыймениск, давление под которым наоборот больше, чем в случае с плоской поверхностью. Следствием этого является опусканиежидкости в капилляре.
С капиллярными явлениями связана также необходимость достижения значительных пересыщений при образовании новой фазы. Вначале образуются зародышевые капли (или частицы) весьма малых размеров. Давление пара (или концентрация раствора), равновесное по отношению к таким высокодисперсным агрегатам, заметно выше давления насыщенного пара (или концентрации насыщенного раствора). Таким образом, для образования мелких зародышей необходимо накопление избыточной энергии, то есть создание пересыщенных состояний (пересыщенный пар при конденсации или пересыщенный раствор при кристаллизации), что сильно тормозит создание новой фазы.