Дифференциальное уравнение состояния
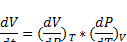
Коэффициенты термического расширения
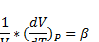
Коэффициенты изотермической сжимаемости
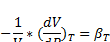
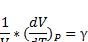
4. Критерий устойчивости равновесного состояния системы. Коэффициент сжимаемости. Уравнения состояния идеального газа (Клапейрона, Клапейрона-Менделеева).
Термодинамическое равновесие — состояние системы, при котором остаются неизменными во времени макроскопические величины этой системы (температура, давление, объём,
энтропия) в условиях изолированности от окружающей среды.
Критерии термодинамической устойчивости различных систем:
· Изолированная (абсолютно не взаимодействующая с окружающей средой) система — максимум энтропии.
· Замкнутая (обменивается с термостатом только теплом) система — минимум свободной энергии.
· Система с фиксированными температурой и давлением — минимум потенциала Гиббса.
· Система с фиксированными энтропией и объёмом — минимум внутренней энергии.
· Система с фиксированными энтропией и давлением — минимум энтальпии.
Термин «сжимаемость» также используется в термодинамике для описания отклонений термодинамических свойств реальных газов от свойств идеальных газов. Коэффициент сжимаемости (фактор сжимаемости [5]) определяется как
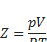
где p — давление газа, T — температура, {\displaystyle {\underline {V}}}V — молярный объём.
Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти неличины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для произвольной массы газа состояние газа описывается уравнением Менделеева—Клапейрона: 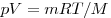
где 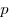 — давление,
— давление, 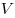 — объем,
— объем, 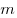 — массa,
— массa, 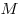 - молярная масса,
- молярная масса, 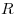 — универсальная газовая постоянная (
— универсальная газовая постоянная (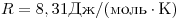 ).
).
5. Уравнение Ван-дер-Ваальса. Изотермы Ван-дер-Ваальса, ур-диаграмма, критическая точка. Характеристика реальной докритической изотермы. Пограничные кривые, разделяющие жидкую и газообразную фазы рабочего тела.
Уравне́ние Ван-дер-Ва́альса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Здесь m − масса газа, M − молярная масса (т.е. масса одного моля данного газа), R − универсальная газовая постоянная. (p+a/V2)(V−b)=RT.
Из рисунка, на котором изображены изотермы газа Ван-дер-Ваальса, видно, что ниже некоторой температуры зависимость {\displaystyle p(V)}p(V) перестаёт быть монотонной: образуется петля Ван-дер-Ваальса, в которой увеличению давления соответствует увеличение объёма, что противоречит законам термодинамики. Появление петли означает, что уравнение Ван-дер-Ваальса в данной области изменения p{\displaystyle p} и V{\displaystyle V} перестаёт описывать действительную ситуацию, когда имеет место фазовый переход газ — жидкость и реальная изотерма представляет собой отрезок прямой — конноду (ноду), соединяющую две фигуративные точки на бинодали.
Критическая температура фазового перехода — значение температуры в критической точке. При температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
6. Вывод формул для вычисления констант R, а, b через параметры в критической точке и приведение уравнения Ван-дер-Ваальса к безразмерному виду.
Числовые значения постоянных a,b,R ур. Вандервальса можно высчитать через параметры вещества
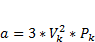
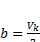
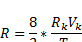
Pk, Vk, Tk – которые опред.экспереметально
Уравнение Ван-дер-Ваальса в безразмерном виде оно не содержит const поэтому данное уровнение может быть применено и любому веществу в том числе и мало изучено
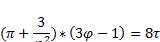
7. ϕ,π - диаграммы и их использование. Принцип Ван-дер-Ваальса (закон соответственных состояний) для термодинамически подобных газов.
Закон соответсветсвия состояний если два сравниваемых газа имеют два одинаковых приведеных параметра то у них будет одинаковый и третий параметр.
Газы для которых данный закон выполняется называются термоденамически подобными. Для токих газов по уровнению вандервальса в безразмерном виде 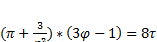 . Строим единую
. Строим единую  диаграмму и с ее помощью находим недостающие параметры малоизученых газов для которых опытным потем найдены параметры критической точки.
диаграмму и с ее помощью находим недостающие параметры малоизученых газов для которых опытным потем найдены параметры критической точки.
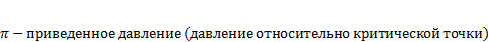
ϕ  приведенный удельный обьем (обьем относительно критической точки)
приведенный удельный обьем (обьем относительно критической точки)
8. Смеси идеальных газов. Объемные, молярные и массовые доли.
Газы образующие смесь называются компонентами.
Если компоненты не вступают не вступают в химическую реакцию и каждый компонент является идеальным газом то такую смесь можно рассматривать как некий новый идеальный газ со средней молярной массой μс и удельной газовой постоянной Rc и каждый компонент смеси ведет себя независимо от друг друга.
Температура всех компонентов одна и таже и равна температуре смеси. Каждый компонент которой занимает весь обьем в который заключена смесь и окзывает на стенки сосуда свое так наз порционное давление.
Обьемная доля (ri)- это отклонение порционного обьема i компонента к обьему смеси 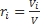
Молярная доля (ni)- это отклонение числа киломолей i компонента к числу киломолей смеси 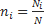
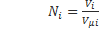
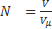
Массовой долей компонента смеси (gi) – это отношение массы i компонента к массе всей смеси. 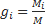
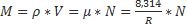
9. Парциальные давление и объем, законы Дальтона и Амаго. Формулы вычисления параметров и газовых постоянных смеси по заданным параметрам компонент.
Парциальнвм давлением некоторого i- го компонента газового раствора называется давление, которое имеет этот компонент, занимая весь объем раствора в отсутствии прочих компонентов при той же температуре. Практически его можно измерить, следующим образом, из сосуда удаляем газовый раствор данного состава. Затем сосуд заполняется при той же температуре заполняется тем же количеством молей 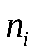 чистого компонента, с которым он входил в раствор.
чистого компонента, с которым он входил в раствор.
Парциальным объемом некоторого i=го компонента газового раствора называется объем в отсутствии других компонентов. Практически его измерить можно так. Цилиндр с поршнем заполнить чистым компонентом i в количестве равном числу молей, находящемся в растворе. Установить то же давление, которое было в растворе при той же температуре. Объем в цилиндре будет равен парциальному объему газа i- го компонента. Парциальное давление – это существенно новая величина Для парциального объема эо не так в силу определения 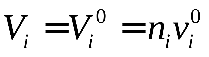
Закон Амага
Молекулы одного газа представлены вертикальными черточками, а другого — горизонтальными (рис. 1.2). На рис. 1.2, а молекулы рассеяны по всему объему. Если молекулы первого газа собраны в одной части объема, а молекулы другого газа — в другой, как это показано на рис. 1.2, б, то уменьшение объема газа при Т = onst вызывает пропорциональное увеличение давления (закон Бойля—Мариотта). Подбирая соответствуюш им образом доли от общего объема, можно добиться того, что каждый газ достигает давления смеси. Объемы, которые занимают эти газы, называют парциальными, приведенными к давлению смеси. Сумма парциальных объемов равна объему смеси (закон Амага) [c.23]
Джон Дальтон сформулировал этот закон в 1801 году, хотя молекулярно-кинетическая теория газов (модель, описывающая поведение газов), из которой он непосредственно вытекает, была разработана позже — уже в середине XIX века. Давление газа на стенки сосуда представляет собой результат столкновения молекул газа с этими стенками. Рассматривая газ с этих позиций, нетрудно понять, что количество столкновений со стенкой молекул каждого вида будет зависеть от того, как много молекул этого вида присутствует в газе. А из этого следует, что общее давление, представляющее собой сумму столкновений всех молекул, получается при сложении числа столкновений молекул каждого вида.
10. Теплоемкость идеальных газов и их смесей. Массовая, молярная и объемная теплоемкости. Изобарная и изохорная теплоемкости, уравнение Майера. Показатель адиабаты.
Теплоемкость тела называется количество теплоты которое необходимо ему передать (или наоборот отвести) что бы его температура увеличилась (уменьшилась) на 1 градус.
Теплоемкость идеальных газов зависит от характера подвода или отвода теплоты в отличие от реальных газов которая может зависть еще и от давления.
Теплоемкость является величиной экстенсивной, то есть она зависит от количества вещества.
Молярная удельная теплоемкость μc - отнесена к 1 кг вещества (Дж/кМоль*К)
Обьемная удельная теплоемкость (С’) – данная теплоемкость отнесётся к 1 кубичесому метру. (Дж/м3*К)
Удельная массовая теплоемкость (С) – это теплоемкость отнесенная к 1 кг вещества (Дж/кг*К)
Отношение изобарной теплоемкости к изохорной называют показателем адиабаты
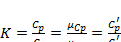
Массовая теплоемкость - это количество теплоты, которую необходимо подвести к единице массы вещества (обычно 1 кг), чтобы нагреть его на один градус.
Молярная теплоёмкость — отношение теплоёмкости к количеству вещества, теплоёмкость одного моля вещества
Объёмная теплоёмкость характеризует способность данного объёма данного конкретного вещества увеличивать свою внутреннюю энергию при изменении температуры вещества (подразумевая отсутствие фазового перехода).
Изобарная теплоемкость... Удельная теплоёмкость вещества — теплоёмкость единицы массы данного вещества. Единицы измерения — Дж/(кг К). Молярная теплоёмкость вещества — теплоёмкость 1 моля данного вещества.
Соотношение Майера (или уравнение Майера, или соотношение Роберта Майера) — это уравнение, связывающее теплоёмкость идеального газа при постоянном давлении с его теплоёмкостью при постоянном объёме.
Показатель адиабаты (иногда называемый коэффициентом Пуассона) — отношение теплоёмкости при постоянном давлении () к теплоёмкости при постоянном объёме (). Иногда его ещё называют фактором изоэнтропийного расширения. Обозначается греческой буквой (гамма) или (каппа).
11. Зависимость молярной теплоемкости от степеней свободы молекул и температуры.
12. Понятие термодинамического процесса. Квазистатические (равновесные) процессы. Обратимый и необратимый процессы.
Термодинамические процессы [править | править код]
При изменении внешних параметров или при передаче энергии в систему в ней могут возникать сложные процессы на макроскопическом и молекулярном уровне, в результате которых система переходит в другое состояние. Равновесная термодинамика не занимается описанием этих переходных процессов, а рассматривает состояние, устанавливающееся после релаксации неравновесностей. В термодинамике широко применяются идеализированные процессы, в которых система переходит из одного состояния термодинамического равновесия в другое, которые непрерывно следуют друг за другом. Такие процессы называются квазистатическими или квазиравновесными процессами[13]. Особую роль в методах термодинамики играют циклические процессы, в которых система возвращается в исходное состояние, совершая по ходу процесса работу и обмениваясь энергией с окружающей средой.
Квазистатический процесс в термодинамике — идеализированный процесс, состоящий из непрерывно следующих друг за другом квазистатических состояний, в которых характеризующие систему термодинамические величины за время наблюдения не изменяются. Если каждое такое квазистатическое состояние системы близко к состоянию равновесия и, следовательно, систему в каждый момент времени можно считать находящейся в термодинамическом равновесии, то такие процессы называют равновесными, или, точнее, квазиравновесными [1]. Количественный критерий квазистатичности/нестатичности процесса тот же, что и для обратимых процессов: этим критерием служит возникновение энтропии — эта величина равна нулю при отсутствии нестатических процессов в термодинамической системе и положительна при их наличии.
Обратимым термодинамическим процессом называется термодинамический процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Необходимым и достаточным условием обратимости термодинамического процесса является его равновесность.
Необратимым термодинамическим процессом называется термодинамический процесс, не допускающий возможности возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения
13. Уравнения обмена энергией в форме работы и теплоты. Энтропия как обобщенная координата для абсолютной температуры. Изотермный и изоэнтропный (адиабатный) процессы классической равновесной термодинамики.
Уравнения обмена энергией в форме работы
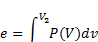
Уравнения обмена энергией в форме теплоты
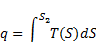
S-интропия (физическая величина)
14. Основные термодинамические функции. Функции линии (процесса) и функции состоянии. Количество теплоты, работа, внутренняя энергия, энтальпия и энтропия.
Термодинамические функции (термодинамические потенциалы) — характеристическая функция в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе.
Функции линии (процесса) - это величины, зависящие от пути процесса.
Функции состояния является –величины обладающие полным дифференциалом и их изменение зависит только от начального или конечного состояния системы и совершенно не зависит от пути перехода от первого ко ковторому (внутренняя энергия(U), энтальпия (H), энтропия (S))
Количество теплоты — энергия, которую получает или теряет тело при теплопередаче.
Вну́тренняя эне́ргия —часть полной энергии термодинамической системы, которая не зависит от выбора системы отсчета[1] и которая в рамках рассматриваемой проблемы может изменяться[2].
Энтальпия — это тепловая функция соответ след выражению H=U+P*V
энтропия (S) – это тепловая функция состояния котороя возникла в ходе теоритического поиска как наиболее благоприятных условий привращения теплоты в работу в теплоту двигателя.
15. Первое начало термодинамики. Располагаемая (полезная внешняя или техническая) работа. Понятие вечного двигателя первого рода. Основные формулировки первого закона термодинамики.
Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы ΔU: Изменение внутренней энергии системы равно количеству сообщенной системе теплоты минус количество работы, совершенной системой против внешних сил.