l 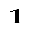 = –
= – 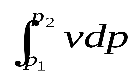 = v (p
= v (p  – p
– p  )
) 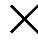 10
10 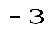 , кДж / кг, (7.5)
, кДж / кг, (7.5)
где p 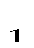 и p
и p 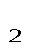 – давление в начале и в конце процесса, Па.
– давление в начале и в конце процесса, Па.
Тепло, участвующее в процессе и идущее на изменение внутренней энергии газа,
q = 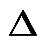 u = c
u = c 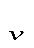 (T
(T 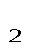 - T
- T 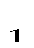 ), кДж / кг. (7.6)
), кДж / кг. (7.6)
Вечный двигатель первого рода Вечный двигатель, перпетуум-мобиле (латинское perpetuum mobile переводится вечное движение) — воображаемая машина, которая, будучи раз пущена в ход, совершала бы работу неограниченно долгое время, не заимствуя энергии извне.
Первый закон термодинамики гласит, (4 разные формулировки) что: Энергия не может быть создана или уничтожена (закон сохранения энергии), она лишь переходит из одного вида в другой в различных физических процессах. Отсюда следует, что внутренняя энергия изолированной системы остается неизменной.
16. Изменение удельных внутренней энергии, энтальпии и энтропии в идеальном газе. Вывод уравнения Майера.
соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
Cp - CV = R.
CP –теплоемкость при постоянном давления
CV –теплоемкость при постоянном объёме
Изобарная теплоемкость Cp> Cv так как при нагревание вещества при постоянном объёме теплота расходует только на увеличение энергии теплового движение молекул а при нагревание при постоянном давление происходит расширение газа тоесть теплота в этом случае расходуется на совершение работы расшерения
Изменения внутренней энергии, энтальпии и энтропии не зависят от процесса п поэтому для любого процесса, протекающего в идеальном газе, их можно вычислить по формулам
17. Второе начало термодинамики в формулировке Больцмана. Понятие вечного двигателя второго рода. Другие формулировки первого закона термодинамики.
Формулировка Больцмана: Энтропия — это показатель неупорядоченности системы. Чем выше энтропия, тем хаотичнее движение материальных частиц, составляющих систему. Давайте посмотрим, как она работает, на примере воды. В жидком состоянии вода представляет собой довольно неупорядоченную структуру, поскольку молекулы свободно перемещаются друг относительно друга, и пространственная ориентация у них может быть произвольной. Другое дело лед — в нем молекулы воды упорядочены, будучи включенными в кристаллическую решетку. Формулировка второго начала термодинамики Больцмана, условно говоря, гласит, что лед, растаяв и превратившись в воду (процесс, сопровождающийся снижением степени упорядоченности и повышением энтропии) сам по себе никогда из воды не возродится. Энтропия не может уменьшаться в замкнутых системах — то есть, в системах, не получающих внешней энергетической подпитки. Или, холодильник не работает, если он не включен в розетку! Или, частицы, оказавшись в беспорядочном хаотичном состоянии не возвращаются в порядок самопроизвольно.
Вечный двигатель второго рода — неограниченно долго действующая машина, которая, будучи пущена в ход, превращала бы в работу всё тепло, извлекаемое из окружающих тел.
Первый закон термодинамики гласит, (4 разные формулировки) что: Энергия не может быть создана или уничтожена (закон сохранения энергии), она лишь переходит из одного вида в другой в различных физических процессах. Отсюда следует, что внутренняя энергия изолированной системы остается неизменной.
18. Аналитическая формулировка второго закона термодинамики. Изменение энтропии при взаимодействии с окружающей средой и протекании внутри нее необратимых процессов (релаксация).
Таким образом, универсальная функция Кирхгофа есть не что иное, как испускательная способность абсолютно черного тела. Рассуждения Кирхгофа, приведшие его к формулировке своего закона, имеют очень общий характер и покоятся на втором законе термодинамики, в силу которого тепловое равновесие, установившееся в изолированной системе, нельзя нарушить обменом тепла между частями системы. [c.689]
Образование турбулентного движения можно обосновать еще исходя из общих законовфизики, в частности из второго закона термодинамики в формулировке С. Больцмана Во всякой изолированной системе происходят такие изменения, которые приводят систему в ее наиболее вероятное состояние. С этой точки зрения хаотичное движение отдельных частиц в потоке жидкости, свойственное турбулентному движению, является более вероятным, чем другие, более упорядоченные формы движения. Параллельноструйное ламинарное течение может возникнуть только в условиях, которые не дают возможности частицам жидкости двигаться беспорядочно (из-за большой вязкости жидкости при малых скоростях). [c.141]
19. Вывод формулы изменения энтропии в обратимом процессе 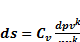
21. Политропный процесс. Вывод уравнения политропы. Показатель политропы. Изоэнтропный, изотермический, изобарный и изохорический процессы.
Политро́пный процесс, политропи́ческий процесс — термодинамический процесс, во время которого теплоёмкость газа остаётся неизменной. В соответствии с сущностью понятия теплоёмкости, предельными частными явлениями политропного процесса являются изотермический процесс () и адиабатный процесс ().
Показатель политропы Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа ». Для идеального газа уравнение политропы может быть записано в виде: Здесь — теплоёмкость газа в данном процессе, и — теплоёмкости того же газа, соответственно, при постоянном давлении и объёме.
Изоэнтропи́йный процесс — тепловой процесс, происходящий при постоянной энтропии (превращение).
Изотермический процесс (от др.-греч. ἴσος «равный» и θέρμη «жар») — термодинамический процесс, происходящий в физической системе при постоянной температуре.
Изобари́ческий или изоба́рный проце́сс (др.-греч. ἴσος «одинаковый» + βάρος «тяжесть») — термодинамический процесс, происходящий в системе при постоянных давлении и массе газа. Согласно закону Гей-Люссака, в идеальном газе при изобарном процессе отношение объёма к температуре постоянно:.
Изохорный процесс Изохорный, или изохорический процесс (от др.-греч. ἴσος — «равный» и χώρος — «место») — термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
22. Понятие о круговом процессе (цикле). Прямые и обратные циклы. Термический КПД и среднее давление цикла.
Круговой процесс (цикл) в термодинамике, процесс, при котором физическая система (например, пар), претерпев ряд изменений, возвращается в исходное состояние.
прямой термодинамический цикл теплосиловой установки, в котором часть тепла, сообщаемого рабочему телу, преобразуется в полезную работу.
В термодинамике холодильных установок и тепловых насосов рассматривают обратный цикл Карно, состоящий из следующих стадий[8][9]: адиабатического сжатия за счёт совершения работы (на рис. 1 — процесс В→Б); изотермического сжатия с передачей теплоты более нагретому тепловому резервуару (на рис. 1 — процесс Б→А); адиабатического расширения (на рис. 1 — процесс А→Г); изотермического расширения с отводом теплоты от более холодного теплового резервуара (на рис. 1 — процесс Г→В).
ТЕРМИЧЕСКИЙ КПД
безразмерная величина, применяемая в технич. термодинамике и теплотехнике для хар-ки степенисовершенства преобразования энергии в прямом круговом процессе - цикле теплового двигателя. Т. кпд n t цикла равен отношению работы А, совершаемой за цикл рабочим телом, к теплоте Q2, получ. при этомрабочим телом от нагревателей (теплоотдатчиков): n t = A/Q1. Согласно второму началу термодинамики, Т. кпд любого цикла n t < 1. Наибольший Т. кпд в заданном диапазоне темп-р рабочего тела имеет Карно цикл.
23. Холодильные установки и тепловые насосы. Термический КПД. холодильный и отопительный коэффициенты.
Холодильные машины и установки предназначены для искусственного снижения и поддержания пониженной температуры ниже температуры окружающей среды от 10 °С и до −153 °С в заданном охлаждаемом объекте. Машины и установки для создания более низких температур называются криогенными. Отвод и перенос тепла осуществляется за счет потребляемой при этом энергии. Холодильная установка выполняется по проекту в зависимости от проектного задания, определяющего охлаждаемый объект, необходимого интервала температур охлаждения, источников энергии и видов охлаждающей среды (жидкая или газообразная).
Тепловой насос — устройство для переноса тепловой энергии от источника низкопотенциальной тепловой энергии (с низкой температурой) к потребителю (теплоносителю) с более высокой температурой[1].
Термодинамический КПД - отношение полезной работы, вырабатываемой двигателем, к теплоте, подводимой от рассматриваемого топлива.
Для оценки работы холодильных машин применяется так называемый холодильный коэфф ициент, определяемый отношением полезной теплоты Q2, отнятой от холодного источника ограниченной емкости, к затраченной работе:
В холодильной машине теплота Q1 выбрасывается в окружающую среду – источник неограниченной емкости. Машины, основным продуктом производства которых является теплота Q1, передаваемая в источник ограниченной емкости, называются тепловыми насосами. Эффективность работы в этом случае оценивается отопительным коэффициентом, представляющим собой отношение теплоты Q1, переданной потребителю, к затраченной работе.
24. Цикл Карно, его vр- и sТ-диаграммы. Термический КПД для цикла Карно.
В термодинамике цикл Карно́ или процесс Карно — это идеальный[1] круговой процесс, состоящий из двух адиабатных и двух изотермических процессов[2]. В процессе Карно термодинамическая система выполняет механическую работу за счёт обмена теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником
Термический КПД цикла Карно является пределом возможности преобразования теплоты в работу с помощью теплового двигателя в заданных условиях. В определенном интервале температур T1 и T2 любой произвольный обратимый цикл имеет термический КПД ниже, чем кпд цикла Карно.
25. Термодинамические процессы с водяным паром. Температура насыщения. Насыщенный и перегретый пар. Процессы парообразования при испарении и кипении. Скрытая теплота парообразования.
Температуру, при которой жидкость переходит из жидкой фазы в газообразную или наоборот, называют температурой насыщения.
Перегре́тый пар — пар, нагретый до температуры, превышающей температуру кипения при данном давлении. Перегретый пар используется в циклах различных тепловых машин с целью повышения их КПД. Получение перегретого пара происходит в специальных устройствах — пароперегревателях.
Насы́щенный пар — это пар, находящийся в термодинамическом равновесии с жидкостью или твёрдым телом того же состава. Насыщенный водяной пар над водой (льдом) — водяной пар, находящийся в термодинамическом равновесии с плоской поверхностью жидкой воды или льда в чистом виде или в составе влажного газа.
П ар образуется двумя путями
1. Путем испрарения с поверхности воды (Пар распространяется в окружающе пространство в результате его диффузии в воздухе при этом новые порции жидкости испоряются по мере удаления от поверхности воды ранее образуя молекулы пара)
2. В результате парообразования во всем объёме жидкости в результате кипения воды (жидкость нагрета до температуры кипения будет испорятся не только с поверхности но и повсему объёму в толщине воды начнут образовывается пузырьки пара, которые врезультате начнут всплывать)
Количество теплоты которое необходимо передать одному кг нагретой до t кипения воды для ел превращения в сухой насыщенный пар называется - скрытой теплотой парообразования.
26. Производство водяного пара. Процесс парообразования на vр-диаграмме. Основные этапы парообразования.
Производство водяного пара в заданном параметром осуществляется в парогенераторах. Полученный перегретый пар оправляют к месту использования откуда возвращают к парогенераторам в виде конденсата. Эта вода подлежит первичной очистки, смешиванию с добытой водой и предварительному нагреву. Затем вновь исп. для производства пара.
Этапы парообразования
1. Подогрев питательной водой до температуры насыщения заданном давление.
2. Процесс парообразовании, то есть превращение кипящей жидкости в сухой насыщенный пар
3. Перегрев пара до требуемой температуры
На vр-диаграмме первый этап парообразования представлен участком а,b на этом участке при постоянном давление P0 и температура питательной воды возрастает от начального значения T0 (в точке a) до некоторой температуры Tсо которое при заданном давление P0 будет является температурой насыщения в точке b. Это точка является завершением первого этапа парообразования в точке b в граница кb (левая пунктираная линия). Она определяет жидкую фазу питательной воды (X=0 влажного пара область где X>0 но X<1). Граница конце (правая пунктирная линия) отделят область влажного насыщенного пара от области сухого насыщенного пара. Кb и Кс также являются линиями постоянным степенями сухости влажного пара. На участке а, b с ростом t питательной воды она расширяется и ее объём возрастает от V0 до Vж
27. Процесс парообразования на sТ-диаграмме. Степень сухости пара. Вывод формулы для энтропии перегретого пара.
Степень сухости — это параметр, показывающий массовую долю насыщенного пара в смеси воды и водяного пара. Значение соответствует воде в момент кипения (насыщения). Значение, показывает, что в смеси присутствует только пар
Если массу сухого насыщенного пара обозначить как mп, а массу взвешенной в нем жидкости mж, то степень сухости будет определяется величиной Х= 
Степень сухости принимается от 0 до 1 причем степень сухости Х=0 будет соответсвовать житкости, а Х=1 сухому пару.
Энтальпия перегретого пара при постоянном перегреве с увеличением давления уменьшается. Следовательно, при повышении давления вырабатываемого котлом пара целесообразно одновременно увеличить температуру перегретого пара. В связи с этим в котлах, вырабатывающих перегретый пар высокого давления, повышается роль пароперегревателя и водяного экономайзера. [1]
28. sh - диаграмма (диаграмма Молье) и ее применение при расчете процессов с водяным паром.
29. Основные процессы с водяным паром (изобарный, изотермный, изохорный, изоэнтропный).
Изохорный процесс при нагреванием при постоянном объеме влажный пар можно перевести в сухой насыщенный и перегретый. Охлаждением его можно сконденсировать, но не до конца, так как при каком угодно низком давлении над жидкостью всегда находится некоторое количество насыщенного пара. Это означает, что изохора не пересекает нижнюю пограничную кривую.
Изобарный процесс (рис. 4.10). При подводе теплоты к влажному насыщенному пару его степень сухости увеличивается и он (при постоянной температуре) переходит в сухой, а при дальнейшем подводе теплоты — в перегретый пар (температура пара при этом растет). При отводе теплоты влажный пар конденсируется при Ts = const.
Изотермический процесс (рис. 4.11). Внутренняя энергия водяного пара в процессе Т = const не остается постоянной (как у идеального газа), так как изменяется ее потенциальная составляющая. Величина 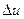 находится по формуле для изохорного процесса
находится по формуле для изохорного процесса
30. Принципиальная схема паросиловой установки. Определение температуры смеси добавочной воды и конденсата паровой турбины.
31. Определение КПД котлоагрегата. Расчет площади поверхности экономайзера.