Первый закон термодинамики является частным случаем закона сохранения и превращения энергии.
Первый закон термодинамики устанавливает эквивалентность при взаимных превращениях механической и тепловой энергии и математически может быть выражен следующим образом:
Q = L
где Q – количество тепла, превращенного в работу;
L – работа, полученная за счет тепла Q.
Количества тепла Q и работы L измерены в данном случае в соответствии с системой единиц СИ – в одних и тех же единицах – в джоулях.
Джоуль (Дж) - единица измерения механической работы (энергии) в системе единиц СИ представляет собой работу, совершаемую силой, равной 1Н, на пути в 1м, пройденном телом под действием этой силы по направлению, совпадающему с направлением силы.
Так как за единицу работы принят Дж, то единицей мощности будет являться Дж/с. Эта единица носит название ватт (Вт). В технике применяют более крупные единицы энергии и мощности: кДж, МДж, кВт, МВт, кВт·ч.
Широкое распространение в технике имеет внесистемная единица тепловой энергии – калории (кал).
1 кал = 4,1868 Дж
1 ккал = 4,1868 кДж
За единицу механической работы ранее принимали килограммометр (кгс·м, кГ·м), а за единицу мощности кгс·м/с, кГ·м/с.
1 ккал = 427 кГ·м
1 кГ·м = 1/427 ккал
1 кВт·ч = 367000 кГ·м = 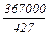 = 860 ккал
= 860 ккал
КПД тепловых установок
КПД может быть вычислен, если известны расход топлива на 1 кВт·ч и теплота сгорания топлива, т.е. то количество тепла, которое выделяется при полном сгорании массовой или объемной единицы топлива.
Если расход топлива на 1 кВт·ч (удельный расход топлива) b выражен в кг/(кВт·ч), а теплота сгорания топлива Q – в кДж/кг, то КПД теплосиловой установки определяется из выражения:
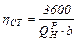 (5.1)
(5.1)
Аналитическое выражение первого закона термодинамики или основное уравнение тепла в дифференциальной форме для любого тела имеет следующий вид:
dQ = dU + dL (5.2)
где dQ – количество тепла, сообщенного извне рабочему телу массой М кг;
dU – изменение внутренней энергии рабочего тела;
dL – работа, совершенная рабочим телом по преодолению внешнего давления, «внешняя работа» работа расширения.
Каждый из трех членов этого уравнения может быть в зависимости от характера изменения состояния положительным, или отрицательным, или равным нулю.
Для бесконечно малого изменения состояния 1 кг любого газа уравнение (5.2) примет следующий вид:
dq = du + dl (5.3)
Так как:
dl = pdv
то:
dq = du + pdv
Для конечного изменения состояния уравнения (5.2) и (5.3) соответственно имеют вид:
Q = U + L (5.4)
и
q = u + l (5.5)
Величина работы расширения для 1 кг газа определяется из уравнения:
dl = pdv
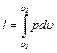 (5.6)
(5.6)
Изменение внутренней энергии идеального газа для любого процесса при бесконечно малом изменении состояния (для 1кг):
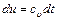 (5.7)
(5.7)
Интегрирую уравнение (5.7) в пределах от t1 до t2, получаем:
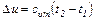 (5.8)
(5.8)
где 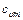 - средняя массовая теплоемкость при постоянном объеме в пределах от t1 до t2.
- средняя массовая теплоемкость при постоянном объеме в пределах от t1 до t2.
ЭНТАЛЬПИЯ ГАЗОВ
Заменяя в основном уравнении первого закона:
dq = du + pdu
величину pdv через d(pu) – udp, получаем:
dq = du + d(pu) – udp = d(u + pu) – udp
Выражение u + pu является параметром состояния. В технической термодинамике этот параметр называют энтальпией и обозначают h. Таким образом:
h = u + pu (5.9)
и, следовательно, основное уравнение первого закона, выраженное через энтальпию, имеет вид:
dq = dh – udp (5.10)
Для идеальных газов:
dh = cp dT
Следовательно:
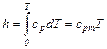 (5.11)
(5.11)
где сpm – средняя массовая теплоемкость при постоянном давлении в пределах от 0 до Т.
В теплотехнических расчетах обычно требуется знать изменение энтальпии, а не ее абсолютное значение, поэтому начало отсчета (0 К или 0°С) для конечного результата (Dh) не имеет значения.
Интегрируя уравнение (5.9) при p = const, получаем:
q = h2 – h1 (5.12)
Таким образом, количество тепла в процессе р=const численно можно определить как разность энтальпии конечного и начального состояния.
ЗАДАЧИ
5.4. (132) В сосуд, содержащий 5 л воды при температуре 20°С, помещен эл. нагреватель мощностью 800 Вт. Определить, сколько времени потребуется, чтобы вода нагревалась до температуры кипения 100°С. Потерями тепла сосуда в окружающую среду пренебречь.
ОТВЕТ: t = 30 мин.
5.3. (133) В калориметр, содержащий 0,6 кг воды при t =20°С, опускают стальной образец массой в 0,4 кг, нагретый до 200°С. Определить теплоемкость стали, если повышение температуры воды составило 12,5°С. Массой собственно калориметра пренебречь.
ОТВЕТ: с = 0,469 кДж/(кг·°С).
5.5. (134) Свинцовый шар падает с высоты h = 100 м на твердую поверхность. В результате падения кинетическая энергия шара полностью превращается в тепло. 1/3 образовавшегося тепла передается окружающей среде, а 2/3 расходуются на нагревание шара. Теплоемкость свинца с = 0,03 ккал/(кг·°С). Определить повышение температуры шара.
ОТВЕТ: Δt = 5,2°С
5.6. (135) Автомобиль массой 1,5 т останавливается под действием тормозов при скорости 40 км/ч. Определить конечную температуру тормозов t2, если их масса равна 15 кг, начальная температура t1 = 10°С, а теплоемкость стали, из которой изготовлены тормозные части, равна 0,46 кДж/(кг·°С). Потерями тепла в окружающую среду пренебречь.
ОТВЕТ: t2 = 23,4°С.
5.7. (136) Предполагая, что все потери гидротурбины превращаются в тепло и тратятся на нагрев воды, определить КПД турбины по следующим данным: высота падения воды равна 400 м, нагрев воды составляет 0,2°С.
ОТВЕТ: h = 78,6%.
5.8. (140) К газу, заключенному в цилиндре с подвижным поршнем, подводится извне 100 кДж тепла. Величина произведенной при этом работы составляет 115 кДж. Определить удельное изменение внутренней энергии газа, если количество его равно 0,8 кг.
ОТВЕТ: Δu= - 18,2 кДж/кг