Основными термодинамическими процессами являются:
1) процесс сообщения или отнятия теплоты при постоянном объеме газа (u = const) – изохорный процесс;
2) процесс сообщения или отнятия теплоты при постоянном давлении газа (p = const) – изобарный процесс;
3) процесс без сообщения или отнятия теплоты извне (dq = 0) – адиабатный процесс;
4) процесс, в котором изменение параметров подчиняется уравнению: pun = const, где n – величина, постоянная для данного процесса, – политропный процесс.
Изохорный процесс
В диаграмме pu этот процесс изображается прямой 1–2, параллельной оси ординат. Уравнение прямой 1–2 (рис.6.1), называется изохорой:
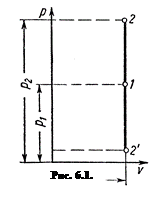 u = const
u = const
Зависимость между начальными и конечными параметрами процесса:
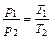 (6.1)
(6.1)
Изменение внутренней энергии:
Duu=qu= cum(t2 – t1) (6.2)
Если в процессе участвует М кг или Vн м3 газа, то количество теплоты или изменение внутренней энергии газа подсчитывается по формуле:
Qu =DUu=Mcum(t2 – t1) = Vнc¢(t2 – t1) (6.3)
где Vн – количество газа в м3 при нормальных условиях.
Если количество тепла необходимо подсчитать, пользуясь нелинейной зависимостью теплоемкости от температуры, то следует пользоваться формулой (4.6) и (4.7).
В изохорном процессе газ работы не совершает (L = const).
ЗАДАЧИ
6.3. (156) В закрытом сосуде емкостью V=0,6 м3 содержится воздух при давлении p1=0,5 МПа и температуре t1=20°С. В результате охлаждения сосуда воздух, содержащийся в нем, теряет 105 кДж. Принимая теплоемкость воздуха постоянной, определить, какое давление и какая температура устанавливаются после этого в сосуде.
РЕШЕНИЕ
Пользуясь уравнением состояния, определяем массу воздуха в сосуде:
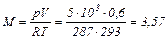 кг
кг
Количество тепла, отводимого от воздуха в процессе, определяется уравнением (6.3):
Q = Mcum(t2 – t1)
Откуда:
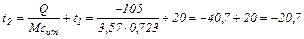 °C
°C
Значение cum = 0,723 получено из выражения 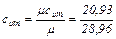 (для двухатомных газов).
(для двухатомных газов).
Из соотношения параметров в изохорном процессе имеем:
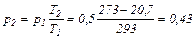 МПа
МПа
6.6. (159) До какой температуры нужно охладить 0,8 м3 воздуха с начальным давлением 0,3 МПа и температурой 15°С, чтобы давление при постоянном объеме понизилось до 0,1 МПа? Какое количество тепла нужно для этого отвести? Теплоемкость воздуха принять постоянной.
ОТВЕТ: До t2 = –177 °C; Q = –402 кДж.
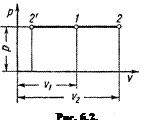
Изобарный процесс
В диаграмме pu этот процесс изображается прямой 1–2, параллельной оси абсцисс. Уравнение прямой 1–2 (рис. 6.2.), называемой изобарой:
р = const
Зависимость между начальными и конечными параметами процесса:
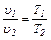 (6.4)
(6.4)
Работа 1 кг газа:
l = p(u2 – u1) (6.5)
или:
l = R(T2 – T1) (6.6)
Для М кг газа:
L = Mp(u2 – u1) = p(V2 – V1) (6.7)
или:
L = MR(t2 – t1) (6.8)
Если в процессе р =const участвует М кг или Vн м3 газа, то количество тепла подсчитывается по формуле:
Qр = Mcpm(t2 – t1) = Vнc¢pm(t2 – t1) (6.9)
где Vн – количество газа в м3 при нормальных условиях.
Если количество тепла необходимо подсчитать, пользуясь нелинейной зависимостью теплоемкости от температуры, то следует пользоваться формулой (4.7) или (4.9).
Изменение внутренней энергии газа определяется по формуле (6.2) или по формуле (4.6).
ЗАДАЧИ
6.7. Какое количество тепла необходимо затратить, чтобы нагреть 2 м3 воздуха при постоянном избыточном давлении р=0,2 МПа от t1=100 °C до t2=500 °С? Какую работу при этом совершит воздух? Давление атмосферы принять равным 760 мм рт. ст.
РЕШЕНИЕ
Из уравнения (4.7) имеем:
qp = cpm2t2 – cpm1t1
Пользуясь табл. VII, находим:
сpm1 = 1,0061 кДж/(кг ·°С); сpm2 = 1,0387 кДж/(кг ·°С)
Следовательно:
qp = 1,0387·500 – 1,0061·100=418,7 кДж/кг
Массу воздуха определяем из характеристического уравнения:
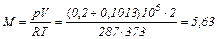 кг
кг
Таким образом:
Qp = Mqp = 5,63·418,7 = 2357 кДж
Найденное количество тепла можно определить не только по массе воздуха, но и по его объему. В этом случае уравнение (4.7) следует написать так:
qp = c¢pm2t2 – c¢pm1t1
Пользуясь табл. VII, получаем:
c¢pm1 = (c¢pm) 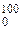 = 1,3004 кДж/(м3 ·°С)
= 1,3004 кДж/(м3 ·°С)
c¢pm2 = (c¢pm) 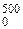 = 1,3427 кДж/(м3 ·°С)
= 1,3427 кДж/(м3 ·°С)
Следовательно:
qp = 1,3427·500 – 1,3004·100 = 541,4 кДж/м3
Объем воздуха должен быть приведен к нормальным условиям. Согласно уравнению (2.15):
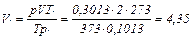 м3
м3
Таким образом:
Qp = qpVн = 541,4·4,35 = 2356 кДж
Работа газа по уравнению (6.8):
L = MR(t2 – t1) = 5,63·287·400 = 646,3 кДж
6.8. (165) Определить количество тепла, необходимое для нагревания 2000 м3 воздуха при постоянном давлении p =0,5 МПа от t1 =150 °C до t2 =600°C. Зависимость теплоемкости от температуры считать нелинейной.
ОТВЕТ: Qp = 3937 МДж = 940943 ккал.
6.9. (166) В установке наружного отопления внешний воздух при температуре t= - 15°C нагревается в калорифере при p= const до 60°C. Какое количество тепла надо затратить для нагрева 1000 м3 наружного воздуха? Теплоемкость воздуха считать постоянной. Давление воздуха принять равным 760 мм рт ст.
ОТВЕТ: 103033 кДж.
Изотермический процесс
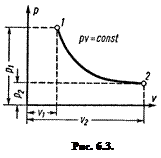 Кривая изотермического процесса, называемая изотермой, в диаграмме pu изображается равнобокой гиперболой (рис. 6.3). Уравнение изотермы в координатах pu:
Кривая изотермического процесса, называемая изотермой, в диаграмме pu изображается равнобокой гиперболой (рис. 6.3). Уравнение изотермы в координатах pu:
pu = const
Зависимость между начальными и конечными параметрами определяется по формулам:
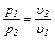 (6.10)
(6.10)
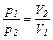 (6.11)
(6.11)
Работа 1 кг идеального газа определяется из уравнений:
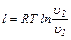 (6.12)
(6.12)
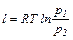 (6.13)
(6.13)
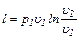 (6.14)
(6.14)
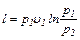 6.15)
6.15)
Если в процессе участвуют М кг газа, то полученные из формул (6.12) –(6.14) значения нужно увеличить в М раз. Можно также для этого случая в формулах (6.14) и (6.15) заменить удельный объем u полным объемом V. Получим:
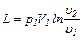 (6.16)
(6.16)
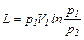 (6.17)
(6.17)
Так как в изотермическом процессе t =const, то для идеального газа:
Du = cum(t2 – t1) = 0
Количество тепла, сообщаемого газу или отнимаемого от него, равно:
qt = l (6.18)
или для М кг газа:
Qt = L (6.19)
Натуральный логарифм, входящий в формулы, может быть заменен десятичным по соотношению:
lnN = 2,303 lgN
ЗАДАЧИ
6.14. (180) Воздух в количестве 0,5 кг при p1 = 0,5 МПа и t1 = 30°С расширяется изотермически до пятикратного объема. Определить работу, совершаемую газом, конечное давление и количество тепла, сообщаемого газу.
ОТВЕТ: p2 = 0,1 МПа; L = Q = 70 кДж.
6.15. (181) Для осуществления изотермического сжатия 0,8 кг воздуха при p1 = 0,1 МПа и t = 25°С затрачена работа в 100 кДж. Как велико давление p2 сжатого воздуха и сколько тепла необходимо при этом отвести от газа?
ОТВЕТ: p2 =322 кПа; Q = –90 кДж.
Адиабатный процесс
Уравнение адиабаты в системе координат pu (рис. 6.4) при постоянной теплоемкости (сu = const) для идеального газа:
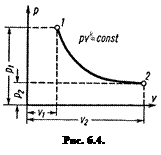 puk =const
puk =const
где k = 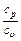 – показатель адиабаты.
– показатель адиабаты.
Зависимости между начальными и конечными параметрами процесса:
между p и u: 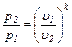 (6.20)
(6.20)
между Т и u: 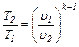 (6.21)
(6.21)
между Р и Т: 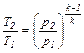 (6.22)
(6.22)
Работа 1 кг газа определяется по следующим формулам:
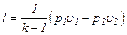 (6.23)
(6.23)
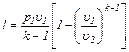 (6.24)
(6.24)
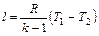 (6.25)
(6.25)
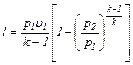 (6.26)
(6.26)
Для определения работы М кг газа нужно в формулах (6.23), (6.24) и (6.26) заменить удельный объем u общим объемом V газа. Тогда получим:
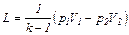 (6.27)
(6.27)
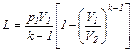 (6.28)
(6.28)
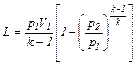 (6.29)
(6.29)
Формула (6.25) для М кг газа примет следующий вид:
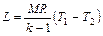 (6.30)
(6.30)
Уравнение первого закона для адиабатного процесса имеет следующий вид:
0 = du + dl
следовательно:
du = –dl
или: Du = –l (6.31)
т.е. изменение внутренней энергии газа и работа адиабатного процесса равны по величине и противоположны по знаку.
Изменение внутренней энергии идеального газа в адиабатном процессе может быть также выражено уравнением:
Du = cum(t2 – t1) (6.32)
ЗАДАЧИ
6.20. (198) 1 кг воздуха, занимающий объем u1=0,0887 м3/кг при p1=1 МПа, расширяется до 10–кратного объема. Определить конечное давление и работу, совершенную воздухом, в изотермическом и адиабатном процессах.
ОТВЕТ: 1) Т = const; p2 = 0,1 Мпа; l = 204 кДж/кг;
2) dQ = 0; p2 = 40 кПа; l = 133,5 кДж/кг.
6.25. (213) Воздух при температуре 127°С изотермически сжимается так, что объем его становится равным 1/4 начального, а затем расширяется по адиабате до начального давления. Определить температуру воздуха в конце адиабатного расширения. Представить процесс расширения и сжатия воздуха в диаграмме pu.
ОТВЕТ: t2 = – 4°C.
6.27. 1 кг воздуха при температуре t1 = 17°С сжимается адиабатно до объема, составляющего 1/5 начального, а затем расширяется изотермически до первоначального объма. Определить работу, произведенную воздухом в результате обоих процесов.
ОТВЕТ: l = 67 кДж/кг
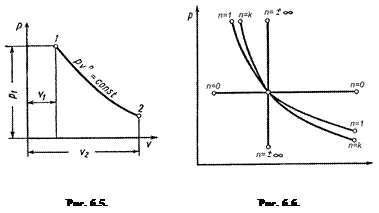
Политропный процесс
Уравнение политропы в системе координат pu (рис. 6.5) при постоянной теплоемкости:
pun = const
где n – показатель политропы.
Характеристикой политропного процесса является величина:
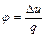 (6.33)
(6.33)
которая может быть определена из выражения:
 |
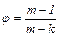 (6.34)
(6.34)
где m – показатель политропы, а 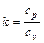
Пользуясь рис. 6.6, можно по величине показателя политропы определить ее относительное расположение в диаграмме pu, а также выяснить характер процесса, т.е. имеет ли место подвод или отвод тепла и увеличение или уменьшение внутренней энергии газа.