Физической культуры и спорта
Занятие: Практическое занятие №4
Тема: Роль окислительно-восстановительных процессов в жизнедеятельности организма
Практическое занятие №4.
РОЛЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ В ЖИЗНЕДЕЯТЕЛЬНОСТИ ОРГАНИЗМА
Цель: проанализировать и доказать биологическую роль окислительно-восстановительных процессов в жизнедеятельности организма.
Ход работы:
1.Изучите теоретическую часть. Запишите в 10 предложениях наиболее значимые для Вас аспекты темы.
2. Кому из ученых принадлежит высказывание:
«Жизнь - непрерывная цепь окислительно-восстановительных процессов»?
Чем знаменит автор высказывания? Докажите цитату на конкретных примерах.
3.Выполните письменно задание:
а) Приведите примеры действия бактерицидных веществ, основанного на окислительных свойствах.
б) Приведите примеры использования окислительно-восстановительных реакций для детоксикации.
в) Приведите примеры антиоксидантов.
4.Сформулируйте вывод.
Теоретическая часть
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ
Процессы обмена веществ, дыхания, гниения, брожения, фотосинтеза являются в своей основе окислительно-восстановительными процессами. В случае аэробного метаболизма основным окислителем является молекулярный кислород, а восстановителем - органические вещества продуктов питания. Показателем того, что в основе жизнедеятельности организма лежат окислительно-восстановительные реакции, являются биоэлектрические потенциалы органов и тканей. Биопотенциалы являются качественной и количественной характеристикой направления, глубины и интенсивности протекания биохимических процессов. Поэтому регистрация биопотенциалов органов и тканей широко применяется в клинической практике при изучении их деятельности, в частности при диагностике сердечно-сосудистых заболеваний снимают электрокардиограмму, при измерении биопотенциалов мышц снимают электромиограмму. Регистрация потенциалов мозга - энцефалография - позволяет судить о патологических нарушениях нервной системы. Источником энергии жизнедеятельности клеток служит мембранный потенциал, равный 80 мВ, обусловленный возникновением ионной асимметрии, т.е. неодинаковым распределением по обе стороны мембраны катионов и анионов. Мембранный потенциал имеет ионную природу. В многоядерных комплексах протекают процессы, связанные с переносом электронов и протонов между частицами, которые сопровождаются изменением степени окисления реагирующих частиц и возникновением окислительно-восстановительного потенциала. Окислительно-восстановительный потенциал имеет электронную природу. Эти процессы имеют обратимый циклический характер и лежат в основе многих важных физиологических процессов. Михаэлис отмечал важную роль окислительно-восстановительных процессов в жизни: «Окислительно-восстановительные процессы, происходящие в живых организмах, относятся к разряду тех, которые не только бросаются в глаза и могут быть опознаны, но и являются самыми важными для жизни и с биологической, и с философской точки зрения».
СУЩНОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ
В 1913 году Л.В. Писаржевский выступил с электронной теорией окислительно-восстановительных процессов, которая является в настоящее время общепринятой. Этот тип реакций осуществляется за счет перераспределения электронной плотности между атомами реагирующих веществ (переходом электронов), что проявляется в изменении степени окисления.
Реакции, в результате которых изменяются степени окисления атомов, входящих в состав реагирующих веществ вследствие переноса электрона между ними, называются окислительно-восстановительными реакциями.
Окислительно-восстановительный процесс состоит из 2 элементарных актов или полуреакций: окисления и восстановления.
Окисление - это процесс потери (отдачи) электронов атомом, молекулой или ионом. При окислении степень окисления частиц повышается:

Частица, отдающая электроны, называется восстановителем. Продукт окисления восстановителя называется его окисленной формой:

Восстановитель со своей окисленной формой составляют одну пару окислительно-восстановительной системы (Sn2+/Sn4+).
Мерой восстановительной способности того или иного элемента является потенциал ионизации. Чем меньше потенциал ионизации элемента, тем более сильным восстановителем он является, s-элементы и элементы в низшей и промежуточной степени окисления - сильные восстановители. Способность частицы отдавать электроны (донорная способность) определяет ее восстановительные свойства.
Восстановление - это процесс присоединения электронов частицей. При восстановлении степень окисления понижается:

Частица (атомы, молекулы или ионы), присоединяющая электроны, называется окислителем. Продукт восстановления окислителя называется его восстановленной формой:

Окислитель со своей восстановленной формой составляет другую пару (Fe3+/Fe2+) окислительно-восстановительной системы. Мерой окислительной способности частиц является сродство к электрону. Чем больше сродство к электрону, т.е. электроноакцепторная способность частицы, тем более сильным окислителем он является. Окисление всегда сопровождается восстановлением, и, наоборот, восстановление связано с окислением.
Рассмотрим взаимодействие FeCl3 с SnCl2. Процесс состоит из двух полуреакций:
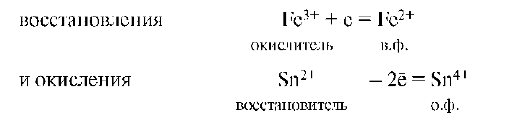
Окислительно-восстановительную реакцию можно представить в виде сочетания двух сопряженных пар.
В ходе реакций окислитель превращается в сопряженный восстановитель (продукт восстановления), а восстановитель в сопряженный окислитель (продукт окисления). Их рассматривают как окислительно-восстановительные пары:
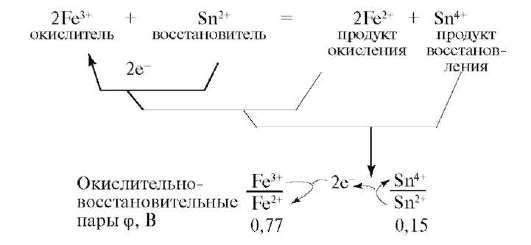
Поэтому окислительно-восстановительные реакции представляют единство двух противоположных процессов окисления и восстановления, которые в системах не могут существовать один без другого. В ЭТОМ МЫВИДИМ ПРОЯВЛЕНИЕ УНИВЕРСАЛЬНОГО ЗАКОНА ЕДИНСТВА И БОРЬБЫПРОТИВОПОЛОЖНОСТЕЙ. Реакция произойдет, если сродство к электрону окислителя больше, чем потенциал ионизации восстановителя. Для этого введено понятие электроотрицательности - величины, характеризующей способность атомов отдавать или принимать электроны.
Составление уравнений окислительно-восстановительных реакций проводится методом электронного баланса и методом полуреакций. Методу полуреакций необходимо отдать предпочтение. Применение его связано с применением ионов, реально существующих, видна роль среды. При составлении уравнений необходимо выяснить, какие из веществ, вступающих в реакцию, выполняют роль окислителя, а какие - восстановителя, влияние на ход реакции pH среды и каковы возможные продукты реакции. Окислительно-восстановительные свойства проявляют соединения, которые содержат атомы, имеющие большое число валентных электронов, обладающих различной энергией. Такими свойствами обладают соединения d-элементов (IB, VIIB, VIIIB групп) и р-элементов (VIIA, VIA, VA групп). Соединения, которые содержат элемент в высшей степени окисления, проявляют только окислительные свойства (КМnО4, H2SO4), в низшей - только восстановительные свойства (H2S), в промежуточной - могут вести себя двояко (Na2SO3). После составления уравнений полуреакций, ионного уравнения составляют уравнение реакции в молекулярной форме:

Проверка правильности составления уравнения: число атомов и зарядов левой части уравнения должно быть равно числу атомов и зарядов правой части уравнения для каждого элемента.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ В БИОЛОГИЧЕСКИХ СИСТЕМАХ
В процессе жизнедеятельности в клетках и тканях могут возникать разности электрических потенциалов. Электрохимические превращения в организме можно разделить на 2 основные группы.
1. Окислительно-восстановительные процессы вследствие переноса электронов от одних молекул к другим. Эти процессы имеют электронную природу.
2. Процессы, связанные с переносом ионов (без изменения их зарядов) и с образованием биопотенциалов. Биопотенциалы, регистрируемые в организме, - это в основном мембранные потенциалы. Они имеют ионную природу. В результате этих процессов возникают потенциалы между разными прослойками тканей, находящихся в разных физиологических состояниях. Они связаны с различной интенсивностью протекания физиологических окислительно-восстановительных процессов. Например, потенциалы, образующиеся в тканях поверхности листа на освещенной и неосвещенной стороне в результате различной интенсивности протекания процесса фотосинтеза. Освещенный участок оказывается положительно заряженным по отношению к неосвещенному.
В окислительно-восстановительных процессах, имеющих электронную природу, можно выделить три группы.
К первой группе можно отнести процессы, связанные с переносом электронов между веществами без участия кислорода и водорода. Эти процессы осуществляются с участием комплексов переноса электронов - гетеровалентных и гетероядерных комплексов. Перенос электронов происходит в комплексных соединениях одного и того же металла или атомов различных металлов, но в разной степени окисления. Действующим началом переноса электронов являются переходные металлы, которые проявляют несколько устойчивых степеней окисления, и для переноса электронов и протонов не требуются большие энергетические затраты, перенос может осуществляться на большие расстояния. Обратимость процессов позволяет многократно участвовать в циклических процессах. Данные колебательные процессы обнаружены в ферментативном катализе (цитохромы), синтезе белков, обменных процессах. Данная группа превращений участвует в поддержании антиокислительного гомеостаза и в защите организма от окислительного стресса. Они являются активными регуляторами свободно-радикальных процессов, системой утилизации активных форм кислорода, перекиси водорода, участвуют в окислении субстратов
типа каталазы, пероксидазы, дегидрогеназы. Эти системы осуществляют антиоксидантное, антиперекисное действие.
Ко второй группе можно отнести окислительно-восстановительные процессы, связанные с участием кислорода и водорода. Например, окисление альдегидной группы субстрата в кислотную:

В третью группу относят процессы, связанные с переносом протонов и электронов от субстрата, которые носят pH-зависимый характер, протекают в присутствии ферментов дегидрогеназ (E) и коферментов (Ко) с образованием активированного комплекса фермент-кофермент-субстрат (Е-Ко-S), присоединяя электроны и катионы водорода от субстрата, и вызывают его окисление. Таким коферментом является никотинамидадениндинуклеотид (НАД+), который присоединяет два электрона и один протон:

В биохимических процессах имеют место совмещенные химические равновесия: окислительно-восстановительные, протолитиче-ские и процессы комплексообразования. Процессы, как правило, имеют ферментативный характер. Виды ферментативного окисления: дегидрогеназное, оксидазное (цитохромы, свободнорадикальное окисление-восстановление). Протекающие в организме окислительно-восстановительные процессы условно можно разделить на следующие типы: 1) реакции внутримолекулярной дисмутации (диспропорцио-нирования) за счет атомов углерода субстрата; 2) реакции межмолекулярные. Наличие у атомов углерода широкого диапазона степеней окисления от -4 до +4 свидетельствует об его двойственности. Поэтому в органической химии распространены реакции окислительно-восстановительной дисмутации за счет атомов углерода, которые протекают внутри- и межмолекулярно.
МЕМБРАННЫЙ ПОТЕНЦИАЛ
Со времен Р. Вирхова известно, что живая клетка - это элементарная ячейка биологической организации, обеспечивающая все функции организма. Протекание многих физиологических процессов в организме связано с переносом ионов в клетках и тканях и сопровождается возникновением разности потенциалов. Большая роль в мембранном транспорте принадлежит пассивному транспорту веществ: осмосу,
фильтрации и биоэлектрогенезу. Эти явления определяются барьерными свойствами клеточных мембран. Разность потенциала между растворами разной концентрации, разделенными мембраной с избирательной проницаемостью, называют мембранным потенциалом. Мембранный потенциал имеет ионную, а не электронную природу. Он обусловлен возникновением ионной асимметрии, т.е. неодинаковым распределением ионов по обе стороны мембраны.
Катионный состав межклеточной среды близок к ионному составу морской воды: натрий, калий, кальций, магний. В процессе эволюции природа создала особый способ переноса ионов, получивший название пассивного транспорта, сопровождающегося возникновением разности потенциалов. Во многих случаях основой переноса веществ является диффузия, поэтому потенциал, который образуется на клеточной мембране, называют иногда диффузионным потенциалом. Он существует, пока концентрация ионов не выравнивается. Величина потенциала невелика (0,1 В). Облегченная диффузия осуществляется через ионные каналы. Ионная асимметрия используется для генерации возбуждения в нервных и мышечных клетках. Однако наличие ионной асимметрии по обе стороны мембраны важно и для тех клеток, которые не способны генерировать возбуждающий потенциал.
Изучение процессов биологического окисления начал в XVIII в. А. Лавуазье. Он обратил внимание на наличие определенной тождественности процессов горения органических веществ вне организма и дыханием животных. Оказалось, что при дыхании, как и при горении, поглощается кислород и образуются CO2 и H2O, однако процесс «горения» в организме идет очень медленно, к тому же, без пламени.
После работ А. Лавуазье в науке в течение длительного времени господствовало мнение о тождестве явлений горения и медленного окисления питательных веществ в организме. Однако оставалось неясным, почему это особое медленное «горения» в организме происходит при необычных условиях. при определенной низкой температуры (36-37 ° C), без возникновения пламени (как это имеет место при горении) и в присутствии воды, содержание которой достигает в тканях 75-80% от общей массы и которая в обычных условиях горению мешает. Это указывало на то, что медленное окисление органических веществ в организме по своему механизму резко отличается от обычного горения в воздухе органических веществ (дерева, угля и т.д.), хотя конечными продуктами в обоих случаях CO2 и вода.
Причину такого своеобразного течения окислительных процессов в живых организмах ученые сначала пытались объяснить «активацией» кислорода в клетках организма.
Одна из первых теорий биологического окисления, связанных с «активацией» кислорода, была развита русским ученым О.М.Бахом (1897), который считал, что молекула кислорода способна действовать как окислитель органических веществ только после своей активации результате разрыва одного из н "связей в его молекуле (-OO-). Активация происходит, в частности, если в среде присутствуют соединения, которые легко окисляются (например, имеющих двойные связи), при участии ферментов оксигеназ.
Соединения легко окисляются, например, ненасыщенные жирные кислоты, взаимодействуя с кислородом, образуют пероксиды. В этих реакциях окисление параллельно с восстановлением. Таким образом О.М. Бах впервые сформулировал идею о сопряженность окислительно-восстановительных процессов при дыхании. Теория А.Н. Баха получила название «перекисной теории» активации кислорода.
Однако истинный механизм активации кислорода во время окисления различных субстратов дыхания оказался другим.
Значительную роль в развитии теории биологического окисления сыграли работы другого российского ученого - В.И. Палладина (1907). Он развил представление о дыхании как систему ферментативных процессов и особое значение придавал окислению субстратов путем отщепления водорода (процесс дегидрирования).
Изучая окисление субстратов в растениях, В.И. Палладин установил, что оно может происходить без кислорода, если в среде имеются вещества, способные присоединять отщепленным при окислении водород. Такими веществами могут быть пигменты или хромогены и другие вещества, которые выполняют функцию промежуточных переносчиков водорода. Присоединяя водород от субстратов при этом окисляются, хромогены восстанавливаются и становятся бесцветными. Таким образом, В.И. Палладин придавал большое значение процесса окисления как процесса дегидрирования, а также указывал на важную роль кислорода как акцептора водорода в процессах биологического окисления.
Исследования В.И. Палладина были подтверждены работами Г. Виланда, который установил на примере окисления альдегидов, что процесс дегидрирования субстратов является основным процессом, который лежит в основе биологического окисления, и кислород взаимодействует уже с активированными атомами водорода. Таким образом, была создана концепция окисления веществ путем их дегидрирования, которая стала называться теорией Пал-Ладина-Виланда. Большую роль в подтверждении этой теории сыграло открытие и изучение целого ряда ферментов-дегидрогеназ, катализирующих отщепление атомов водорода от различных субстратов.
В дальнейшем были изучены: связь дыхания с другими процессами обмена веществ, в том числе и с процессом фосфорилирования; свойства ферментов, катализирующих реакции биологического окисления; локализация этих ферментов в клетке; механизм аккумуляции и преобразования энергии и т.п..
Значительный вклад в изучение биологического окисления сделали О. Варбург, Д. Кейлин, Г. Кребс, П. Митчелл, Д. Грин, А. Ленинджер, Б. Чанс, Э. Рекер, В.О. Энгельгардт, В.А. Белицер, С.Е. Северин, В.П. Скулачев и др..
Окислительно-восстановительные реакции играют исключительную роль в обмене веществ и энергии, происходящем в организме человека и животных. Реакция окисления неотделима от реакции восстановления, и оба эти процесса необходимо рассматривать в неразрывном единстве. При любой окислительно-восстановительной реакции алгебраическая сумма степеней окисления атомов остается неизменной. Многие окислительно-восстановительные реакции сводятся только к взаимодействию окислителя и восстановителя. Но чаще всего, если реакция осуществляется в водной среде, на ход окислительно-восстановительного процесса оказывает большое влияние взаимодействие реагентов с ионами водорода и гидроксила воды, а также присутствующих в растворе кислот и щелочей. Иногда влияние среды на ход окислительно-восстановительного процесса столь велико, что некоторые реакции могут осуществляться только в кислой или щелочной среде. От кислотно-щелочного баланса среды зависит направление окислительно-восстановительной реакции, количество электронов, присоединяемых молекулой (ионом) окислителя и отдаваемых молекулой (ионом) восстановителя и т. д. Например, реакция между иодидами и иодатами с выделением элементов иода протекает только в присутствии сильных кислот, а в сильно щелочной среде при нагревании может протекать обратная реакция.
Обмен веществ, в котором окислительно-восстановительные процессы играют столь значительную роль, имеет две стороны: 1) пластическую, сводящуюся к синтезу сложных органических веществ, необходимых организму в качестве «строительных материалов» для обновления тканей и клеток, из веществ, которые поступают главным образом с пищей (это анаболические процессы, или процессы ассимиляции, требующие затрат энергии) -- 2) энергетическую, сводящуюся к распаду (окислению) сложных высокомолекулярных веществ, играющих роль биологического топлива, до более простых -- в оды, диоксида углерода и т. д. (это катаболические процессы, или процессы диссимиляции, сопровождающиеся освобождением энергии).
Окислительно-восстановительные реакции являются необходимыми звеньями в сложной цепи как анаболических, так и катаболических процессов, но их роль особенно велика как основных источников энергии для живого организма. Организмы, существующие в аэробных условиях (т. е. в окислительной атмосфере кислорода воздуха), получают эту энергию за счет процесса дыхания, в результате которого поступающие в организм питательные вещества в клетках и тканях окисляются до диоксида углерода, воды, аммиака, мочевины и других продуктов жизнедеятельности, характеризующихся сравнительно небольшими значениями энергии и высокими значениями энтропии (от греч. -- поворот, превращение -- это мера беспорядка системы, состоящей из многих элементов).
В основе процессов дыхания лежит окислительно-восстановительная реакция, при которой молекула диатомного кислорода образует две молекулы воды. В процессе внешнего дыхания кислород воздуха связывается с гемоглобином и в форме оксигемоглобина доставляется с потоком крови к капиллярам тканей. В процессе тканевого, или клеточного дыхания, ткани и клетки поглощают этот кислород, за счет которого осуществляется окисление поступивших в организм из внешней среды белков, жиров и углеводов. одновременно образующийся диоксид углерода с потоком венозной крови направляется в легкие и там, диффундируя через стенки альвеол, оказывается в составе выдыхаемого воздуха. Но в этих процессах биологического окисления субстратами, непосредственно подвергающихся действию кислорода, являются не те высокомолекулярные соединения, которые первоначально находились в составе пищи, а образовавшиеся в результате гидролитического расщепления в желудочно-пищевом тракте более простые, низкомолекулярные продукты.
На первой стадии диссимиляции в результате гидролиза сложные углеводы -- крахмал, сахароза, гликоген и другие при участии амилаз превращаются в глюкозу и другие моносахариды. Жиры при участии липаз превращаются в жирные кислоты и глицерин. Белки под действием протеолитических ферментов превращаются в низкомолекулярные пептиды и аминокислоты. На этой стадии освобождается энергия, составляющая не более 1% от общей химической энергии пищевых веществ. Часть продуктов, возникших на первой стадии диссимиляции, организм человека использует в качестве исходных веществ для анаболических реакций, связанных с получением материалов для застройки тканей и клеток, а также как запас химического топлива.
Другая часть продуктов гидролиза подвергается окислению, при котором наряду с диоксидом углерода, водой, аммиаком, мочевиной и т. д. образуются также продукты неполного окисления.
На второй стадии диссимиляции освобождается около 1/3 общего количества энергии, но еще не происходит аккумулирование выделившейся энергии путем образования высокоэргических веществ.
На третьей стадии диссимиляции происходит полное окисление всех образовавшихся во второй стадии промежуточных продуктов: воды, диоксида углерода, аммиака, мочевины и т. д. и освобождаются остальные 2/3 химической энергии, полученные организмом из пищевых веществ. Это сложный химический процесс, включающий десять последовательно протекающих реакций, каждая из которых катализируется соответствующим ферментом, называется циклом трикарбоновых кислот или циклом Кребса. Ферменты, необходимые для осуществления этих последовательных реакций, локализуются в мембранных структурных элементах клеток -- митохондриях. окисление тиосульфат антидот вода
На третьей стадии диссимиляции освобождается 40?60% энергии, которая используется организмом для синтеза высокоэргических веществ.
Таким образом, рассмотренные стадии диссимиляции в организме питательных веществ показывает, что энергоснабжение организма на 99% обеспечивается протеканием в нем окислительно-восстановительных процессов.
Кроме того, с помощью окислительно-восстановительных реакций в организме разрушаются некоторые токсические вещества, образующиеся в ходе метаболизма. Именно таким путем организм избавляется от вредного влияния промежуточных продуктов биохимического окисления.
Сведения относительно окислительно-восстановительных свойств различных лекарственных препаратов позволяют решать вопросы о совместимости при одновременном их назначении больному, а также о допустимости их совместного хранения. С учетом этих данных становятся понятными несовместимость ряда лекарственных средств (например, таких как ио-дид калия и нитрит натрия, перманганат калия и тиосульфат натрия, пероксид водорода и ио-диды и т. д.).
Во многих случаях фармацевтические свойства медицинских препаратов находятся в непосредственной связи с их окислительно-восстановительными свойствами. Так, например, многие из антисептических, противомикробных и дезинфицирующих средств, (иод, перманганат калия, пероксид водорода, соли меди, серебра и ртути) являются в то же время и сильными окислителями.
Применение тиосульфата натрия в качестве универсального антидота (противоядия) основано на его способности участвовать в окислительно-восстановительных реакциях в роли как окислителя, так и восстановителя. В случае отравлений соединениями мышьяка, ртути и свинца, прием внутрь раствора тиосульфата натрия приводит к образованию труднорастворимых и потому практически неядовитых сульфатов. При отравлениях синильной кислотой или цианидами тиосульфат натрия дает возможность превратить эти токсичные вещества в менее ядовитые роданистые соединения. При отравлении галогенами и другими сильными окислителями антитоксическое действие триосульфата натрия обусловлено его умеренными восстановительными свойствами.
Говоря об окислительно-восстановительных процессах, нужно отметить, что во время окислительных или восстановительных реакций изменяется электрический потенциал окисляемого или восстанавливаемого вещества: одно вещество, отдавая свои электроны и заряжаясь положительно, окисляется, другое, приобретая электроны и заряжаясь отрицательно, -восстанавливается. Разность электрических потенциалов между ними есть окислительновосстановительный потенциал (ОВП).
Окислительно-восстановительный потенциал является мерой химической активности элементов или их соединений в обратимых химических процессах, связанных с изменением заряда ионов в растворах. Это означает, что ОВП, называемый также, редокс-потенциал (от английского RedOx -- Reduction/Oxidation), характеризует степень активности электронов в окислительно-восстановительных реакциях, т. е. в реакциях, связанных с присоединением или передачей электронов. При измерениях (в электрохимии) величина этой разности обозначается как Eh и выражается в милливольтах. Чем выше концентрация компонентов, способных к окислению, к концентрации компонентов, могущих восстанавливаться, тем выше показатель редокс-потенциала. Такие вещества, как кислород и хлор, стремятся к принятию электронов и имеют высокий электрический потенциал, следовательно, окислителем может быть не только кислород, но и другие вещества (в частности, хлор), а вещества типа водорода, наоборот, охотно отдают электроны и имеют низкий электрический потенциал. Наибольшей окислительной способностью обладает кислород, а восстановительной -- водород, но между ними располагаются и другие вещества, присутствующие в воде и менее интенсивно выполняющие роль либо окислителей, либо восстановителей.
Значение ОВП для каждой окислительно-восстановительной реакции может иметь как положительное, так и отрицательное значение.
Так, например, в природной воде значение Eh колеблется от -400 до +700 мВ, что определяется всей совокупностью происходящих в ней окислительных и восстановительных процессов. В условиях равновесия значение ОВП определенным образом характеризует водную среду, и его величина позволяет делать некоторые общие выводы о химическом составе воды.
В биохимии величины редокс-потенциала выражаются не в милливольтах, а в условных единицах rH (reduction Hydrogenii).
Шкала условных единиц rH содержит 42 деления.
«0» -- означает чистый водород,
«42» -- чистый кислород,
«28» -- нейтральная среда.
pH и rH тесно взаимосвязаны.
Окислительные процессы понижают показатель кислотно-щелочного равновесия (чем выше rH, тем ниже pH), восстановительные -- способствуют повышению pH. В свою очередь показатель pH влияет на величину rH.
В организме человека энергия, выделяемая в ходе окислительно-восстановительных реакций, расходуется на поддержание гомеостаза (относительное динамическое постоянство состава и свойств внутренней среды и устойчивость основных физиологических функций организма) и регенерацию клеток организма, т. е. на обеспечение процессов жизнедеятельности организма.
ОВП внутренней среды организма человека, измеренный на платиновом электроде относительно хлорсеребряного электрода сравнения, в норме всегда меньше нуля, т. е. имеет отрицательные значения, которые обычно находятся в пределах от -100 до -200 милливольт. ОВП питьевой воды, измеренный таким же способом практически всегда больше нуля, обычно находится в пределах от +100 до +400 мВ. Это справедливо практически для всех типов питьевой воды, той, которая течет из водопроводных кранов во всех городах мира, которая продается в стеклянных и пластиковых бутылках, которая получается после очистки в уста-
новках обратного осмоса и большинства разнообразных больших и малых водоочистительных систем.
Указанные различия ОВП внутренней среды организма человека и питьевой воды означают, что активность электронов во внутренней среде организма человека намного выше, чем активность электронов в питьевой воде.
Активность электронов является важнейшей характеристикой внутренней среды организма, поскольку напрямую связана с фундаментальными процессами жизнедеятельности.
Когда обычная питьевая вода проникает в ткани человеческого (или иного) организма, она отнимает электроны от клеток и тканей, которые состоят из воды на 80?90%. В результате этого биологические структуры организма (клеточные мембраны, органоиды клеток, нуклеиновые кислоты и другие) подвергаются окислительному разрушению. Так организм изнашивается, стареет, жизненно-важные органы теряют свою функцию. Но эти негативные процессы могут быть замедлены, если в организм с питьем и пищей поступает вода, обладающая свойствами внутренней среды организма, т. е. обладающая защитными и восстановительными свойствами.
Для того, чтобы организм оптимальным образом использовал в обменных процессах питьевую воду с положительным значением окислительно-восстановительного потенциала, ее ОВП должен соответствовать значению ОВП внутренней среды организма. Необходимое изменение ОВП воды в организме происходит за счет затраты электрической энергии клеточных мембран, т. е. энергии самого высокого уровня, энергии, которая фактически является конечным продуктом биохимической цепи трансформации питательных веществ.
Количество энергии, затрачиваемой организмом на достижение биосовместимости воды, пропорциональна ее количеству и разности ОВП воды и внутренней среды организма.
Если поступающая в организм питьевая вода имеет ОВП близкий к значению ОВП внутренней среды организма человека, то электрическая энергия клеточных мембран (жизненная энергия организма) не расходуется на коррекцию активности электронов воды и вода тотчас же усваивается, поскольку обладает биологической совместимостью по этому параметру. Если питьевая вода имеет ОВП более отрицательный, чем ОВП внутренней среды организма, то она подпитывает его этой энергией, которая используется клетками, как энергетический резерв антиокси-дантной защиты организма от неблагоприятного влияния внешней среды.
Процессы обмена веществ, дыхания, гниения, брожения, фотосинтеза являются окислительно-восстановительными процессами (ОВП). В живых организмах, вследствие наличия многочисленных мембран, направленного транспорта веществ и прохождения различных ОВП между его частями, возникает разность зарядов, называемая биопотенциалами. По своей природе биопотенциалы могут быть диффузными, мембранными и редокс-потенциалами. Мембранный потенциал имеет ионную природу, а редокс-потенциал – электронную природу. Биопотенциалы играют важнейшую роль в направленном транспорте веществ, работе мембранных систем, процессах биосинтеза, выделения и запасания энергии. Выделение и запасание организмом энергии тесно связано с процессами окисления и восстановления. Биопотенциалы являются качественной и количественной характеристикой направления, глубины и интенсивности протекания биохимических процессов. Поэтому регистрация биопотенциалов органов и тканей широко применяется в клинической практике при изучении их деятельности, в частности, при диагностике сердечно-сосудистых заболеваний снимают электрокардиограмму, при измерении биопотенциалов мышц снимают электромиограмму. Регистрация потенциалов мозга – энцефалография – позволяет судить о патологических нарушениях нервной системы. Источником энергии жизнедеятельности клеток служит мембранный потенциал, равный 80 мВ, обусловленный возникновением ионной асимметрии, т.е. неодинаковым распределением по обе стороны мембраны катионов и анионов.
Важными процессами в организмах являются реакции ферментативного окисления веществ-субстратов: углеводов, жиров, аминокислот. В результате этих процессов организмы получают большое количество энергии. Приблизительно 90 % всей потребности взрослого мужчины в энергии покрывается за счет энергии, вырабатываемой в тканях при окислении углеводов и жиров. Остальную часть энергии ~10 % дает окислительное расщепление аминокислот.
Все биохимические ОВП, скорость и глубина которых контролируется организмом, протекают под действием ферментов – оксидоредуктаз, которые делятся на кофакторы и коферменты и могут быть и окислителями и восстановителями [1]. Системы с более низким окислительно-восстановительным потенциалом отдают электроны, с высоким – их принимают. Электроны переносятся по дыхательной цепи ферментов постепенно с нарастанием редокс-потенциала. В качестве переносчиков электронов в дыхательную цепь митохондрий входят различные белки, содержащие разнообразные функциональные группы, которые предназначены для переноса электронов. По мере продвижения по цепи от одного интермедиата к другому электроны теряют свободную энергию. На каждую пару электронов, переданных по дыхательной цепи кислороду, синтезируется три молекулы АТФ. Свободная энергия, высвобождающаяся при переносе двух электронов на кислород, составляет 220 кДж/моль.
В течение жизни человек подвергается воздействию различных вредных внешних факторов – плохая экология, неправильное и зачастую некачественное питание, употребление некачественной питьевой воды, стрессовые ситуации, курение, злоупотребление алкоголем, употребление лекарственных препаратов, болезни и многое другое. Все эти факторы способствуют разрушению окислительно-восстановительной системы регуляции организма, в результате чего процессы окисления начинают преобладать над процессами восстановления, защитные силы организма и функции жизненно важных органов человека начинают ослабевать и уже не в состоянии самостоятель