Гемоглобин - аллостерический белок. Конформационные изменения молекулы гемоглобина. Кооперативный эффект. Регуляторы сродства гемоглобина к кислороду. Структурные и функциональные различия миоглобина и гемоглобина.
К гемопротеинам относятся: гемоглобин, миоглобин, цитохромы, пероксидаза, каталаза. Эти белки содержат в качестве простетической группой гем.
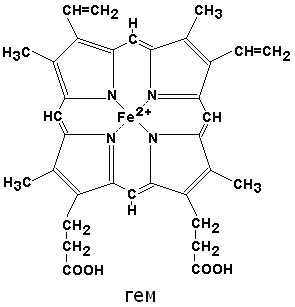
По своему химическому строению гем представляет собой протопорфирин IX, связанный с двухвалентным железом. Протопорфирин IX - органическое соединение, относящееся к классу порфиринов. Протопорфирин IX содержит четыре замещённых пиррольных кольца, соединённых метиновыми мостиками =СН—. Заместителями в пиррольных кольцах являются: четыре метильные группы СН3—, две винильные группы СН2=СН— и два остатка пропионовой кислоты — СН2—СН2—СООН. Гем соединяется с белковой частью следующим образом. Неполярные группы. протопорфирина IX взаимодействуют с гидрофобными участками аминокислот при помощи гидрофобных связей. Кроме того, имеется координационная связь между атомом железа и имидазольным радикалом гистидина в белковой цепи. Ещё одна координационная связь атома железа может использоваться для связывания кислорода и других лигандов.
Присутствие в биологическом материале гемсодержащих белков обнаруживается при помощи бензидиновой пробы (при добавлении бензидина и пероксида водорода исследуемый раствор окрашивается в сине-зелёный цвет).
равните структуру и функцию миоглобина и гемоглобина, запомните характерные особенности каждого из этих белков.
Миоглобин - хромопротеин, присутствующий в мышечной ткани и обладающий большим сродством к кислороду. Молекулярная масса этого белка около 16000 Да, Молекула миоглобина имеет третичную структуру и представляет собой одну полипептидную цепь, соединённую с гемом. Миоглобин не обладает аллостерическими свойствами (см. 2.4.), кривая насыщения его кислородом имеет вид гиперболы (рисунок 4). Функция миоглобина заключается в создании в мышцах кислородного резерва, который расходуется по мере необходимости, восполняя временную нехватку кислорода.
|
|
Гемоглобин (Hb) - хромопротеин, присутствующий в эритроцитах и участвующий в транспорте кислорода к тканям. Гемоглобин взрослых людей называется гемоглобином А (Hb A). Молекулярная масса его составляет около 65000 Да. Молекула Hb А имеет четвертичную структуру и включает четыре субъединицы - полипептидные цепи (обозначаемые α1, α2, β1 и β2, каждая из которых связана с гемом.
Запомните, что гемоглобин относится к аллостерическим белкам, его молекулы могут обратимо переходить из одной конформации в другую. При этом изменяется сродство белка к лигандам. Конформация, обладающая наименьшим сродством к лиганду, называется напряжённой, или Т-конформацией. Конформация, обладающая наибольшим сродством к лиганду, называется релаксированной, или R-конформацией.
Различные факторы среды могут сдвигать это равновесие в ту или иную сторону. Аллостерическими регуляторами, влияющими на сродство Hb к O2, являются: 1) кислород; 2) концентрация Н+ (рН среды); 3) углекислота (СO2); 4) 2,3-дифосфоглицерат (ДФГ). Присоединение молекулы кислорода к одной из субъединиц гемоглобина способствует переходу напряжённой конформации в релаксированную и повышает сродство к кислороду других субъединиц той же молекулы гемоглобина. Это явление получило название кооперативного эффекта. Сложный характер связывания гемоглобина с кислородом отражает кривая насыщения гемоглобина O2, имеющая S-образную форму (рисунок 3.1).
|
|
Повышение содержания СO2, Н+, ДФГ на фоне низкого парциального давления O2 в тканях способствует взаимодействию этих факторов с гемоглобином и переходу R-конформации в Т-конформацию. Это приводит к смещению равновесия в уравнении (1) вправо. Выделившийся O2 поступает в ткани.
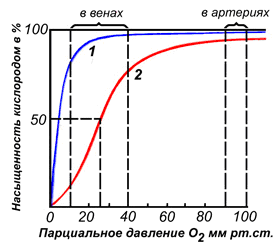
Рисунок 3.1. Кривые насыщения миоглобина (1) и гемоглобина (2) кислородом.
4. Биологические функции белков. Роль пространственной организации полипептидной цепи в образовании активных центров. Взаимодействие белков с лигандами. Денатурация белков.
Белки играют важнейшую роль в организме, выполняя многообразные биологические функции.Запомните наиболее важные из них и примеры соответствующих белков, изучив таблицу 2.2.
| Таблица 2.2 Функциональная классификация белков | |||||||||||||||||||||||||
2.2.2. Обратите внимание на то, что в основе функционирования любого белка лежит его способность к избирательному взаимодействию со строго определёнными молекулами или ионами (лигандами). Например, для ферментов, катализирующих химические реакции, лигандами будут вещества, участвующие в этих реакциях (субстраты), для транспортных белков - транспортируемые вещества и т.д. 2.2.3. Лиганд способен взаимодействовать не со всей поверхностью белковой молекулы, а только с определённым её участком, который представляет собой центр связывания или активный центр. Этот центр формируется пространственно сближенными радикалами аминокислот на уровне вторичной или третичной структуры белка. Способность лиганда взаимодействовать с центром связывания обусловлена их комплементарностью, то есть взаимным соответствием их пространственной структуры (подобно взаимодействию «ключ - замок»). Между функциональными группами лиганда и центра связывания образуются нековалентные (водородные, ионные, гидрофобные), а также ковалентные связи. Комплементарностью лиганда и центра связывания можно объяснить высокую специфичность (избирательность) взаимодействия белок - лиганд. Важно отметить, что изменение пространственной структуры белка в процессе денатурации (см. 2.4) приводит к разрушению центров связывания и утрате биологической функции белка. |
Денатурацией белков называется это изменение нативных (природных) физико-химических и, главное, биологических свойств белка вследствие нарушения его четвертичной, третичной и даже вторичной структуры. Денатурацию белка могут вызвать:
· температура выше 60° С;
· ионизирующая радиация;
· концентрированные кислоты и щёлочи;
· соли тяжёлых металлов (ртути, свинца, кадмия);
· органические соединения (спирты, фенолы, кетоны).
Для денатурированных белков характерно:
· изменение конформации молекулы;
· уменьшение растворимости в воде;
· изменение заряда молекулы;
· меньшая устойчивость к действию протеолитических ферментов;
· потеря биологической активности.
Обратите внимание, что при определённых условиях возможно восстановление исходной (нативной) конформации белка после удаления фактора, вызвавшего денатурацию. Этот процесс получил название ренаживации.
Запомните некоторые примеры использования процесса денатурации белков в медицине:
· для осаждения белков плазмы крови при определении содержания небелковых веществ в крови;
· при проведении дезинфекции и санитарной обработки;
· при лечении и профилактике отравлений солями тяжёлых металлов (в качестве противоядия применяют молоко или яичный белок);
· для получения лекарственных веществ белковой природы (используется денатурация в мягких условиях с последующей ренативацией).
Строение и биологическая роль нуклеотидов.
Нуклеиновыми кислотамиили полинуклеотидами называются высокомолекулярные вещества, состоящие из нуклеотидов, соединённых в цепь 3', 5'-фосфодиэфирными связями. Каждый нуклеотид состоит из азотистого основания, углевода (пентозы) и остатка фосфорной кислоты.
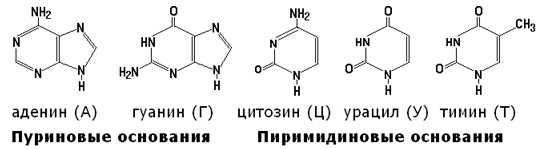
Азотистые основания, входящие в состав нуклеотидов, имеют следующее строение:
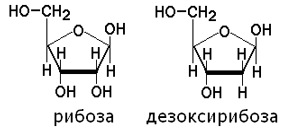
 Углеводы представлены рибозой и дезоксирибозой:
Углеводы представлены рибозой и дезоксирибозой:
 4.1.2.Азотистое основание и пентоза, соединённые N-гликозидной связью, образуют нуклеозид. Если в качестве пентозы в нуклеозиде присутствует рибоза, то это рибонуклеозид, а если дезоксирибоза - то это дезоксирибонуклеозид.
4.1.2.Азотистое основание и пентоза, соединённые N-гликозидной связью, образуют нуклеозид. Если в качестве пентозы в нуклеозиде присутствует рибоза, то это рибонуклеозид, а если дезоксирибоза - то это дезоксирибонуклеозид.
|
4.1.3. Нуклеотиды представляют собой фосфорилированные нуклеозиды. Остаток фосфорной кислоты, как правило, присоединяется к гидроксильной группе пентозы в 5'-положении при помощи сложноэфирной связи. Примеры:
В клетках встречаются также нуклеозиддифосфаты и нуклеозидтрифосфаты, содержащие соответственно два и три остатка фосфорной кислоты. Биологическая роль этих соединений будет рассматриваться в дальнейшем.
6. Первичная и вторичная структуры ДНК. Правила Чаргаффа. Принцип комплементарности. Типы связей в молекуле ДНК. Биологическая роль ДНК. Молекулярные болезни - следствие генных мутаций.
Первичной структурой нуклеиновых кислот называется последовательность расположения мононуклеотидов в цепи ДНК или РНК. Первичная структура нуклеиновых кислот стабилизируется 3',5'-фосфодиэфирными связями. Эти связи образуются при взаимодействии гидроксильной группы в 3'-положении пентозного остатка каждого нуклеотида с фосфатной группой соседнего нуклеотида (рисунок 3.2),
Таким образом, на одном конце полинуклеотидной цепи имеется свободная 5'-фосфатная группа (5'-конец), а на другом - свободная гидроксильная группа в 3'-положении (3'-конец). Нуклеотидные последовательности принято записывать в направлении от 5'-конца к 3'-концу.
ДНК (дезоксирибонуклеиновая кислота) содержится в клеточном ядре и имеет молекулярную массу порядка 1011 Да. В состав её нуклеотидов входят азотистые основания аденин, гуанин, цитозин, тимин, углевод дезоксирибоза и остатки фосфорной кислоты. Содержание азотистых оснований в молекуле ДНК определяют правила Чаргаффа:
1) количество пуриновых оснований равно количеству пиримидиновых (А + Г = Ц + Т);
2) количество аденина и цитозина равно количеству тимина и гуанина соответственно (А = Т; Ц = Г);
3) ДНК, выделенные из клеток различных биологических видов, отличаются друг от друга величиной коэффициента специфичности:
(Г + Ц) /(А + Т)
Эти закономерности в строении ДНК объясняются следующими особенностями её вторичной структуры:
1) молекула ДНК построена из двух полинуклеотидных цепей, связанных между собой водородными связями и ориентированных антипараллельно (то есть 3'-конец одной цепи расположен напротив 5'-конца другой цепи и наоборот);
2) водородные связи образуются между комплементарными парами азотистых оснований. Аденину комплементарен тимин; эта пара стабилизируется двумя водородными связями. Гуанину комплементарен цитозин; эта пара стабилизируется тремя водородными связями (см. рисунок б). Чем больше в молекуле ДНК пар Г-Ц, тем больше её устойчивость к действию высоких температур и ионизирующего излучения;
3) обе цепи ДНК закручены в спираль, имеющую общую ось. Азотистые основания обращены внутрь спирали; кроме водородных, между ними возникают также гидрофобные взаимодействия. Рибозофосфатные части расположены по периферии, образуя остов спирали (см. рисунок 3.4).
Рисунок 3.4. Схема строения ДНК. 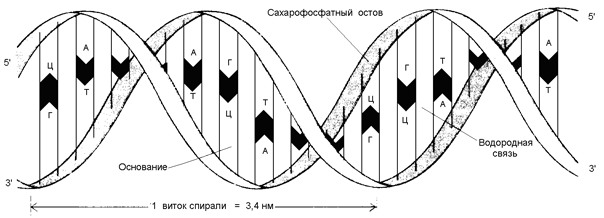
Первичная и вторичная структуры РНК. Типы РНК: особенности строения. Основные компоненты белоксинтезирующей системы. Функция рибосом. Адапторная функция тРНК и роль мРНК в синтезе белка.
РНК (рибонуклеиновая кислота) содержится преимущественно в цитоплазме клетки и имеет молекулярную массу в пределах 104 - 106 Да. В состав её нуклеотидов входят азотистые основания аденин, гуанин, цитозин, урацил, углевод рибоза и остатки фосфорной кислоты. В отличие от ДНК, молекулы РНК построены из одной полинуклеотидной цепи, в которой могут находиться комплементарные друг другу участки (рисунок 3.5). Эти участки могут взаимодействовать между собой, образуя двойные спирали, чередующиеся с неспирализованными участками.

Рисунок 3.5. Схема строения транспортной РНК.
По особенностям структуры и функции различают три основных типа РНК:
1) матричные (информационные) РНК (мРНК) передают информацию о структуре белка из клеточного ядра на рибосомы;
2) транспортные РНК (тРНК) осуществляют транспорт аминокислот к месту синтеза белка;
3) рибосомальные РНК (рРНК) входят в состав рибосом, участвуют в синтезе белка.
8. Биосинтез ДНК (репликация) и мРНК (транскрипция). Процессы "созревания" первичного транскрипта при образовании мРНК.
Матричный биосинтез – процесс сборки новых макромолекул из мономеров, последовательность которых запрограммирована с помощью нуклеиновых кислот. Молекулы, используемые в качестве программы в матричном биосинтезе, называют матрицами.
Тремя главными матричными биосинтезами, присущими всем без исключения живым организмам, являются репликация ДНК, транскрипция и трансляция.
· репликация ДНК происходит в ядре, предшествует делению клеток, в результате чего дочерние клетки получают полный набор генов;
· транскрипция также осуществляется в ядре, в ходе её образуются матричные, транспортные и рибосомальные РНК, участвующие в синтезе белка в клетке;
· трансляция происходит на рибосомах и приводит к образованию специфических клеточных белков.
Связь этих процессов отражена в основном постулате молекулярной биологии: направление потока информации от генотипа к фенотипу: ДНК → РНК → белок (стрелки обозначают направление передачи информации).
4.3.2. Кроме того, для некоторых видов вирусов характерны ещё два вида матричных синтезов:
· репликация РНК – синтез РНК на матрице РНК;
· обратная транскрипция – синтез ДНК с использованием в качестве матрицы молекулы РНК.
4.3.3. Попытаемся сформулировать общие закономерности, характерные для всех матричных биосинтезов.
1. Мономеры (нуклеотиды, аминокислоты) непосредственно в синтезе полимеров участвовать не могут; они должны находиться в активной форме – нуклеотиды – в виде нуклеозидтрифосфатов, аминокислоты – в виде соединений с тРНК.
2. Синтез всех полинуклеотидных и полипептидных цепей складывается из трёх основных этапов – инициации, элонгации и терминации.
3. На матрице имеется специальный сигнал или группа сигналов, позволяющие опознать кодирующий элемент, с которого начинается информация о синтезируемой цепи биополимера. Этот сигнал, как правило, не совпадает с точкой физического начала полимерной цепи матрицы. Инициация – процесс, в котором происходит присоединение первого мономерного звена к молекуле-матрице.
4. На каждый акт инициации биосинтеза приходится большое количество актов элонгации, т.е. соединения очередного мономера с растущей цепью. В элонгации участвуют 3 компонента: а) концевая группа синтезируемого полимера, б) кодирующий элемент матрицы, в) очередная молекула активного мономера. Все они должны быть зафиксированы определённым образом в активном центре фермента или рибосомы.
5. Каждый акт элонгации начинается с отбора субстратов путём перебора всех присутствующих субстратов в системе. Попадание в активный центр нужного субстрата является сигналом для осуществления ферментативной реакции соединения мономерного фрагмента с концом синтезируемой полимерной цепи. Присоединение мономера к растущей цепи служит сигналом для перемещения активного центра на один кодирующий элемент матрицы.
6. Конец продукта чаще всего не соответствует концу матрицы, на ней должен быть специальный сигнал, обеспечивающий прекращение роста цепи, т.е. терминацию.
7. Синтез биологически активной молекулы, как правило, не заканчивается терминацией. Образующийся полимер претерпевает ряд превращений, таких как частичный гидролиз и объединение нескольких цепей в одну, модификация мономеров в составе полимера, присоединение простетической части (к полипептиду) или апопротеина (к полинуклеотиду).
Репликация – процесс самоудвоения ДНК, или биосинтез дочерней молекулы ДНК, полностью идентичной исходной молекуле (матрице). Локализация процесса – клеточное ядро. Основные принципы репликации ДНК:
· комплементарность - синтезируемые цепи комплементарны матрице;
· антипараллельность - 5'-конец синтезируемой полинуклеотидной цепи находится напротив 3'-конца матрицы и наоборот;
· униполярность - синтез полинуклеотидных цепей происходит всегда в направлении 5' → 3';
· потребность в затравке - ферменты, синтезирующие ДНК, способны лишь наращивать существующую полинуклеотидную цепь, поэтому вначале синтезируется короткая цепь РНК (затравка или праймер), к которой присоединяются дезоксирибонуклеотиды; выполнившая свою роль РНК-затравка удаляется;
· прерывистость - одна из дочерних цепей (лидирующая) в процессе репликации растёт непрерывно, а другая (отстающая) - в виде фрагментов длиной в несколько сот нуклеотидов (фрагментов Оказаки);
· полуконсервативность - в результате репликации образуются две двойные дочерние ДНК, каждая из которых сохраняет (консервирует) в неизменном виде одну из половин материнской ДНК.
4.4.2. Условия, необходимые для репликации ДНК:
1) Матрица – молекула ДНК (рисунок 26.1, а);
2) Расплетающие белки – разрывают водородные связи между комплементарными основаниями двойной спирали ДНК, в результате чего образуется репликативная вилка (рисунок 26.1, б);
3) ДНК-связываюшие белки - присоединяются к разделившимся цепям ДНК и препятствуют их обратному воссоединению;
4) Праймаза (РНК-полимераза) - фермент, синтезирующий затравочную РНК.
5) Субстраты и источники энергии – дезоксирибонуклеозидтрифосфаты (дАТФ, дГТФ, дТТФ, дЦТФ). Присоединяются к азотистым основаниям полинуклеотидных цепей при помощи водородных связей по принципу комплементарности;
6) ДНК-полимераза – фермент, который формирует из нуклеозидтрифосфатов новые полинуклеотидные цепи за счёт образования 3’,5’-фосфодиэфирных связей. Источником энергии служат макроэргические связи нуклеозидтрифосфатов. На одной ветви репликативной вилки синтезируется непрерывная цепь, на другой – фрагменты Оказаки (рисунок 26.1, в);
7) ДНК-лигаза – фермент, соединяющий фрагменты Оказаки в единую цепь (рисунок 26.1, г).
В результате образуются две идентичные молекулы ДНК (рисунок 26.1, д).
Транскрипция – биосинтез РНК на матрице ДНК. Процесс транскрипции также происходит в клеточном ядре. Основные принципы транскрипции:
· комплементарность - синтезируемые цепи комплементарны матрице;
· антипараллельность - 5'-конец синтезируемой полинуклеотидной цепи находится напротив 3'-конца матрицы и наоборот;
· униполярность - синтез полинуклеотидных цепей происходит всегда в направлении 5' → 3';
· беззатравочность - биосинтез РНК не требует наличия праймера;
· асимметричность - синтез дочерней цепи идёт только на одной цепи ДНК-матрицы, вторая при этом блокирована.
4.5.2. Условия, необходимые для транскрипции:
· Матрица – участок одной из цепей ДНК (рисунок 8.2, а);
· ДНК-зависимая РНК-полимераза – главный фермент, участвующий в транскрипции. Место присоединения фермента к ДНК – промотор;
· Субстраты и источники энергии – рибонуклеозидтрифосфаты (АТФ, ГТФ, УТФ, ЦТФ). Связываются с азотистыми основаниями транскрибируемой цепи ДНК водородными связями по принципу комплементарности.
9. Биосинтез белков. Генетический код. Последовательность реакций при синтезе полипептидной цепи (инициация, элонгация, терминация) в процессе трансляции на рибосомах. Посттрансляционная модификация молекул белков. Нарушения синтеза белка в детском возрасте (квашиоркор) .
| Трансляция(от англ. translation – перевод) – перевод генетической информации, заключённой в мРНК, в линейную последовательность аминокислот в полипептидной цепи. Этот перевод осуществляется посредством генетического (биологического) кода. 5.1.2. Генетический код – последовательность нуклеотидов, соответствующая определённым аминокислотам. Генетический код характеризуется свойствами: · код триплетный – каждой аминокислоте соответствует тройка (триплет) нуклеотидов – кодон. Всего существует 43 = 64 кодона. Из них 61 является смысловым (то есть кодирует определённую аминокислоту) и 3 – бессмысленными (терминирующими); · код неперекрывающийся – один и тот же нуклеотид ДНК или РНК не может принадлежать одновременно двум соседним кодонам; · код непрерывный – отсутствуют «знаки препинания», вставки между кодонами в полинуклеотидной цепи; · код вырожденный (множественный) – некоторые аминокислоты могут кодироваться более, чем одним триплетом нуклеотидов (так как кодонов 61, а аминокислот – 20); · код универсальный – смысл кодонов одинаков для организмов всех видов. 5.1.3.Аминокислоты и триплеты нуклеотидов, кодирующие их, не комплементарны друг другу. Поэтому должны существовать молекулы-адапторы, каждая из которых может взаимодействовать как с определённым кодоном, так и с соответствующей аминокислотой. Такими молекулами являются транспортные РНК (рисунок 8.3). Каждая тРНК содержит триплет нуклеотидов – антикодон, который комплементарен строго определённому кодону мРНК. 3’-конец тРНК (акцепторный участок) является местом присоединения аминокислоты, соответствующей кодону мРНК. |
Активация аминокислот – подготовительный этап биосинтеза белка – включает связывание их со специфическими тРНК при участии фермента аминоацил-тРНК-синтетазы. Реакция происходит в цитоплазме клеток.
Собственно процесс трансляции включает 3 стадии – инициации, элонгации, терминации и происходит на рибосомах.
Каждая рибосома состоит из большой и малой субчастиц (40S и 60S) и содержит аминоацильный (А) и пептидильный (П) участки. Пептидильный участок связывает инициирующую аминоацил-тРНК, все остальные аминоацил-тРНК присоединяются к аминоацильному участку.
1) Стадия инициации – начало трансляции. Условия, необходимые для инициации:
· инициирующий кодон мРНК (АУГ);
· белковые факторы инициации;
· малая и большая субчастицы рибосомы;
· ГТФ (источник энергии для смыкания субчастиц рибосомы);
· ионы магния;
· инициирующая аминоацил-тРНК (метионил-тРНК) – связывается своим антикодоном с инициирующим кодоном мРНК в пептидильном участке рибосомы.
В результате образуется инициирующий комплекс: мРНК – рибосома – метионил-тРНК (рисунок 5.3, а).
2) Стадия элонгации – удлинение полипептидной цепи на 1 аминокислотный остаток – происходит в три шага:
· присоединение к инициирующему комплексу аминоацил-тРНК, соответствующей кодону, находящемуся в аминоацильном участке рибосомы (рисунок 5.3, б);
· транспептидация – образование пептидной связи между остатками аминокислот (рисунок 5.3, в). Источник энергии – ГТФ;
· транслокация – перемещение рибосомы относительно мРНК на 1 триплет (рисунок 5.3, г). Источник энергии – ГТФ. В ходе элонгации принимают участие белковые факторы.
Описанный процесс многократно повторяется (по количеству аминокислот в цепи).
3) Стадия терминации – окончание трансляции. Обеспечивается присутствием в цепи мРНК одного из терминирующих (бессмысленных) кодонов – УАА, УГА или УАГ. В освобождении полипептида участвуют белковые факторы терминации (рисунок 5.3, д). Когда в аминоацильном участке оказывается один из бессмысленных кодонов, факторы терминации стимулируют гидролазную активность пептидилтрансферазы. Благодаря этому гидролизуется связь между тРНК и пептидом. ГТФ для этой реакции не требуется. После этого пептидная цепь, тРНК и мРНК покидают рибосому, а её субчастицы диссоциируют.
Таким образом, трансляция мРНК приводит к формированию пептидной цепи со строго определённой последовательностью аминокислотных остатков. Следующий этап формирования белка – фолдинг, т.е. сворачивание пептидной цепи в правильную трёхмерную структуру. Если белок состоит из нескольких субъединиц, то фолдинг включает и объединение их в единую макромолекулу.
Считается, что небольшие белковые молекулы, содержащие около 100 аминоацильных остатков, могут самостоятельно принимать трёхмерную структуру, фолдинг более крупных полипептидных цепей требует участия специальных белков – шаперонов.
Шапероны называют иначе белками теплового шока, так как они не только обеспечивают правильный фолдинг вновь образованных белков, но и ренатурацию ранее синтезированных белков, подвергшихся в клетке частичной денатурации под действием различных факторов (перегрев, облучение, действие своблодных радикалов и т.д.).
5.2.2. Посттрансляционные модификации белковой молекулы могут включать:
· частичный протеолиз (например, превращение профермента в фермент);
· присоединение простетической группы (остатков фосфорной кислоты, углеводных остатков, гемовых групп и т.д.);
· модификации боковых цепей аминокислотных остатков:
o гидроксилирование пролина в гидроксипролин в коллагене,
o метилирование аргинина в гистоне,
o йодирование тирозина в тироглобулине).
5.2.3. Действие токсических и лекарственных веществ на биосинтез белка. Биосинтез белка является одним из наиболее сложных процессов, протекающих в клетках. Его прерывание или извращение возможно в результате нарушения любого из трёх матричных синтезов.
Так, мутагены (бенз(а)пирен, линдан) нарушают репликацию ДНК и таким образом прерывают белоксинтезирующие процессы.
Некоторые токсические вещества (госсипол) могут изменять скорость транскрипции.
К лекарственным веществам, влияющим на биосинтез белка, относятся антибиотики и интерфероны.
Антибиотики, блокирующие матричные биосинтезы, используются в лечении инфекционных заболеваний и злокачественных опухолей. (см. таблицу 5.1).
Таблица 5.1