ОСНОВНАЯ ЧАСТЬ
Вариант №24
Контрольная работа №1
По теме “Реакционная способность веществ”.
Задание 6.
Определить массовую долю кислорода (в процентах) в оксиде азота (IV).
Решение.
Формула определения массовой доли определенного компонента в смеси:
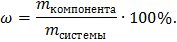
Молярная масса кислорода равна 32 г/моль, молярная масса этого соединения M(NO2)=46 г/моль, подставляем известные значения в формулу:
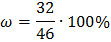

Ответ: массовая доля кислорода в оксиде азота (IV) равна 69,5%.
Задание 34.
1).Напишите электронную формулу невозбужденного атома элемента с зарядом ядра z, приведите графическую схему распределения электронов по квантовым ячейкам (орбиталям).
2).Укажите валентные электроны его атома. Для каждого из них приведите значения всех квантовых чисел.
3). Сколько в атоме данного элемента электронов с совокупностью главного и орбитального квантовых чисел n и l?
Дано:
z= 50; n= 5;l= 1.
Решение.
1). Элементом с зарядом ядра 50 является олово(Sn), напишем электронную формулу невозбужденного атома элемента Sn:
50Sn - 1S22S22P63S23P63D104S24P64D104F05S25P2
Графическая схема распределения электронов по квантовым ячейкам:

2). Валентными электронами p-элементов являются s и p электроны внешнего квантового уровня. Для олова это 5s2 5p2. Номер группы указывает максимальное число валентных электронов. Значения квантовых чисел, характеризующих валентные электроны, очевидны из выше приведенных графических схем.
3). 50Sn
| Номер электрона | Подуровень | Квантовые числа | |||
| n | e | me | ms | ||
| s | +½ | ||||
| –½ | |||||
| p | -1 | +½ | |||
| +½ |
Задание 49.
Составьте формулы оксидов и гидроксидов элементов второго периода (Li, Be, B, C, N) в их высших степенях окисления. Как изменяется в этом ряду кислотно-основной характер гидроксидов? Приведите обоснованный ответ.
Решение.
В периодах основные свойства оксидов и гидроксидов ослабевают, а кислотные усиливаются, поэтому:
а)Li, Li2O основной оксид реагирует с кислотными оксидами и солями, R2O подгруппа лития.
б)Be, BeO (амфотерный) основной оксид реагирует с кислотами и солями, RO подгруппа бериллия. Гидроксид Ве (ОН)2- амфотерные соединения.
в)B, B2O3 кислотный оксид реагирует с основаниями и солями, R2O3 подгруппа алюминия.
г)C, CO2 кислотный оксид реагирует с оксидами (основными), RO2 подгруппа углерода.
д)N, N2O5 кислотный оксид реагирует с основаниями,подгруппа R2O5.
Контрольная работа №2
По теме “Химическая термодинамика и кинетика”.
Задание 74.
Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция, протекающая по уравнению:
H2(г) + CO2(г) = CO(г) + H2O(ж); ∆H = -2,85 кДж.
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите  реакции.
реакции.
Решение.
H2(г) +CO2(г) =CO(г) +H2O(ж);∆H=-2,85кДж
∆Sх.р. =197,91+69,94-213,65-130,59=-76,39Дж/моль*К
∆Gх.р. = -2,85 - 298*(-76,39/1000) = 19,91 кДж
При стандартных условиях невозможна экзотермическая реакция, т.к. ∆Gх.р. >0.
Ответ: при стандартных условиях невозможна экзотермическая реакция.
Задание 87.
В гетерогенной системе установилось равновесие. Напишите выражение для константы равновесия. Дайте обоснованные ответы на вопросы: а) как уменьшение давления отразится на состоянии равновесия; б) в каком направлении сместится равновесие при уменьшении температуры; в) как и во сколько раз изменится скорость прямой реакции при уменьшении давления в системе в два раза?
FeO(к) + H2(г) 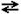 Fe(к) + H2O, ΔH > 0
Fe(к) + H2O, ΔH > 0
Решение.
Константа равновесия для системы FeO(к) + H2(г) 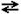 Fe(к) + H2O, ΔH > 0 получается такая:
Fe(к) + H2O, ΔH > 0 получается такая:
K=[H2O]/[H2]=p(H2O)/p(H2)
а) На одну молекулу газообразного вещества реагентов (водорода) образуется одна молекула газообразных продуктов (водяной пар). Таким образом, количество газа и давление (при изохорно-изотермическом процессе) в ходе реакции не изменяются. Следовательно, изменение давления на равновесие не влияет.
б)При повышении температуры равновесие смещается в сторону эндотермической, а при понижении – в сторону экзотермической реакции.
в)Изменение общего давления приводит к изменению парциальных давлений всех газов в равное число раз и (в данном случае) не нарушает равновесие.
Задание 114.
Какой объем раствора вещества NaOH с массовой долей ω1, (плотность ρ1)следует взять для приготовления объема V2 раствора с массовой долей ω2 (плотность ρ2)? Чему равна молярная концентрация полученного раствора? При ω1=40%, ρ1=1,430 г/моль, V2=5 л, ω2=10%, ρ2=1,110 г/моль.
Решение.
Определяем массу вещества, при 10%:
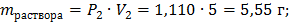
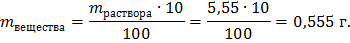
Определяем массу вещества, при 40%:
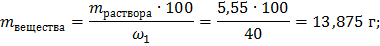
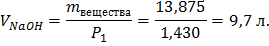
Зная молекулярную массу NaOH находим молярную концентрацию:
M(NaOH)= 40 г/моль.
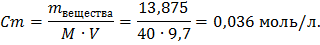
Ответ: Cm=0,036 моль/л, V(NaOH)=9,7 л.
Контрольная работа №3
по теме “Электрохимические системы”.
Задание 125.
Окислительно-восстановительные реакции протекают по приведенным схемам. Для каждой реакции укажите: а) окислитель и восстановитель; б) какое вещество окисляется, какое вещество восстанавливается. Составьте электронные уравнения и на основании их расставьте коэффициенты в уравнениях реакций.
1) Cr2O3 + KNO3 + KOH → K2CrO4 + KNO2 + H2O;
2) HNO3 + H2S → H2SO4 + NO + H2O.
Решение.
1) Cr2O3 + KNO3 + KOH = K2CrO4 + KNO2 + H2O
2Cr{+3} — 6e = 2Cr{+6} 1 — окисление
N{+5} + 2e = N{+3} 3 — восстановление
Cr2O3 + 3KNO3 + 4KOH = 2K2CrO4 + 3KNO2 + 2H2O
2) HNO3 + H2S = H2SO4 + NO + H2O
S{-2} — 8e = S{+6} 3 — окисление
N{+5} + 3e = N{+2} 8 — восстановление
3Н2S + 8HNO3 = 3H2SO4 + 8NO + 4H2O
Задание 150.
Напишите уравнения анодного и катодного процессов. Суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе. Вычислите величину электродвижущей силы (ЭДС) гальванического элемента при указанных молярных концентрациях растворов соответствующих солей.
Pb | Pb(NO3)2 || AgNO3 | Ag
(1 M) (0,01 M)
Решение.
Правый электрод: 
Левый электрод: 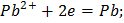
Общая реакция: 
ЭДС гальванического элемента вычисляется по формуле:
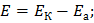
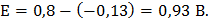
Ответ: E= 0,93 В.
Задание 165.
Электролиз водного раствора вещества KI проводили с угольными электродами катодного и анодного процессов. Вычислите массы веществ, выделившихся на катоде и на аноде. Определите объем выделившихся газообразных веществ (н.у.). При I=10 А,  =50 мин.
=50 мин.
Решение.
Электролиз йодида калия протекает по следующей схеме:
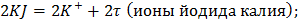
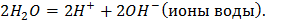
На аноде:
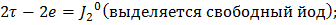
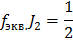
На катоде:
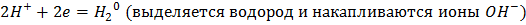
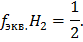
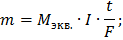
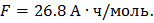
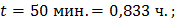

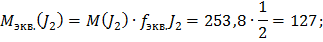
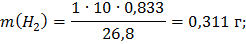



Ответ: Масса йода = 39,47 г, масса водорода = 0,311 г, объем водорода = 3,5 л.
Задание 183.
Какие коррозионные процессы могут протекать при контакте двух металловCu, Ag? Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии в заданных условиях. Если коррозия невозможна, то объясните, почему?
а) аэрируемый раствор H2SO4;
б) закрытый сосуд с раствором HCl.