Фаза инициации
У эукариот в области промотора транскриптона, включающего “знаковые” (узнаваемые белками) нуклеотидные последовательности (- тата -; - цаат -), образуется мультибелковый инициаторный комплекс. Среди белков комплекса – общие транскрипционные факторы, обусловливающие точную “посадку” на биспираль ДНК РНК-полимеразы, определение точки начала транскрипции и положения инициирующего кодона, взаимодействие с энхансерами и специфическими транскрипционными факторами. В месте “посадки” РНК-полимеразы биспираль ДНК расплетается и ее матричная цепь открывается для считывания биоинформации;
Осуществляется:
· ДНК – зависимыми РНК – полимеразами
· Оператором
· Промотором, содержащим блок Прибнова5' - ТАТААТ - 3', который является стартом транскрипции
· Белковыми факторами инициации
Фаза элонгации
Наращивание РНК транскрипта идет в направлении 5́ → 3́; скорость транскрипции – 30 нуклеотидов/сек. “надежность” транскрипции – 1 ошибка на 2·104 включенных нуклеотида;
РНК-полимераза наращивает молекулу РНК транскрипта на 3́ конце путем присоединения из пула рибонуклеозидтрифосфатов – АТФ, ГТФ, УТФ и ЦТФ – требуемого рибонуклеозидмонофосфата;
У прокариот еще до окончания транскрипции на РНК транскрипте с 5́ конца начинается трансляция. У эукариот первоначально образуется пре-и(м)РНК транскрипт, который отсоединяется от матрицы и подвергается процессингу с образованием зрелых и(м)РНК. пре-РНК транскрипты образуются для рРНК и, возможно, для тРНК.
Регуляторы скорости транскрипции:энхансеры – (ускоряют) и сайленсеры (замедляют)
Фаза терминации
Процесс транскрипции завершается, когда РНК-полимераза, перемещаясь вдоль матричной цепи ДНК, достигает кодона-терминатора (АТТ, АТЦ, АЦТ).
По завершении транскрипции эукариотические и(м)РНК на 3́ конце полиаденилируются;
По завершении транскрипции пре-и(м)РНК транскрипт (пре-рРНК транскрипт и, возможно, пре-тРНК транскрипт) отсоединяется от матрицы ДНК и подвергается процессингу.
Терминация транскрипции осуществляется палиндромом, который образует шпилечную структуру или фигуру «креста»
Регуляция генной активности:
Эукариоты
Различают неспецифическую и специфическую регуляцию генной активности;
Механизм неспецифической регуляции работает на всех уровнях организации генетического аппарата (генном, хромосомном, геномном) и заключается в гетерохроматизации генетического материала;
Главные участники специфической регуляции генной активности: промотор, энхансеры и сайленсеры, общие и специфические транскрипционные факторы, белки ядерного матрикса, метилирование азотистых оснований днк (цитозина);
“ген-господин” контролирует синтез ключевого белка-регулятора экспрессии многих генов (“гены-рабы”).
Регуляция генной активности идет за счет специальных регуляторных белков, которые кодируются регуляторными генами
Прокариоты
Для прокариот характерен полицистронный (цистрон = структурный ген) принцип организации генной активности. Цистроны объединяются в единую функциональную систему- оперон.Оперон — это тесно связанная последовательность структурных генов, определяющих синтез группы белков, которые участвуют в одной цепи биохимических преобразований если они участвуют в одной цепи биохимических преобразований.
Лактозный оперон e. Coli. Негативная регуляция - в отсутствие в среде лактозы ген-оператор (часть промотора) заблокирован белком-репрессором (продукт гена-регулятора). Появившаяся лактоза инактивирует репрессор. Ген-оператор активируется, РНК-полимераза “допускается” к промотору и оперон транскрибируется; позитивная регуляция – основана на наличии белка-активатора (cap), который увеличивает сродство промотора к РНК-полимеразе и активирует оперон, но в условиях высокой концентрации цамф (ситуация глюкозного “голода”, необходим переход к использованию лактозы и некоторых др. Сахаров).
11) Транкриптон: единица генетической(транскрипционной) активности ДНК у эукариот.
Единица генетической активности ДНК у эукариот – транскриптон
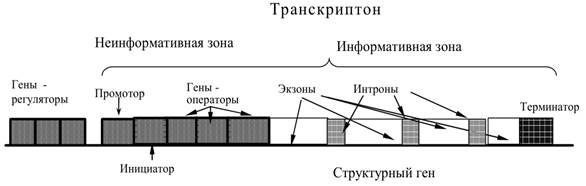
Инициирующий транскрипцию кодон (ТАЦ –Метионин), за которым следует первый значимыйКодон;
Экзоны (функциональная часть: транскрибируются, транслируются)
Интроны (НЕинформативные участки: транскрибируются, НЕтранслируются)
Завершающий транскрипцию кодон-терминатор(АТТ, АТЦ или АЦТ), следующий за последнимзначимым кодоном;
12) Посттранскрипционные процессы – процессинг пре-и(м)РНК (гяРНК) транскрипта, сплайсинг гяРНК,ядерно-цитоплазматический транспорт и(м)РНК, ядерные и цитоплазматические информосомы.
После окончания транскрипции, как у прокариот, так и у эукариот происходит цепь биохимических реакций, которая приводит к созреванию молекул предшественников: транспортной РНК(пре-тРНК) и рибосомной РНК (пре-рРНК) и пре-мРНК (только у эукариот). Совокупность реакций, приводящая к формированию зрелой (готовой к трансляции) молекулы мРНК, называется процессингом.
Особенности транскрипции у эукариот. Процессинг мРНК. Процессннг включает следующие преобразования молекулы мРНК:
1) метилирование и кэпирование;
2) полиаденилирование;
3) сплайсинг.
Эукариотические мРНК несут, как правило, на 5'-конце дополнительную группу: КЭП-модифицированный в 7-положении метилированный остаток гуанозин-5'-трифосфата, соединенный с концевым нуклеозидом 5'-5'-способом, Кэпирование РНК осуществляется ферментами: гуанилтрансферазой и метилтрансферазой. Предполагают, что КЭП необходим для регуляции трансляции и для стабилизации мРНК, (он предохраняет ее от действия 5'-экзонуклеаз), К 3'-концу РНК после завершения ее синтеза с помощью фермента поли(А)-полимеразы присоединяется последовательность полиадениловой кислоты. Этот процесс называют полиаденилированием. Остальные варианты преобразования пре-мРНК: вырезание нитронов и сшивание экзонов (сплайсинг) в эукариотических генах, а также образование различных сочетаний экзонов, входящих в зрелую мРНК (альтернативный сплайсинг).
Эукариотические мРНК в отличие от прокариотических стабильны в течение часов и суток. Это объясняется, во-первых, стабилизацией 5'- и 3'-концов, а во-вторых, связыванием мРНК с белками (т.е. образованием информосом). Пре-мРНК на всех стадиях процессинга и после него связана с белками. Информосомы могут быть ядерными и цитоплазматическими. Ядерные информосомы - это рибонуклеопротеиновые (РНП) частицы с константой седиментации 30S.
Посттранскрипционный внутриядерный перенос пре-мРНК из ядра в цитоплазму осуществляется с помощью ядерных информосом. При этом переносе зрелой мРНК происходит замена связанных с мРН К белков. Ядерные информоферы (белковые глобулы) остаются в ядре, а мРНК после перехода в цитоплазму объединяется с новыми белками, образуя цитоплазматические информосомы. Цитоплазматические информосомы не обязательно транслируются, т.е. могут быть свободными.
Пре-и(м)рнк транскрипт эукариот содержит транслируемую (соответствует экзонам ДНК) и нетранслируемую (соответствует интронам ДНК) части;
В области сплайосом транскрипт разрывается и интронные участки удаляются;
Экзонные участки пре-и(м)РНК транскрипта соединяются – сплайсинг – с образованием зрелых и(м)РНК;
Зрелые и(м)РНК комплексируются с белками (информоферы) – ядерные информосомы, которые перемещаются к ядерной оболочке (возможно, к порам);
Сплайсинг - вырезание интронов и сшивание экзонов (сплайсосомы –мярнк + белки) идет в ядре
Альтернативный сплайсинг - путем различных комбинаций экзонных участков из одного пре-и(м)РНК транскрипта образуется несколько зрелых и(м)РНК.
Кепирование – на 5,-конце мрнк образуется защита – кэп(шапочка)путем + метилированного гуанозина ч/з остаток фосфорной кислоты)
Полиаденилирование – на 3, конце мрнк защита – «поли (а)хвост»идет + адениловых остатков (до200)
13) Трансляция биоинформации – рибосомный цикл. Биосинтез белка.
Трансляция - перевод нуклеотидной последовательности мРНК в аминокислотную последовательность полипептида. Осуществляется в цитоплазме на рибосомах (на шЭПС, в гиалоплазме) Участвуют: мРНК, рРНК, тРНК, белковые факторы
В названном комплексе и(м)РНК несет биоинформацию о последовательности аминокислот в полипептиде; рибосомы создают условия для пространственного взаиморасположения участников процесса и для осуществления требуемых каталитических и регуляторных актов; тРНК “транслирует” нуклеотидный текст в аминокислотный;
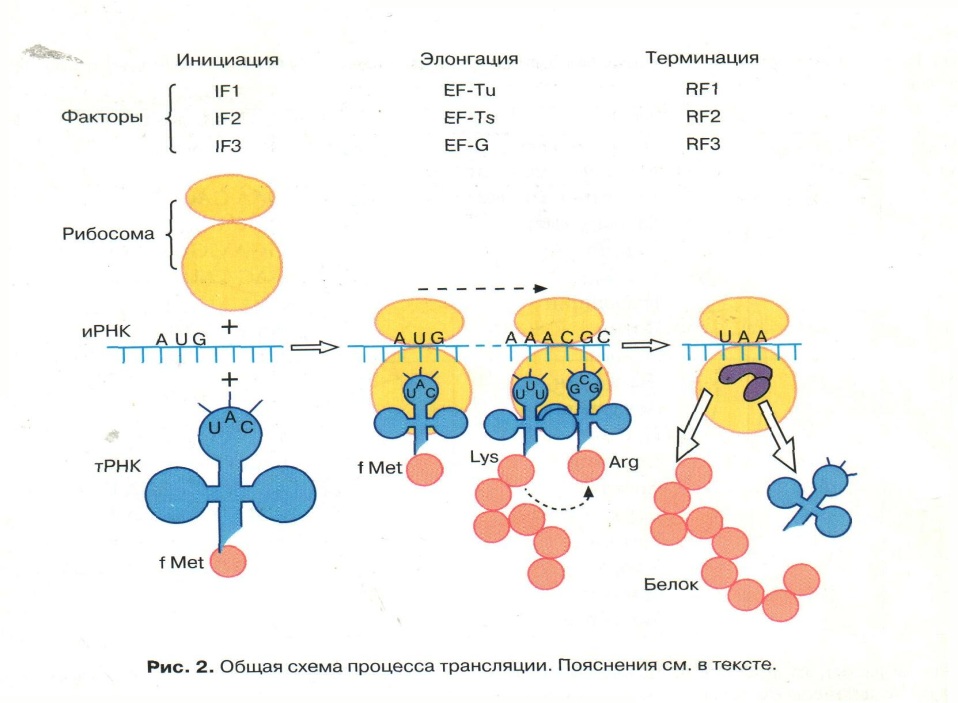
Трансляция, начавшись, идет, не прерываясь, вплоть до завершения; субъединицы рибосом, тРНК, некоторые белки участвуют в процессе неоднократно – “рибосомный цикл биосинтеза белков”; начало и окончание трансляции задаются однозначно сигнальными кодонами и(м)РНК – инициирующим и терминатором;
Трансляция – матричный процесс; в нем выделяют фазы инициации, элонгации и терминации;
Фаза инициации
1. Включение в пептидную цепь в качестве первой а. К. – модифицированного МЕТИОНИНА, с которого начинается ВСЕ синтезы пептидов.
2. Инициаторная тРНК с а.к. - метионин узнает малую субъединицу рибосом с помощью Белковых Факторов Инициации
3. Малая субъединица рибосом узнает мРНК и ее инициирующий кодон стартовый - АУГ
4. Образуется комплекс Малая субъединица рибосом + тРНК + мРНК
5. Формируются участки ФЦР: А – центр, где устанавливается связь «кодон –антикодон» и П –центр, где образуются пептидные связи между аминокислотами.
Фаза элонгации
Фаза элонгации – циклический процесс: с каждым очередным шагом строящийся полипептид удлинняется на один аминокислотный остаток;
Влючает в себя 3 этапа.
На первом этапе молекула аминоацил-тРНК связывается со свободным участком рибосомы, примыкающим к занятому Р-участку. Связывание осуществляется путем спаривания трех нуклеотидов антикодона с тремя нуклеотидами иРНК, находящимися в А-участке.
На втором этапе карбоксильный конец полипептидной цепи отделяется в Р-участке от молекулы тРНК и образует пептидную связь с аминокислотой, присоединенной к молекуле тРНК в А-участке.Соединение аминокислот в цепи возможно потому, что у каждой из них имеются две разные химические группы: обладающая основными свойствами аминогруппа, NH2, и кислотная карбоксильная группа, СООН. Карбоксильная группа одной аминокислоты может образовать амидную (пептидную) связь с аминогруппой другой аминокислоты.
На третьем этапе новая пептидил-тРНК переносится в Р-участок рибосомы, в то время как рибосома продвигается вдоль молекулы иРНК ровно на три нуклеотида. Таким образом, в результате элементарного элонгационного цикла полипептид удлиняется на одну аминокислоту.
События повторяются до момента, когда в а-центре рибосомы появится кодон-терминатор и(м)рнк (уаа, уаг, уга), для которого нет трнк с комплементарным антикодоном;
Фаза терминации
Завершения синтеза полипептида, связана с узнаванием специфическим рибосомным белком одного из терминирующих кодонов (УАА, УАГ или У ГА), когда тот входит в зону А-участка рибосомы. При этом к последней аминокислоте в пептидной цепи присоединяется вода, и ее карбоксильный конец отделяется от тРНК. В результате завершенная пептидная цепь теряет связь с рибосомой, которая распадается на две субчастицы.
Прокариотическая клетка
Принципиально процесс трансляции у прокариот следует той же схеме, что и у эукариот;
Рибосомы прокариот имеют меньшие размеры – 70s (80s), также как малая – 30s (40s) и большая -50s (60s) субъединицы; в рибосомальных субъединицах прокариот меньше белков – 21 (30) в малой и 34 (45) в большой;
Хотя у прокариот цистороны одного оперона транскрибируются единым болоком, процесс трансляции происходит поцистронно: каждый цистрон имеет отдельный инициирующий кодон (триплет аминокислоты формилметионина) и кодон-терминатор; хотя трансляция у прокариот происходит поцистронно, синтез разных полипептидов оперона регулируется единым образом;
14) Посттрансляционные процессы – приобретение пептидами третичной и четвертичной структур. Адресный транспорт полипептидов, детекция и уничтожение функционально дефектных полипептидов. Регуляция количества образуемых белков.
Последовательность аминокислотных остатков вполипептиде составляет его первичную (линейную,одномерную) структуру, определяемую последовательностьюнуклеотидов в гене непосредственно;.
Функциональная активность белков в клетке и/или организме связана с приобретением третичной (трехмерной,объемной) структуры путем фолдинга (сворачивания), а также собъединением простых белков (полипептидов) в ди-/мультимерные гомо- или гетеробелковые комплексы.
Предположительно фолдинг может происходить
· случайно путем образования объемнойструктуры до момента, когда находится вариант сминимальной свободной энергией; расчеты говорят, что наэто необходимы млн. Лет, в клетке это занимает минуты;
· Модульный принцип требует участия специальных белков – либо ферментов,либо молекулярных шаперонов(Молекулярные шапероны– семейство специализированных белков, обеспечивающихбыстрое нахождение полипептидом правильной трехмерной структуры (фолдинг) и адресную доставку полипептидов в органеллу, например, в митохондрию;
Шапероны участвуют в фолдинге, не определяя трехмерную структуру; это функция аминокислотной последовательности;
Адресная доставка полипептидов
Полипептиды (простые белки) образуются на полисомах в цитоплазме; полисомы - свободные и прикрепленные к мембранам цитоплазматической сети; структура и функции митохондрий обеспечиваются полипептидами, образуемыми на полисомах цитоплазмы под контролем ядерных генов, и в самой органелле под контролем собственных генов;
Полипептиды, транспорт которых связан с канальцами цитоплазматической сети, имеют лидерную последовательность (25±11 аминокислот). Она вместе с полипептидом после идентификации цитоплазматическими “узнающими сигнал” частицами прикрепляется к мембранному рецептору цитоплазматической сети с образованием поры – транслокона. Попав через пору в просвет, полипептид гидролизуется с присоединением олигосахаридов и в транспортных пузырьках переносится в комплекс гольджи;
В комплексе гольджи полипептиды “сортируются” на секретируемые и предназначенные для внутриклеточных структур; первые – разделяются на “порции” или “кванты”, “упаковываются” в оболочку и в пузырьках доставляются к плазмалемме; вторые – метятся в зависимости от органеллы;
Белки, предназначаемые для лизосом, узнаются в комплексе гольджи с образованием метки. Такие помеченные полипептиды фиксируются на рецепторах мембраны комплекса с последующим образованием пузырьков, несущих исключительно лизосомальные ферменты.
Перемещение митохондриальных белков, образующихся под контролем ядерных генов на свободных полисомах цитоплазмы, требует их комплексирования с шаперонами. В комплексе с последними они проникают через 2 мембраны в матрикс органеллы; здесь при участии других шаперонов эти белки приобретают трехмерную конфигурацию. Белки узнаются органеллой благодаря наличию во внешней мембране рецептора, а в полипептиде лидерной аминокислотной последовательности; если полипептид предназначается для межмембранного пространства митохондрии, он имеет 2 лидерных последовательности: одна – транспорт в матрикс, вторая – транспорт через внутреннюю мембрану;