Тема: «Решение экспериментальных задач».
Цель: закрепить знания учащихся о характерных знаниях органических веществ; уметь решать экспериментальные задачи.
Задачи:
Образовательные:
1. Сформировать знания о качественных реакциях на органические вещества.
Развивающие:
1. Формировать умение анализировать, сравнивать, делать выводы на основе полученной информации;
2. Развивать навыки познавательной деятельности, логическое мышление посредством ответов на проблемные и поставленные вопросы;
3. Развивать умения выделять главное, сравнивать.
4. Развить умение обращаться с веществами, химической посудой, лабораторным оборудованием.
Воспитательные:
1. Осуществлять умения высказывать свои взгляды и суждения;
2. Формировать научное мировоззрение;
3. Актуализировать умение работать в коллективе.
Средства обучения:
1. Эмоциональные: интерес;
2. Интеллектуальные: анализ, сравнение, сопоставление.
Методы обучения:
1. Наглядно-образный.
Оборудование: реактивы и химическая посуда.
Тип урока: обобщение и проверка знаний учащихся по данной теме.
План урока:
1) организационный момент
2) актуализация знаний
4) закрепление знаний
5) домашнее задание
Ход урока
1. Организационный момент (приветствие, проверка отсутствующих, подготовка учащихся к работе на уроке.)
Актуализация знаний
Дайте определение качественным реакциям.
Что такое селективность?
Общее закрепление знаний:
Сегодня на уроке мы вспомним все качественные реакции, которые изучали в этом учебном году, научимся решать экспериментальные задачи.
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны. Это означает, что качественные реакции – это реакции с ощутимым эффектом – цвет, запах, изменение состояния вещества.
"Селективность" – означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность – даже очень небольшое количество вещества должно проявляться в такой реакции.
С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества.
Непредельные углеводороды.
1. Обесцвечивание бромной воды при пропускании через неё этилена.
2.Обесцвечивание перманганата калия в водной и кислой среде при пропускании через неё алкена.
3.Окисление алкинов и получение ацетилена.
Кислородосодержащие органические вещества.
1.Взаимодействие одноатомных предельных спиртов с натрием и окисление спиртов.
2. Внутримолекулярная дегидратация одноатомных спиртов - получение алкенов.
3. Многоатомные спирты.
4. Качественные реакции на фенол - взаимодействие с бромной водой и хлоридом железа (III).
5. Окисление альдегидов. Реакции «серебряного и медного зеркала».
6. Распознавания предельных одноосновных карбоновых кислот. Реакции на индикаторы, взаимодействие с карбонатами и хлоридом железа (III).
7. Качественные реакции на муравьиную кислоту. Обесцвечивание перманганата калия в кислой среде и реакция «серебряного зеркала».
8. Распознавание высших непредельных карбоновых кислот и раствора мыла (стеарата натрия) - обесцвечивание бромной воды олеиновой кислотой и выпадение в осадок стеариновой кислоты при действии на мыло минеральной кислоты.
9. Распознавание глюкозы. Реакции с гидроксидом меди (II), реакции «серебряного и медного зеркала».
10. Действие раствора йода на крахмал.
Азотосодержащие органические соединения.
1. Распознавание первичных и вторичных аминов.
2. Обесцвечивание бромной воды анилином.
3. Качественные реакции на аминокислоты.
4. Цветные реакции белков.
Практическая работа №4
Решение экспериментальных задач
Вариант 1
Задача 1. Докажите опытным путём, что в данном растворе содержится белок.
Задача 2. В двух пронумерованных пробирках находится раствор мыла и крахмальный клейстер. Определите опытным путём содержимое каждой пробирки.
Задача 3. Выберите из числа предложенных веществ – Na2SO4, MgCl2, CaCO3 – нужный реактив и, используя его, получите соль уксусной кислоты.
Вариант 2
Задача 1. Докажите опытным путём, что белый хлеб содержит крахмал.
Задача 2. В двух пронумерованных пробирках находится растворы белка и аминоуксусной кислоты. Определите опытным путём содержимое каждой пробирки.
Задача 3. Выберите из числа предложенных веществ – KNO3, CaSO4, K2CO3 – нужный реактив и, используя его, получите соль уксусной кислоты.
Органические кислоты. Дают окрашенные соли тяжелых металлов. Соль органической кислоты с карбонатом металла – выделение углекислого газа.
Белок. Ксантопротеиновая реакция на белки. Ксантопротеиновая реакция проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую. Появление окрашивания свидетельствует о наличии ароматических аминокислот в составе белка.
Биуретовая реакция белков. Наличие белков в растворе можно обнаружить цветными реакциями. Наиболее универсальной качественной реакцией на белки является биуретовая реакция. Эта реакция характерна для групп атомов, образующих пептидную связь. К раствору белка приливаем немного раствора щелочи и несколько капель слабого раствора сульфата меди. Жидкость окрашивается в фиолетовый цвет, что указывает на присутствие белка в растворе.
Крахмал. Действие раствора йода на крахмал. Образуется соединение тёмно-фиолетового цвета.
Расчетные задачи на установление структуры вещества
Цель: Научить школьников решать расчетные задачи на установление строения вещества.
•Задание 1. Установите строение углеводорода, при сгорании одного объема которого образуется шесть объемов углекислого газа, а при хлорировании на свету – только два монохлорпроизводных.
Решение:

Собственно подсказок для решения задачи две: это выделение шести объемов СО2 (значит, в молекуле 6 атомов углерода) и то, что хлорирование идет на свету (значит, это алкан).
Формула углеводорода – С6Н14.
Устанавливаем структуру. Поскольку у этого углеводорода всего два монохлорпроизводных, значит, его углеродная цепь следующая:

Это – 2,3-диметилбутан. Каркасы хлоруглеводородов следующие:

• Задание 2. Для сжигания порции алкана, содержащей 1•1023 молекул, требуется порция кислорода, содержащая 1,6•1024 атомов. Установите состав и возможное строение (все изомеры) алкана.
Решение
При разборе решения надо обратить внимание на расстановку коэффициентов в общем виде (через n), т.к. без этого задачу не решить:
СnH2n+2 + (1,5n + 0,5)O2 = nCO2 + (n + 1)H2O.
(алкана) = 1•1023/(6,02•1023) = 0,166 моль,
(O2) = 1,6•1024/(6,02•1023•2) = 1,33 моль.
Составим пропорцию:
1 моль алкана – 1,5n + 0,5 кислорода,
0,166 моль алкана – 1,33 моль кислорода.
Отсюда n = 5.
Это – пентан C5H12, для него возможны три изомера:
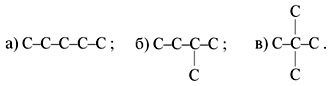
• Задание 3. Смесь алкана и кислорода, объемное соотношение которых соответствует стехиометрическому, после сгорания, конденсации паров и приведения к исходным условиям сократилась по объему вдвое. Установите строение алкана, входившего в состав смеси.
Решение:
При разборе решения надо обратить внимание на расстановку коэффициентов в общем виде через n, т.к. без этого задачу не решить:
СnH2n+2 + (1,5n + 0,5)O2 = nCO2 + (n + 1)H2O.
До реакции общий объем газов был: (1 + 1,5n + 0,5) л.
После реакции учитываем только объем СО2 – n л (вода H2O при 20 °С – жидкость).
Составляем уравнение: 1 + 1,5n + 0,5 = 2n.
Отсюда n = 3.
Ответ. Пропан C3H8.
• Задание 4. Смесь алкана и кислорода, объемное соотношение которых соответствует стехиометрическому, после сгорания, конденсации паров воды и приведения к н.у. cократилась по объему в 1,8 раза. Установите формулу алкана, входившего в состав смеси, если известно, что в его молекуле четыре первичных атома углерода.
Ответ. Неопентан (СН3)3ССН3.
• Задание 5. При пропускании смеси цис- и трансизомеров алкена через избыток раствора перманганата калия масса выпавшего осадка оказалась больше массы исходного алкена. Установите строение алкена.
Решение
Напишем уравнение реакции алкена с раствором перманганата калия:
3СnH2n + 2KMnO4 + 4H2O = 3СnH2n(OH)2 + 2MnO2 + 2KOH.
Пусть в реакцию вступил 1 моль алкена, тогда выделилось 0,6667 моль оксида марганца(IV).
Mr(MnO2) = 87, m(MnO2) = 87•0,6667 = 58 г.
Следовательно, учитывая условие задачи, относительная молекулярная масса алкена меньше 58. Этому условию отвечают алкены С2Н4, С3Н6, С4Н8.
По условию задачи алкен имеет цис- и трансизомеры. Тогда точно не подходят этен и пропен. Остается бутен-2: только он имеет цис- и трансизомеры.
Ответ. Бутен-2.
• Задание 6. При нитровании одного из гомологов бензола массой 31,8 г было получено только одно мононитропроизводное массой 45,3 г. Установите строение исходного вещества продукта реакции.
Решение
По условию задачи (С6Н5R) = (С6Н4RNO2). Используя формулу = m/M, получим:
31,8/(77 + R) = 45,3/(77 – 1 + 46 + R).
Отсюда R = 29.
Поскольку R = СnH2n+1, верно соотношение:
12n + 2n + 1 = 29.
Поэтому n = 2, радикал R – это С2Н5.
Однако по условию задачи получается только одно нитропроизводное. Следовательно, исходное вещество не может быть этилбензолом, т. к. тогда образовались бы орто- и паранитропроизводные. Значит, гомолог бензола содержит не радикал этил, а два метильных радикала. Расположены они симметрично (пара-ксилол). При таком расположении заместителей получается только одно нитропроизводное.
Уравнение реакции:

• Задание 7. При нагревании смеси двух предельных первичных спиртов с разветвленным скелетом в присутствии серной кислоты получена смесь трех органических веществ, относящихся к одному классу соединений. Вещества получены в равных молярных соотношениях общей массой 21,6 г, при этом выделилась вода массой 2,7 г. Установите все возможные формулы исходных соединений и рассчитайте массу исходной смеси.
Решение
Анализируем условие задачи для написания уравнения. В присутствии серной кислоты возможна либо внутримолекулярная, либо межмолекулярная дегидратация или их комбинация. Если дегидратация внутримолекулярная, то получается всего два непредельных углеводорода, если межмолекулярная, то получается смесь трех эфиров. Комбинированный вариант рассматривать не имеет смысла, т.к. по условию получаются вещества одного класса. Уравнение реакции:

Рассчитаем количество вещества воды:
(H2O) = m/M = 2,7/18 = 0,15 моль.
Поскольку продукты реакции получены в равных молярных соотношениях, значит, каждого эфира получилось по: 0,15/3 = 0,05 моль.
Составляем уравнение материального баланса:
0,05 • (М(R) + (М(R') + 16) + 0,05 • (2М(R) + 16) + 0,05 • (2М(R') + 16) = 21,6
Отсюда (M(R) + M(R') = 128. Оба радикала R и R' – предельные, поэтому их суммарную молярную массу можно записать так:
M(СnH2n+1) = 128.
Подставляя значения атомных масс, находим:
12n + 2n + 1 = 128, n = 9.
Молекулы двух спиртов содержат 9 атомов углерода.
По условию задачи спирты первичные и имеют разветвленный углеродный скелет. Значит, один спирт содержит 4 атома углерода, а другой – 5.
Варианты формул:

масса исходной смеси: 21,6 + 2,7 = 24,3 г.
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях – белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив.
Качественный анализ веществ - важная тема при изучении органической химии. Знание её помогает в работе не только химикам, но и медикам, экологам, биологам, эпидемиологам, фармацевтам, работникам пищевой промышленности. Надеюсь, что эти знания помогут вам и в повседневной жизни.
Рефлексия. Подведение итогов урока:
1. Что вам показалось наиболее интересным?
2. Что больше всего запомнилось?
3. Что вызвало затруднение?
4. Что удивило?
· Выставление оценок
Домашнее задание:
1. Повторить параграф 45.
2. Прочитать параграф 46.
3. Повторить конспект урока.
Спасибо за работу! Урок окончен. До свидания.