Растворение как физико-химический процесс. Растворимость. Типы растворов
Растворы играют огромную роль в природе, науке и технике. Природная вода также являются раствором, ведь в ней содержатся растворенные вещества. В пресной воде солей мало, а в морской их содержится около 3,5 %. В первичном океане, из которого зародилась жизнь на Земле, содержание солей составляло около 1%. Как писал американский химик Лайнус Полинг: «Именно в этом растворе впервые развились живые организмы, и из этого раствора они получили ионы и молекулы, необходимые для их роста и жизни… С течением времени живые организмы изменялись и развивались, что позволило им покинуть водную среду и перейти на сушу и затем подняться в воздух. Они приобрели эту способность, сохранив в своих организмах водный раствор в виде жидкостей, содержащий необходимый запас ионов и молекул».
В каждой нашей клеточке напоминание о зарождении жизни. По нашим сосудам: артериям, венам и капиллярам тоже течет раствор, где содержание солей около 0,9%. Плазма крови, желудочный сок тоже являются растворами. Все физико-химические процессы, происходящие в живых организмах, протекают тоже в растворах. Природные водные растворы участвуют в почвообразовании и снабжают растения питательными веществами. Многие технологические процессы также протекают в растворах (получение бумаги, красок, металлов, удобрений, продуктов питания).
Растворы в организме человека
Растворы в промышленности

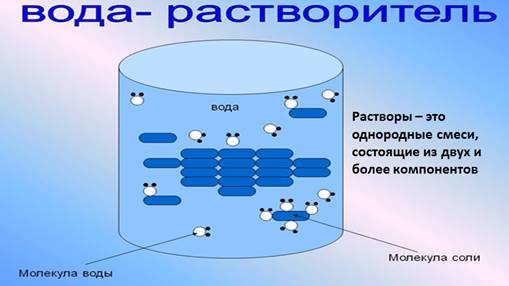
Растворы – это однородные смеси, состоящие из двух и более компонентов.
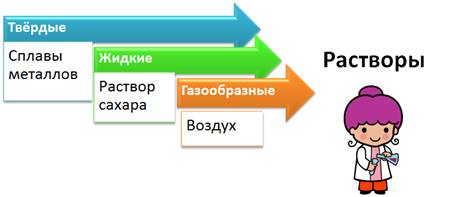
По агрегатному состоянию растворы делят на: твердые (например, сплавы металлов), жидкие (раствор сахара), газообразные (смесь газов – воздух). Наиболее распространены жидкие растворы.
Растворы состоят из растворителя и растворенного вещества (твердого, жидкого или газообразного). Растворителем может быть вода, тогда раствор является водным, а также бензин, эфир, спирт.

Как происходит растворение веществ?
Сторонники физической теории растворов, как Вант-Гофф, Аррениус, Оствальд, считали, что процесс растворения является результатом диффузии, т.е. проникновения молекул растворенного вещества между молекулами воды.
Сторонники химической теории растворов, одним из которых был Д. И. Менделеев, считали, что растворение является химическим взаимодействием растворенного вещества и воды.
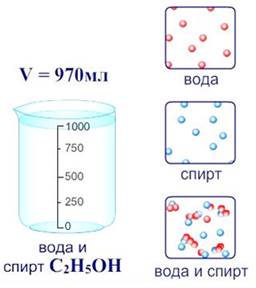
В настоящее время принята физико-химическая теория растворов, которую ещё в 1906 г. предсказывал Д. И. Менделеев. Поэтому растворение является физико-химическим процессом.
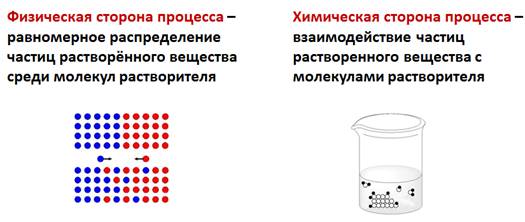
Физическая сторона процесса заключается в разрушении кристаллической решетки вещества и равномерном распределении, по принципу диффузии, частиц растворенного вещества среди молекул растворителя. Химическая сторона процесса проявляется во взаимодействии частиц растворенного вещества с молекулами растворителя.
В результате взаимодействия растворенного вещества и воды образуются гидраты. Растворение сопровождается тепловыми эффектами: при растворении серной кислоты воду добавляют к кислоте, из-за сильного разогревания раствора, т.е. теплота выделяется, а при растворении нитрата аммония, хлорида натрия, теплота, наоборот, поглощается.
Кроме гидратов есть еще кристаллогидраты, т.е. это кристаллические вещества, содержащие молекулы воды. Вода, входящая в их состав – кристаллизационная. Примером кристаллогидратов служит медный купорос – CuSO4 · 5H2O. Медный купорос является веществом голубого цвета, а безводный сульфат меди (II) – белый, при растворении в воде, раствор становится голубого цвета.

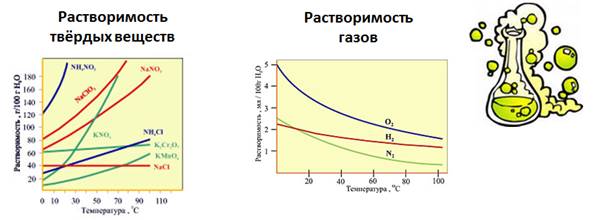
Растворимость веществ в воде зависит от температуры. Растворимость в воде твердых веществ при повышении температуры увеличивается, а газов, наоборот, уменьшается.
Если растворить в воде хлорид калия, то при комнатной температуре может раствориться только 34,4 г в 100 г воды. Если добавить больше соли, то, сколько бы мы не перемешивали, соль не раствориться в воде, т.е. этот раствор уже насыщенный. Раствор, в котором при данной температуре вещество больше не растворяется, является насыщенным. Если растворить не 34,4 г соли, а меньше, то раствор будет ненасыщенным. Т.е. раствор, в котором при данной температуре вещество ещё может раствориться, называют ненасыщенным.
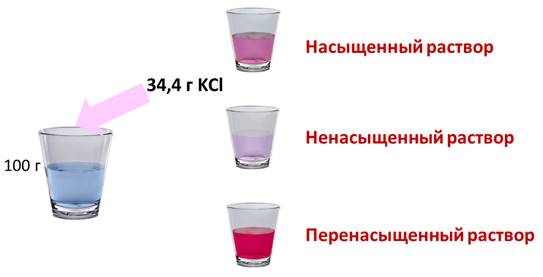
При охлаждении насыщенного раствора возникает избыток растворенного вещества, если оно не выпадает в осадок, то образуется перенасыщенный раствор. Перенасыщенным называют такой раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, чем в его насыщенном растворе при тех же условиях.
Перенасыщенный раствор можно легко приготовить. Для этого нужно приготовить насыщенный раствор соли при высокой температуре, затем избыток соли отфильтровать, накрыть сосуд и охладить при комнатной температуре. Этот раствор может храниться довольно долго, но если в него внести стеклянную палочку, на которой будет несколько крупинок этой соли, то начнется ее кристаллизация из раствора. В мертвом море концентрация соли так велика, что помещенные сюда предметы, начинают покрываться кристаллами.

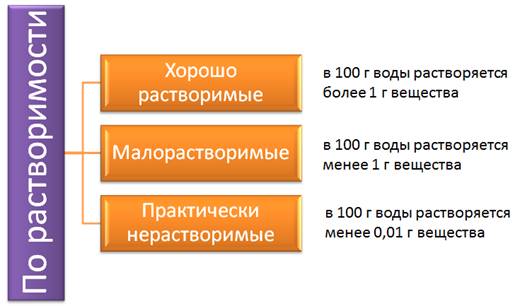
По растворимости вещества делятся на хорошо растворимые, если при комнатной температуре в 100 г воды растворяется более 1 г вещества, если меньше 1 г вещества, то такие вещества являются малорастворимыми, и если вещества растворяется меньше 0,01 г на 100 г воды, то такие вещества относятся к практически нерастворимым. Совершенно нерастворимых веществ нет. Даже атомы серебра чуть-чуть переходят в раствор из изделий, помещенных в воду.