Классификация химических реакций
1. По изменению числа частиц в ходе реакции выделяют реакции замещения, присоединения, отщепления, разложения.
Реакции замещения
Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку):
АВ + С→ АС + В
Реакции этого типа можно рассматривать как реакции обмена, но в органической химии предпочтительней термин "замещение", поскольку в обмене участвует (замещается) лишь меньшая часть органической молекулы.
Примеры:
C2H6 + Cl2 (на свету)→CH3CH2Cl + HCl хлорирование этана
CH3CH2Cl + KOH (водн. р-р) → CH3CH2OH + KCl щелочной гидролиз хлорэтана
Реакции присоединения
В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются:
А + В→С
Примеры:
CH2=CH-CH3 + Br2 →CH2Br-CHBr-CH3 бромирование пропена
CH2=CH2 + H2O→CH3CH2OH гидратация этилена
К реакциям присоединения относятся также реакции полимеризации: n A → An
Например, образование полиэтилена: n CH2=CH2→(-CH2-CH2-) n
Реакции отщепления
В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета.
А→ В + С
Например:
· отщепление хлороводорода ( при действии на хлоралкан спиртовым раствором щёлочи )
CH3-CH2Cl →CH2=CH2 + HCl
· отщепление воды (при нагревании спирта с серной кислотой)
CH3-CH2OH→CH2=CH2 + H2O дегидратация этанола
· отщепление водорода от алкана (в присутствии катализатора)
CH3-CH3 →CH2=CH2 + H2 дегидрирование этана
Реакции разложения
В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ:
А→ В + С +...
К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов:
CnH2n+2→ CmH2m+2 + CpH2p (n = m + p)
Например
C10H22→ C5H12 + C5H10
Реакции разложения при высокой температуре называют пиролизом, например:
СН4 → C + 2H2 пиролиз метана (1000 oC)
Реакции изомеризации или перегруппировки
В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава:
А→В
В этом случае исходное вещество и продукт реакции являются изомерами (структурными или пространственными).
Например, в результате перегруппировки может изменяться углеродный скелет молекулы:

2.По электронной природе реагентов различают нуклеофильные, электрофильные, свободнорадикальные реакции.
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются на радикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, на электрофильные и нуклеофильные.
Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования.
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:

В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
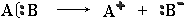
В результате образуются разноименно заряженные ионы – катион и анион. Если заряд иона сосредоточен на атоме углерода, то катион называют карбокатионом, а анион - карбанионом.
Электрофильные реакции
Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.
Электрофильные ("любящие электроны") реагенты или электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне.
Примеры электрофильных частиц: H+, CH3+ и другие карбокатионы, NO2+, ZnCl2, AlCl3. Электрофильное присоединение:
CH2=CH2 + HCl → CH3CH2Cl (электрофил – H+ в составе HCl)
Стадии:
I. CH2=CH2 + Hδ+-Clδ→ CH3CH2+ + Cl- (медленная)
II. CH3CH2+ + Cl- → CH3CH2Cl (быстрая)
Механизм электрофильного присоединения обозначается символом AdE (по первым буквам английских терминов: Ad – addition [присоединение], E – electrophile [электрофил]).
Электрофильное замещение: C6H6 + NO2+→ C6H5NO2 + H+ (электрофил - NO2+)
Катион NO2+ образуется в смеси конц. кислот HNO3 и H2SO4.
Обозначение механизма – SE (S – substitution [замещение]).
Нуклеофильные реакции
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
Нуклеофильные ("любящие ядро") реагенты, или нуклеофилы - это частицы (анионы или молекулы), имеющие неподеленную пару электронов на внешнем электронном уровне. Примеры нуклеофильных частиц:
OH-, Cl-, Br-, CN-, H2O, CH3OH, NH3.
Строение некоторых нуклеофильных реагентов
 | |||
 | |||
Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:
CH2=CH2, CH2=CH–CH=CH2, C6H6 и т.п.
(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
Примеры нуклеофильных реакций
Нуклеофильное замещение:

Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Нуклеофильное присоединение:
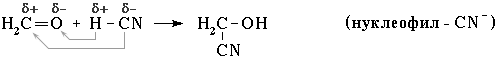
Обозначение механизма – AdN (Ad – addition [присоединение]).
3. По изменению степени окисления элементов – окислительно-восстановительные.
Окислительно-восстановительные реакции - реакции, в ходе которых меняется степень окисления атомов, входящих в молекулу. Для органических реакций этого типа применимы те же законы, что и для неорганических. Отличием является то, что в органической химии окислительно-восстановительные процессы рассматриваются прежде всего по отношению к органическому веществу и связываются с изменением степени окисления углерода, являющегося реакционным центром молекулы. Эти реакции могут проходить по типу реакций присоединения, отщепления, замещения и т.п.
Если атом углерода в органической молекуле окисляется (отдает электроны более электроотрицательному атому), то этот процесс относят к реакциям окисления, т.к. продукт восстановления окислителя (обычно неорганическое вещество) не является конечной целью данной реакции. И наоборот, реакцией восстановления считают процесс восстановления атома углерода в органическом веществе.
Часто в органической химии ограничиваются рассмотрением реакций окисления и восстановления как реакций, связанных с потерей и приобретением атомов водорода и кислорода.
Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель обозначают символом [O]:

Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают символом [H]:

Степень окисления углерода в его соединениях изменяется в диапазоне от -4 (например, в метане CH4) до +4 (в CO2). В органических соединениях атомы углерода в одной и той же молекуле могут иметь разные степени окисления:
-3CH3--1CH2-OH
4. По типу активации различают каталитические и некаталитические реакции.