ВВЕДЕНИЕ
Современное развитие промышленности, городского хозяйства предъявляют высокие требования к сооружениям по забору, транспортировке и очистке природных вод.
Очистные сооружения являются одним из основных элементов системы водоснабжения и тесно связаны с остальными ее элементами.
Повышение качества жизни населения связано с необходимостью использования чистых вод и последующего сброса в водные объекты очищенных до соответствующего качества сточных вод.
Антропогенное воздействие на водные объекты настолько высоко, что механизм самоочищения водоемов становится малоэффективным, большое количество водотоков относится к загрязненным и чрезвычайно загрязненным.
Задача настоящего курсового проекта заключается в разработке технологии очистки природной воды.
Состав мероприятий очистных сооружений должен обеспечивать необходимого количества воды питьевого качества и быть наиболее надежными и экономичными в работе при минимальных затратах на их строительство и эксплуатацию.
Технология очистки воды от цветности и мутности
Расчет дозы и массы реагента
Dи=28( + Жк +
+ Жк +  ±
±  + 1),
+ 1),
где [CO2] – концентрация ионов CO2, мг/л
[Mg] – концентрация ионов Mg, мг/л
Dк – доза коагулянта, мг/л
eк – эквивалентная масса коагулянта
eк= 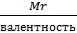
Жк – карбонатная жесткость, мг-экв/л
В качестве коагулянта взяли FeCl3
Молярная масса вещества:
Mr(FeCl3)= 56+3*35.5=161 а.е.м.
eк= 
По [1] определим дозу коагулянта:
По цветности:
Dк=4 
Dк=4  =31 мг/л
=31 мг/л
По п 6.16 [1] принимаем М=40 мг/л
По мутности:
Mr(Ca)= 40 мг/л;
Mr(CaCO3)= 40+12+3*16=100 мг/л;
[Ca]: 40 – 200 мг/л
[CaCO3]: 100 – Х,
Х=  =500 мг/л;
=500 мг/л;
Dк=40+50=90 мг/л.
Определим концентрацию [CO2]
Mr(CO2)= 12+16*2=44 а.е.м.;
Mr(HCO3)= 1+12+16*3=61 а.е.м.;
[CO2]: 44 - Х
[HCO3]: 61 – 200 мг/л,
Х= 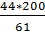 =144 мг/л;
=144 мг/л;
Жк = 5 мг-экв/л;
Жнк=10 мг-экв/л;
[Ca]=200 мг/л=  =10 мг-экв/л;
=10 мг-экв/л;
ΔЖ=15-10=5 мг-экв/л;
[Mg]=5*12=60 мг/л.
Dи=28( + 5 +
+ 5 +  ±
±  + 1)=538,35 мг/л
+ 1)=538,35 мг/л
Так как производительность ОС 1000 м3/сут,
то mр-ра=538,35*106=538,35кг/сут.
Расчет количества осадка
1) Взвешенные вещества: 300-1,5=298,5 мг/л;
2) Осадок от коагулянта: FeCl3 + 3H2O=Fe(OH)3+HCl
Mr(Fe)= 56 а.е.м.;
Mr(Fe(OH)3)= 56+3*(16+1)=107 а.е.м.;
[Fe]: 56 – 90 мг/л
[Fe(OH)3]: 107 – Х,
Х=  =171,96 мг/л;
=171,96 мг/л;
3) Осадок от умягчения:
Ca(HCO3)2 + 2NaOH = CaCO3 + Na2CO3 + 2H2O
Mr(NaOH)= 23+16+1=40 а.е.м.;
Mr(CaCO3)= 40+12+3*16=100 а.е.м.;
[NaOH]: 40 – 538,35 мг/л
[CaCO3]: 100 – Х,
Х=  =1345,88 мг/л;
=1345,88 мг/л;
 =672,94мг/л;
=672,94мг/л;
Мобщ.осадка=298,5+171,96 +672,94=1143,98 мг/л.
Расчет оборудования
В качестве оборудования для очистки воды от цветности и мутности, умягчения выбран отстойник.
Технология умягчения воды
Расчет дозы и массы реагента
см. п. 2.1
Расчет осадка
см. п. 2.1
Расчет оборудования
см. п. 2.1
Технология обезжелезивания
Расчет потребления воздуха
Расчетные дозы реагентов-окислителей надлежит принимать: хлора Дх, мг/л (из п.6.181 [1])
Дх = 0,7(Fе 2+);
Fe2+ - 5 мг/л (дано)
Дх = 0,7(Fе 2+) = 0,7*5 = 3,5 мг/л;
Fe(HCO3)2+H2O=Fe(OH)2+H2CO3
Fe(OH)2+2H2O+O2=4Fe(OH)3
Mr(Fe)=56 а.е.м.;
Mr(Fe(OH)3)=56+3*(16+1)=107 а.е.м.;
[Fe]: 56 – 5 мг/л
[Fe(OH)3]: 107 – Х,
Х=  =9,6 мг/л;
=9,6 мг/л;
На 1 мг Fe2+ потребуется 0,143 мг - O2 , тогда 5*0,143=0,715 мг/л;
16% - 0,715
100% - Х
Х= 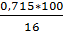 =4,468 мг/л;
=4,468 мг/л;
Расчет осадка
ПДК(Fe)=0,3 мг/л, тогда MFe=5-0,3=4,7 мг/л;
[Fe]: 56 – 4,7 мг/л
[Fe(OH)3]: 107 – Х,
Х=  =8,98 мг/л;
=8,98 мг/л;
ПДК (Mn)=0,1 мг/л, тогда MMn=1-0,1=0,9 мг/л;
Mr(Mn (OH)3)=55+3*(16+1)=106 а.е.м.;
[Mn]: 56 –0,9 мг/л
[Mn (OH)3]: 106 – Х,
Х=  =1.73 мг/л;
=1.73 мг/л;
Расчет оборудования
 =
=  , м2
, м2
где S - площадь фильтра, м2
Q – производительность ОС, 1000 м3/сут
V – скорость фильтрации, м/ч
 =
=  =7, м2
=7, м2
Выбираем 2 фильтра r=1,5 м, hзагрузки=1,5 м.
hфильтра=2 м,
Mзагрузки= 
где V – объём, м3
 – насыпная плотность, т/м3
– насыпная плотность, т/м3
V=1,52*3,14*2=14.13 м3;
Mзагрузки=  =24,02 т
=24,02 т
В первом фильтре воду очищают от железа, а во втором от марганца.
Технология деманганации
Расчет дозы и массы реагента
Принимается модифицированная загрузка для второго фильтра при процессе обезжелезивания. Модифицированная загрузка заключается в том, что фильтр наполняют раствором 1% KMnO4 + 1% FeCl3
Расчет осадка
см. п. 4.2
Расчет оборудования
см. п. 4.2
6 Технология обескремнивания