МПО представляет собой гемсодержащий белок с четвертичной структурой типа α2β2 и состоит из двух протомеров (αβ), включающих большую (57-59 кДа) и малую (10.5-13.5 кДа) субъединицы. Протомеры соединены одной дисульфидной связью в области больших субъединиц, каждая из которых содержит по одной геминовой группировке и небольшому углеводному компоненту. Молекулярная масса белка составляет около 150 кДа, изоэлектрическая точка его находится в области высоких значений рН (ИЭТ>10). Спектр поглощения МПО, в отличие от других геминовых пероксидаз, характеризуется резким сдвигом полосы Соре в более длинноволновую область спектра (430 нм). В настоящее время для МПО человека полностью расшифрована первичная структура, выяснены основные этапы процессинга этого белка и установлена локализация гена, кодирующего этот фермент. Определена и пространственная организация МПО. В нейтрофилах имеется три (реже более) изоформ миелопероксидазы, незначительно отличающихся своей активностью в отношении ряда субстратов-восстановителей, молекулярной массой, а также электрофоретической подвижностью (все эти изоформы кодируются в геноме одним и тем же геном).
МПО локализуется в азурофильных гранулах нейтрофила и по содержанию составляет около 5% от сухого веса клетки (для лейкоцитов человека). В количественном выражении это соответствует 22 млн. молекул этого фермента на клетку. Уже одно это обстоятельство предполагает первостепенное значение МПО для реализации нейтрофилами их защитной функции. В значительно меньших количествах МПО представлена в моноцитах – другом типе фагоцитирующих лейкоцитов крови, теряющим этот фермент в результате их дифференцировки в тканевые макрофаги.
Основная функция МПО в качестве микробицидного фактора осуществляется в фаголизосоме нейтрофила вслед за слиянием МПО-содержащих гранул с фагосомами, заключающими внутри себя объект фагоцитоза – поглощенные микробы. Однако, благодаря способности нейтрофилов секретировать содержимое их гранул в околоклеточное пространство, МПО может использоваться и для упреждающего поражения патогена. Этот же механизм является одной из основных причин повреждения собственных тканей в очаге воспаления.
Мощные разрушительные свойства МПО полностью базируются на ее физико-химических характеристиках, в частности, на высокой окислительной способности активных интермедиатов фермента (Е0>+1.0В) и особенностях пероксидазного катализа, а также на способности МПО кооперировать с другими деструктивными и поражающими объект фагоцитоза факторами.
Аналогично другим пероксидазам МПО катализирует следующую реакцию:
RН2 + Н2О2 ® R· + 2Н2О,
где RН2 - субстрат-восстановитель, в качестве которого для геминовых пероксидаз могут выступать соединения различной химической природы.
Высокие значения редокс-потенциалов активных интермедиатов геминовых пероксидаз (Е0³1.0В) связаны с участием этой группы ферментов в окислении наиболее устойчивых структур. Механизм пероксидазной реакции впервые был предложен Б.Чансом и полностью подтвержден экспериментальными данными:
Е + Н2О2 «Соединение I (1)
Соединение I + RН2 ® Соединение II + НR· (2)
Соединение II + RH2 ® E + HR· (3)
2HR· ® R·+ RH2 (или НR-RН) (4),
где Е - исходная ферри-форма фермента; Соединения I и II - его промежуточные редокс-формы. Причем, Соединение I обладает двумя окислительными эквивалентами, а Соединение II - одним по сравнению с исходной формой Е. НR· - первичный свободнорадикальный продукт катализа. В Соединении I эти окислительные эквиваленты представлены в виде π-катионового радикала порфирина и оксоферрильной группировки FeIV=O, в Соединении II - только в виде FeIV=O.
В том случае, когда свободнорадикальные продукты субстратов (например, индолуксусная кислота и др.) или сами субстраты обладают достаточно высокими электронодонорными свойствами для восстановления молекулярного кислорода до О2-· и/или исходной ферри-формы фермента в ферро-форму, пероксидазный катализ трансформируется в пероксидазно-оксидазный. Выбор между двумя маршрутами (или их совместном осуществлении) в реализации этого типа реакций определяется и значением редокс-потенциала окислительно-восстановительной пары: ферри-/ферро-форм пероксидаз (0.5В или 0.02В). Вследствие этого в реакционной среде возникают еще две редокс-формы фермента, что связано с тем, что ферро-форма фермента, аналогично гемоглобину, способна связывать молекулярный кислород, а О2-· - ассоциироваться с исходной ферри-формой, что ведет к формированию и в первом, и во втором случае окси-формы пероксидазы (аналог оксигемоглобина).
Участие всех редокс-форм пероксидазы в каталитическом оксидазно-пероксидазном процессе можно представить в виде пентагональной схемы:
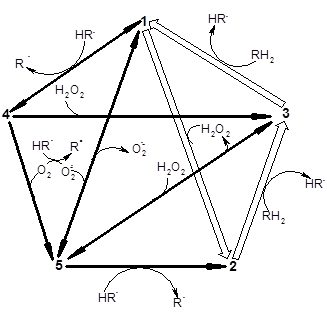
где 1-5 - редокс-состояния фермента, 1- его исходная ферри-форма (FeIII), 2 - Соединение I (феррильная форма: FeIV=O и π-катионовый радикал порфирина), 3 - Соединение II (феррильная форма), 4 - ферро-форма фермента (FeII) - акцептор молекулярного кислорода, 5 - окси-форма фермента (резонансная структура: FeIIO2  FeIIIO2-·). Cтрелками указаны пути конверсии редокс-форм пероксидазы. Жирными стрелками показан маршрут осуществления пероксидазного катализа.
FeIIIO2-·). Cтрелками указаны пути конверсии редокс-форм пероксидазы. Жирными стрелками показан маршрут осуществления пероксидазного катализа.
Скоростьлимитирующей стадией в пероксидазном катализе (механизм Чанса) является регенерация исходной формы фермента (реакция (3)). Значение константы k 1 составляет величину порядка (1.2-1.8)×107М-1с-1. Так как величина константы k -1<0.2с-1, то реакцию (1) можно рассматривать как практически необратимую. Энергия ее активации составляет около 14.6 кДж/моль. Величины констант скоростей реакций (2) и (3) для различных геминовых пероксидаз в зависимости от природы субстратов-восстановителей колеблются в пределах: k2 - от 2.3×108М-1с-1 до 5×104М-1с-1, k3 - от 5.0×107М-1с-1 до 2.5×103М-1с-1.
Как правило, для различных геминовых пероксидаз реакционная способность Соединения I в отношении конкретного субстрата превышает таковую для Соединения II в 50 - 100 раз. Тем не менее редокс-потенциалы одноэлектронного восстановления этих форм близки и составляют около +1.0В. Существование корреляции между редокс-потенциалами субстратов-восстановителей и значениями k2 показывает, что для Соединения I величина k2 определяется только относительной легкостью окисления субстрата. Верхние пределы значений констант k2 и k3 близки (аналогично k1) константам скоростей реакций, ограниченных лишь диффузионным пределом, что свидетельствует о транзиторном характере протекания реакций (1), (2) и (3) без заметного образования фермент-субстратного комплекса.
Однако, для ряда доноров электронов (п-крезол и др.) спектрально зарегистрировано комплексообразование с Соединениями I и II. Тем не менее, и для таких субстратов описание поведения пероксидаз строго в терминах кинетики Михаэлиса не правомочно. Во-первых, невозможно достичь насыщающих концентраций второго субстрата (Н2О2) из-за образования нового редокс-состояния фермента - Соединения III (оксиформа), обладающего низкой активностью и инактивируемого при дальнейшем увеличении концентрации Н2О2. Во-вторых, различные редокс-формы фермента способны взаимодействовать друг с другом, что противоречит основному требованию кинетической модели Михаэлиса - независимому функционированию молекул фермента в ходе катализа:
Е + Соединение I ® 2 Соединение II (5)
Соединение II + Соединение III ® 2 Е + О2 (6)
Соединение I + СоединениеIII ® Е + Соединение II + О2 (7)
В-третьих, происходит разложение Соединения III с переходом фермента в другое редокс-состояние - Соединение II:
Соединение III ® Соединение II + H2O2 (k =2×10-3c-1) (8)
Механизм Чанса, предложенный для пероксидаз, справедлив и для МПО. Отличительной особенностью этого фермента от других геминовых пероксидаз, наряду с его субъединичной организацией, является способность МПО эффективно окислять ионы Cl- (по двухэлектронному механизму) с образованием гипохлорита:
Соединение I + Cl- ® МПО + ОСl- k =3.1×107M-1c-1 (106)
Причем, Соединение II такими свойствами не обладает из-за невозможности осуществления двухэлектронного переноса и недостаточно высокого редокс-потенциала для одноэлектронного окисления Cl- (E0 для пары Cl/Cl- составляет +1.36В).
Благодаря тому обстоятельству, что исходным субстратом для образования гипохлорита является молекулярный кислород (в результате сложной цепи его превращений с участием NADPH-оксидазы и МПО), продуцируемый нейтрофилами OCl- принято включать в состав АМК.