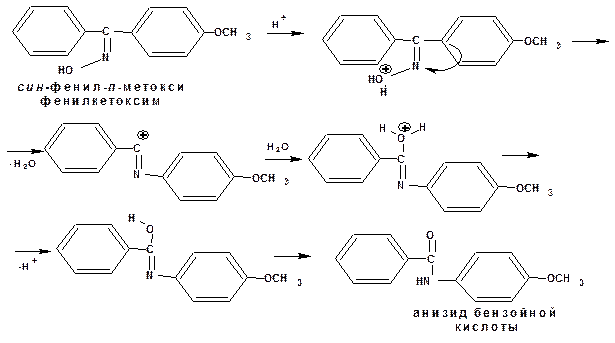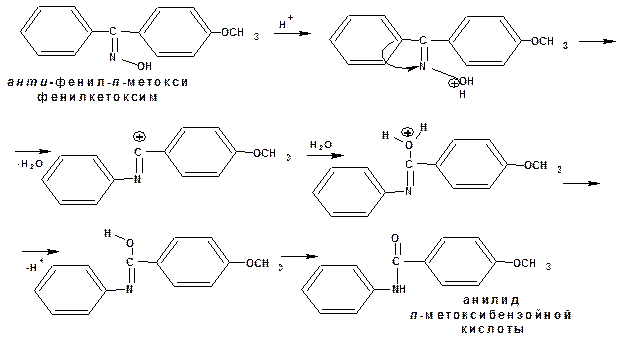Алифатические и ароматические альдегиды получают восстановлением хлорангидридов карбоновых кислот:
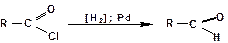
Для предотвращения восстановления карбонильной группы катализатор отравляют соединениями серы.
Окисление метиларенов
В лабораториях ароматические альдегиды получают окислением метиларенов триоксидом хрома в присутствии уксусного ангидрида
:
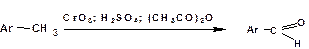
В промышленности бензальдегид получают окислением толуола над пентаоксидом ванадия:
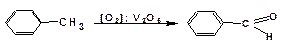
Реакция Гаттермана-Коха
При действии на толуол смеси окиси углерода и хлористого водорода в присутствии катализатора, в качестве которого используют смесь хлористого алюминия и однохлористой меди, получается п -толуиловый альдегид:
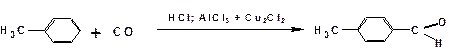
Реакция Вильсмаейера
При действии диметилформамида (ДМФА) на анизол в присутствии хлорокиси фосфора образуется анисовый альдегид:
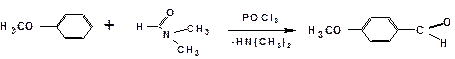
Физические свойства
Муравьиный альдегид является газом с сильным резким запахом. Другие низшие альдегиды и кетоны являются жидкостями, легко растворимыми в воде. Низшие альдегиды обладают удушливым запахом. Запах кетонов более приятный. При одном и том же строении углеродной цепи кетоны кипят при более высокой температуре, чем альдегиды. Альдегиды и кетоны кипят при температурах более низких, чем спирты, что свидетельствует об отсутствии ассоциатов. Но температуры кипения карбонильных соединений выше, чем температуры кипения углеводородов, что свидетельствует о наличии межмолекулярных взаимодействий между молекулами карбонильных соединений в жидкой фазе. Причиной взаимодействий может быть полярность молекул карбонильных соединений.
4. Химические свойства
Карбонильная группа построена из атомов углерода и кислорода, находящихся в состоянии sp2-гибридизации и соединенных друг с другом двойной связью. Наличие двойной связи предполагает склонность карбонильных соединений к реакциям присоединения. Причем наличие электроотрицательного атома кислорода в ненасыщенной системе делает двойную связь электрофильной, а, следовательно, для такой связи будут характерны реакции нуклеофильного присоединения.
Кроме того, повышенная электроотрицательность карбонильной группы, по отношению к атомам углерода, находящимся в состоянии sp3-гибридизации является причиной С-Н кислотных свойств карбонильных соединений, что в свою очередь обуславливает способность карбонильных соединений в реакциям с участием углеродного атома, находящегося в α положении по отношению к карбонильной группе.
Реакции присоединения
4.1.1. Гидрирование
Присоединение водорода к карбонильным соединениям происходит в присутствии катализаторов гидрирования (Ni, Co, Cu, Pt, Pd и др.), а также литийалюминий гидридом. При этом альдегиды образуют первичные спирты, а кетоны – вторичные.
4.1.2. Присоединение гидросульфита натрия
В водном растворе по реакции едкого натра с сернистым ангидридом может быть приготовлен гидросульфит натрия, который легко взаимодействует с карбонильными соединениями с образованием кристаллических осадков α-гидроксиалкилсульфонатов:
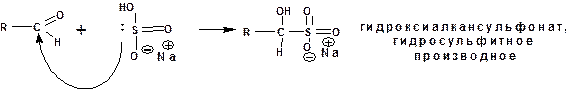
4.1.3. Присоединение синильной кислоты
Присоединение синильной кислоты ведет к образованию α-оксинитрилов. Эта реакция начинается с атаки атома углерода карбонильной группы цианид-ионом, поскольку реакция ускоряется в присутствии едкого кали или цианистого калия:
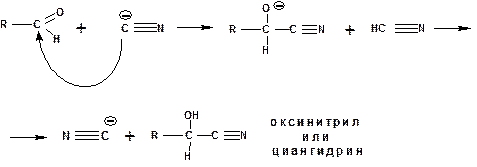
4.1.4. Присоединение спиртов
При действии на альдегиды и кетоны спиртов образуются полуацетали и полукетали. В присутствии каталитических количеств минеральной кислоты из альдегидов и спиртов получаются ацетали:
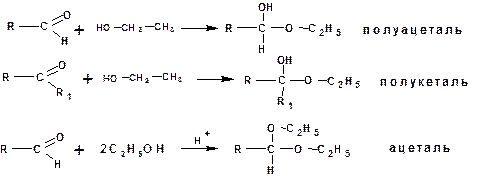
Кетали получают другим способом.
4.1.5. Присоединение производных аммиака
Карбонильные соединения присоединяют производные аммиака, например, гидроксиламин, гидразин, фенилгидразин. Как и в случае образования ацеталей эти реакции катализируются минеральными кислотами. Причем, поскольку амины являются основаниями и способны связывать протоны, то максимальные скорости реакции присоединения достигаются в интервале рН 4,0- 5,5 ед рН
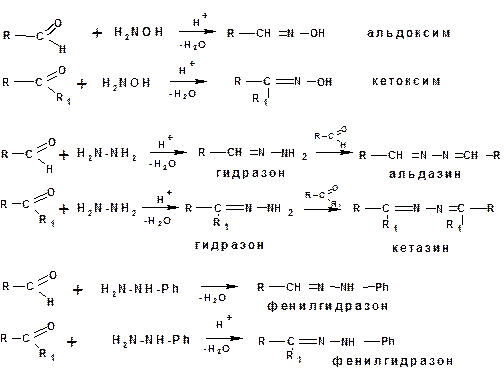
Присоединение производных аммиака происходит в соответствии со следующим механизмом:

Образующиеся в соответствии с данным механизмом оксимы применяются для идентификации альдегидов и кетонов. Восстановлением оксимов могут быть получены первичные амины. Чаще для идентификации альдегидов и кетонов используют арилгидразины. Это твердые вещества с характерными температурами плавления. Самым распространенным из них является 2,4-динитрофенилгидразон:
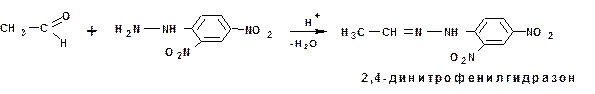
Сам аммиак реагирует по схеме нуклеофильного «присоединения-отщепления» только с альдегидами с образованием альдиминов:
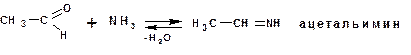
Альдимины тримеризуются в так называемые альдегидоаммиаки:
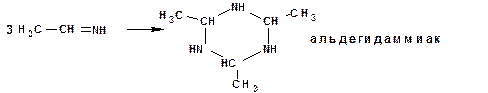
Первая стадия механизм «присоединения-отщепления» предусматривает нуклеофильную атаку атома углерода карбонильной группы. Поэтому ускорению реакции будет способствовать рост частичного, положительного заряда на атоме углерода. Убыль величины положительного заряда будет способствовать понижению реакционной способности карбонильного соединения. Поэтому реакционная способность карбонильных соединений будет понижаться с увеличением числа заместителей с положительным индуктивным и мезомерным эффектом, что выполняется в следующем ряду:
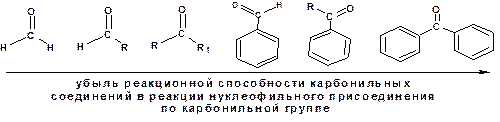
Реакции конденсации
4 .2.1. Альдольно-кротоновая конденсация
Альдегиды и кетоны в слабоосновной среде (ацетат натрия, карбонат калия или разбавленная щелочь 5-10%) подвергаются реакции альдольной конденсации. При этом образуются β-гидроксиальдегиды и β-гидроксикетоны:
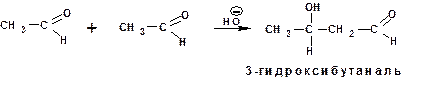
Механизм альдольной конденсации включает следующие стадии:
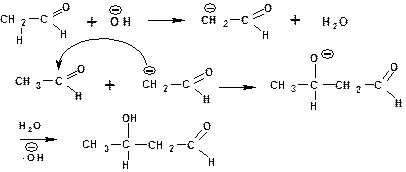
Образовавшийся β-гидроксиальдегид при нагревании даже без водоотнимающих средств легко отщепляет воду:
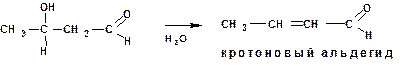
При этом образуется α,β-ненасыщенный альдегид. В данном случае – кротоновый альдегид.
Стадия, ведущая к образованию кротонового альдегида, называется «кротоновой конденсацией». Суммарный процесс называется «альдольно-кротоновой конденсацией». В альдольно-кротоновую конденсацию могут вступать альдегиды и кетоны, имеющие у α-углеродного атома два атома водорода. Причем в случае прекрестной альдольно-кротоновой конденсации (два разных карбонильных соединения) нуклеофильной атаке подвергается соединение, обладающее более высокой реакционной способностью. Т.е. имеющее относительно больший положительный заряд на атоме углерода карбонильной группы. Например, реакция альдольно-кротоновой конденсации уксусного альдегида и ацетона:

Сами кетоны вступают в альдольную конденсацию в более жестких условиях в присутствии более сильных оснований, например гидроокиси бария:
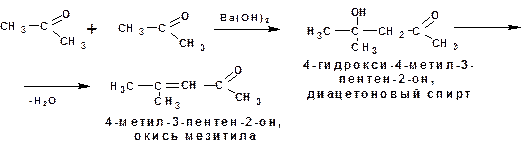
Ароматические альдегиды вступают в реакции типа альдольно-кротоновой конденсации с альдегидами, кетонами, сложными эфирами и ангидридами карбоновых кислот. Причем если в качестве основания используют раствор щелочи или этилат натрия, то реакция называется конденсацией Кляйзена. Если в качестве основания используют ацетат калия или натрия и ангидрид карбоновой кислоты, то это реакция Перкина. Например:
Конденсация Кляйзена:
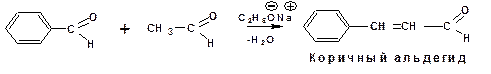
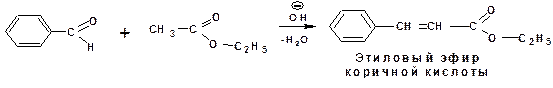
Конденсация Перкина:
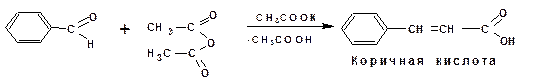
Приведенные примеры показывают, что альдольно-кротоновая конденсация является общим способом получения α,β-ненасыщенных карбонильных соединений и карбоновых кислот.
В реакцию альдольно-кротоновой конденсации вступают карбонильные соединения с числом атомов водорода у α-углеродного атома больше или равному двум:
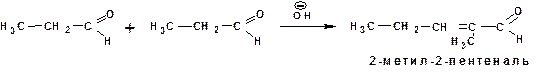
Если у α-углеродного атома только один атом водорода, то реакция останавливается на стадии альдольной конденсации:
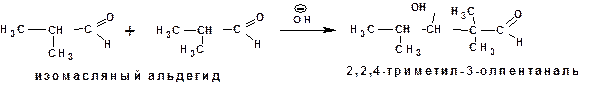
4.2.2. Реакция Канниццаро
Если α-углеродноый атом замещен полностью, то в концентрированной щелочи протекает реакция Канниццаро, которая представляет собой реакцию диспропорционирования где одна молекула альдегида выступает в роли окислителя, а другая - в роли восстановителя.
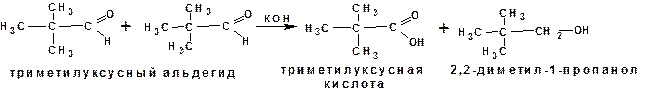 Механизм реакции Канниццаро включает особую стадию – гидридный перенос:
Механизм реакции Канниццаро включает особую стадию – гидридный перенос:
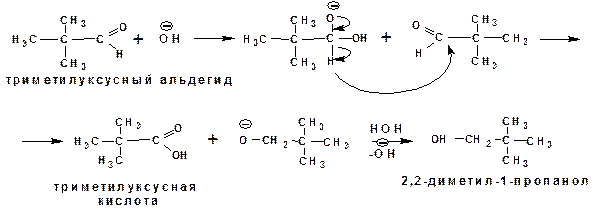
Чаще всего проводят перекрестную реакцию Канниццаро, где в качестве восстановителя используется формальдегид (почему?), а в качестве окислителя – ароматические альдегиды:
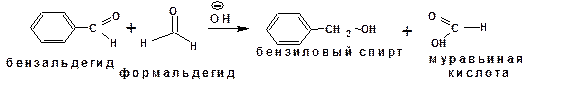
Перекрестная реакция Канниццаро с участием ароматических альдегидов и формальдегида является общим способом получения так называемых ароматических спиртов. Спиртов, в которых гидроксильная группа присоединена в бензильному радикалу. Примером таких спиртов является бензиловый спирт.
4.2.3. Реакция Тищенко
Другой реакцией, в которой происходит гидридный перенос является сложноэфирная конденсация или реакция Тищенко. Например, для двух молекул уксусного альдегида:
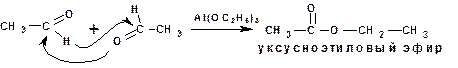
В реакции Тищенко используется в качестве катализатора кислота Льюиса, а механизм реакции предусматривает атаку углерода карбонильной группы атомом кислорода карбонильной группы второй молекулы альдегида.
4.2.3. Реакции полимеризации альдегидов
Применение кислоты и атака углерода карбонильной группы атомом кислорода карбонильной группы второй молекулы альдегида характерны для реакций полимеризации альдегидов.
Например, формальдегид, будучи при нормальных условиях газом, под влиянием разбавленных кислот образует циклический кристаллический тример, называемый триоксиметиленом:
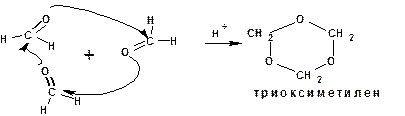
При пропускании газообразного формальдегида над карбонилом железа образуется высокомолекулярный полиформальдегид или параформ:
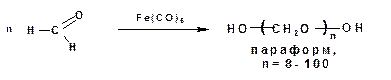
В условиях кислотного катализа уксусный альдегид тримеризуется с образованием циклического паральдегида:
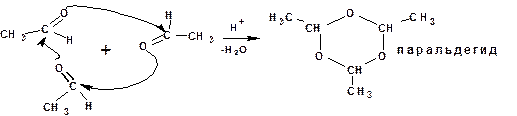
Механизм реакции предусматривает протонирование атома кислорода карбонильной группы одной молекулы альдегида и последующую атаку, образовавшегося карбкатиона, атомом кислорода другой молекулы альдегида.
К числу реакций полимеризации можно отнести реакцию формальдегида с аммиаком:
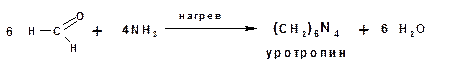
4.2.4. Окисление
Альдегиды легко окисляются до карбоновых кислот. Окисление можно проводить на холоду разбавленным раствором перманганата калия, хромовой кислотой, пероксидом водорода:
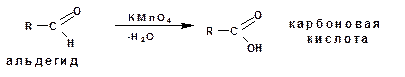
Альдегиды легко окисляются реактивом Толленса. Это раствор аммиаката серебра, при этом выделяется осадок металлического серебра в виде зеркального покрытия.
Альгедиды окисляются фелинговой жидкостью. Это водно-щелочной раствор, комплексной соли меди с винной кислотой. Получают смешением гидроокиси меди с натрийкалиевой соли винной кислоты. При нагревании альдегидов с фелинговой жидкостью медь (II) восстанавливается до меди (I), а альдегид окисляется до кислоты. При этом выделяется красный осадок закиси меди.
Окисление кетонов протекает в жестких условиях с разрывом углеродной цепи и образованием смеси карбоновых кислот:

4.2.5. Перегруппировка Бекмана
Ароматические кетоны проявляют те же свойства, что и ароматические альдегиды. Особенностью являются оксимы несимметричных ароматических кетонов. В силу того, что в оксимах между атомы углерода азота соединены двойной связью, то возможна геометрическая изомерия. Причем в этом случае изомеры обозначаются «син » и «анти ». син -Формой принято считать изомер, содержащий меньший радикал в цис -положении по отношению к гидроксильной группе. По Е,Z-системе син -форма будет рассматриваться как Е-изомер. Анти -Формой принято считать изомер, содержащий меньший радикал в транс -положении по отношению к гидроксильной группе. По Е,Z-системе анти -форма будет рассматриваться как Z –изомер:
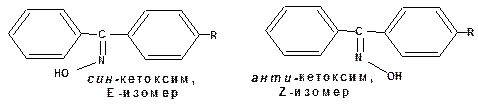
В присутствии минеральных кислот оксимы претерпевают перегруппировку, которая носит имя Бекмана. Механизм бекмановской перегруппировки: