Определение изменения
Энтропии при плавлении олова
Методические указания
к лабораторной работе № 11
Пенза 2007
УДК 531.23
ББК 22я7
А 13
| Составители: | Г. И. Грейсух, доктор технических наук, профессор; Л.И.Абрамова, кандидат физико-математических наук, доцент; С.В.Голобоков, кандидат технических наук, доцент; Н.А. Очкина, кандидат технических наук, доцент |
| Рецензент – | В.Г.Недорезов, доктор технических наук, профессор |
Рассмотрены процессы нагревания и плавления олова, приведены расчетные формулы для определения изменения энтропии.
Методические указания подготовлены на кафедре физики и предназначены для использования студентами специальностей 290100, 290300, 290600 и др. в лабораторном практикуме по курсу общей физики.
© Пензенский государственный
Университет архитектуры и строительства, 2007
Цель работы – изучение процессов плавления и кристаллизации олова и определение изменения энтропии.
ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
1. Теплоемкость твердых тел
Теплоемкостью твердого тела называется величина, равная отношению количества теплоты d Q, поглощаемого телом при бесконечно малом изменении его температуры dT, к этому изменению:
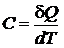 . (1)
. (1)
Удельной теплоемкостью вещества называется физическая величина, равная количеству теплоты d Q, необходимому для нагревания единицы массы вещества на один Кельвин:
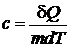 . (2)
. (2)
Отсюда количество теплоты, необходимое для нагревания вещества, определяется выражением
 . (3)
. (3)
Молярная теплоемкость С m – физическая величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества
на 1 К:
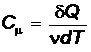 , (4)
, (4)
где n = 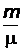 – количество вещества, выражающее число молей.
– количество вещества, выражающее число молей.
Удельная теплоемкость с связана с молярной Сm соотношением
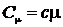 , (5)
, (5)
где m – молярная масса вещества.
Твердое тело – агрегатное состояние вещества, отличающееся стабильностью формы. Тепловое движение атомов твердого тела характеризуется малыми колебаниями около положения равновесия. Все вещества (за исключением гелия) при достаточно низких температурах переходят в твердое состояние. При подводе теплоты к твердому телу она расходуется на увеличение энергии колебаний атомов.
Согласно молекулярно-кинетической теории средняя кинетическая энергия, приходящаяся на одну степень свободы атома твердого тела
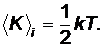
Полная энергия колебательного движения атомов в одном направлении складывается из кинетической и потенциальной энергии, которые равны друг другу, и может быть определена по формуле

Так как каждый атом обладает тремя степенями свободы, то полная энергия одного атома твердого тела равна:
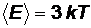 . (6)
. (6)
Внутренняя энергия одного моля равна:
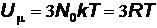 , (7)
, (7)
| где N 0 – | число Авогадро; |
| R – | универсальная газовая постоянная. |
При подводе теплоты в условиях постоянного объема все тепло уходит на увеличение внутренней энергии. Поэтому молярная (атомная) теплоемкость твердого тела определяется равенством:
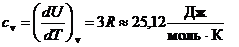 . (8)
. (8)
Из формулы (8) следует, что молярная теплоемкость твердых тел есть величина постоянная, одинаковая для всех веществ. Это утверждение называется законом Дюлонга и Пти.
Как показал опыт, при обычных температурах молярная (атомная) теплоемкость большинства твердых тел близка к значению 25,12 Дж/(К×моль) и почти не зависит от температуры.
Плавление и кристаллизация
Плавление – переход вещества из кристаллического (твердого) состояния в жидкое. Плавление происходит с поглощением теплоты. На рис.1 изображена примерная диаграмма плавкости: на оси абсцисс откладывается время, на оси ординат – температура олова.
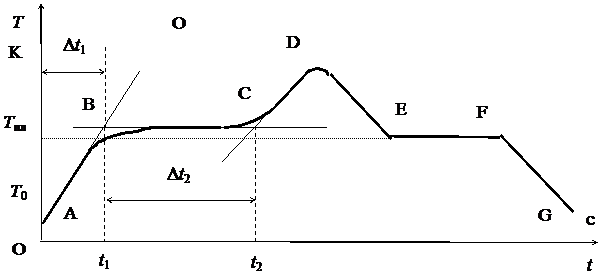
Рис.1
При нагревании твердого тела внутренняя энергия возрастает, увеличивается амплитуда колебаний атомов в узлах кристаллической решетки, при этом возрастает температура (линия АВ).
Когда температура возрастает до точки плавления Т пл, амплитуда колебаний достигает такой величины, что начинается разрушение кристаллической решетки – твердое тело начинает плавиться. Процесс плавления происходит изотермически, т.е. при постоянной температуре (горизонтальная прямая ВС), и характеризуется удельной теплотой плавления, которая определяется количеством теплоты, необходимым для расплавления единицы массы вещества:
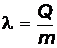 . (9)
. (9)
Когда закончится процесс плавления, образуется жидкая фаза и температура жидкости начинает повышаться (кривая СД).
Если прекратить нагрев жидкости (точка D) и начать ее охлаждать, то кривая ДE пойдет вниз. Когда температура понизится до Т пл (см. рис. 1), начинается процесс кристаллизации, при этом атомы и молекулы жидкой фазы, соединяясь друг с другом, образуют кристаллическую решетку. Процесс кристаллизации (линия EF) происходит при постоянной температуре и протекает с выделением теплоты кристаллизации, которая равна теплоте плавления. Когда процесс кристаллизации закончится, прекратится выделение теплоты кристаллизации, начинает охлаждаться твердое тело (кри-
вая FG).