1. Занесите результаты измерений в таблицу 1.
Таблица 1 - Результаты измерений и вычислений
| Физическая величина | Т | 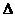 Р Р
| 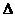 Т Т
| m | a | b | Тинв | Ткр |
| Единицы измерений Номер опыта | оС | Па | оС | 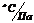
| 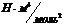
| 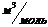
| К | К |
| … | ||||||||
| n |
2. Из экспериментальных данных определить пределы изменения аргумента 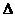 Р и функции
Р и функции 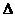 Т.
Т.
3. На координатных осях указать откладываемые физические величины и обозначить единицы величин.
4. Указать масштаб на осях координат (при очень больших или очень малых величинах, показательную часть в записи величины указать рядом с единицами измерений на оси).
5. Нанести полученные экспериментальные данные на координатную плоскость, обозначив их крестиком, кружочком, или жирной точкой.
6. Провести через экспериментальные точки плавную линию, в соответствии с выбранным законом аппроксимации экспериментальных данных, по методу наименьших квадратов.
7. На графике 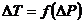 , по наклону линии определить коэффициент Джоуля-Томсона для выбранной вами температуры.
, по наклону линии определить коэффициент Джоуля-Томсона для выбранной вами температуры.
8. Определить температуру инверсии Тинв и критическую температуру Ткр для углекислого газа используя данные таблицы 4 и формулы (29-30) раздела I.
9. Исследовать знак эффекта, выявить существующие зависимости между величинами.
10. По двум парам температур дифференциального термометра получить формулы для определения постоянных a и b для углекислого газа, используя формулу 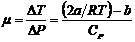 и экспериментальные данные, полученные при трех значениях выбранных температур. (
и экспериментальные данные, полученные при трех значениях выбранных температур. (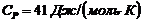 , R – газовая постоянная).
, R – газовая постоянная).
11. Определить температуру инверсии Тинв и критическую температуру Ткр для углекислого газа используя вычисленные значения постоянных a и b и формулы (29-30) раздела I.
12. Определить абсолютные погрешности прямых измерений.
13. Вывести формулы для оценки максимальной абсолютной и относительной погрешности косвенных измерений.
14. Выполнить оценку максимальной абсолютной и относительной погрешности косвенных измерений.
15. Выполнить сравнительную оценку экспериментальных и справочных результатов.
По указанию преподавателя студент может самостоятельно, опираясь на имеющиеся теоретические знания, методическую и справочную литературу, подобрать метод обработки и анализа экспериментальных данных, математический метод решения задачи аппроксимации, а также выбрать характеристики для оценки погрешности результатов измерения.
Контрольные вопросы
1. Как силы межмолекулярного взаимодействия зависят от расстояния между молекулами?
2. Укажите соотношения между минимальной потенциальной энергией двух молекул и средней кинетической энергией хаотического движения молекулы для различных агрегатных состояний вещества.
3. Из каких предпосылок выводится уравнение Ван-дер-Ваальса?
4. Каков физический смысл постоянных Ван-дер-Ваальса? Какое значение принимают эти постоянные для идеального газа?
5. Что такое внутреннее давление?
6. Объясните различие опытных изотерм реального газа и изотерм, соответствующих уравнению Ван-дер-Ваальса.
7. При каких условиях возникает критическое состояние вещества и в чем оно проявляется?
8. Объясните эффект Джоуля -Томсона.
9. Какой из эффектов Джоуля -Томсона называют положительным, а какой отрицательным?
10.Азот массой т = 300 г, находится в сосуде объемом V = 0,5 л при температуре t = 27 °С. Можно ли считать азот в таком состоянии идеальным газом или нет?
11. Найдите выражение для коэффициента Джоуля – Томсона в двух случаях: а) силы межмолекулярного притяжения отсутствуют,
б) объем молекул не учитывается.
12.Что можно сказать на основании ваших измерений Тинв и Ткр о точности уравнения Ван-дер-Ваальса?