Работа № 3. ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ
Цель работы – усвоение понятий эквивалент, молярная масса эквивалента, знакомство со способами расчета молярных масс эквивалентов простых и сложных веществ; экспериментальное определение эквивалента неизвестного металла объемным методом.
Основные слова и определения, которые следует знать[1]:
Моль – количество вещества, содержащее столько формульных единиц, сколько атомов содержится в 0,012 кг изотопа углерода  .
.
Постоянная Авогадро NA - это число частиц в 1 моле любого вещества;
NA=6,022*1023 моль -1.
Молярная масса М- масса одного моля вещества. Молярная масса М численно совпадает с массами атомов и молекул, выраженными в атомных единицах массы, и измеряется в граммах на моль (г/моль).
Атомная единица массы (а. е. м. или u) – это единица массы, равная 1/12 массы атома изотопа углерода 12С, и применяемая в атомной и ядерной физике для выражения масс молекул, атомов, ядер, протона и нейтрона. 1 а.е.м. (u) ≈ 1.66054*10-27 кг.
Молярный объем Vм – объем 1-го моля газа, измеряется в литрах на моль (л/моль).
Формульная единица вещества ФЕ –это реально существующие частицы вещества: атомы (S, C, Fe), молекулы (H2O, CO2, NaOH, HCl, H2), ионы (Са+2, СО3-2), радикалы (ОН., NO2.) и другие частицы вещества.
Химический эквивалент (Э)- это реальная или условная частица, которая может присоединять, высвобождать, или быть каким-либо другим способом равнозначна одному атому (иону) водорода в обменных (кислотно-основных) реакциях или одному электрону в окислительно-восстановительных реакциях.
Или:
Химический эквивалент (Э)– это реальная или условная частица вещества ФЕ, эквивалентная в кислотно-оснoвной реакции одному иону водорода или в окислительно-восстановительной реакции – одному электрону
Эквивалентное число или число эквивалентности Zэкв - это число, равное абсолютному значению степени окисления иона или количеству электронов, переданному восстановителем окислителю или окислителем восстановителю.
Фактор эквивалентности f – это число, показывающее, какая доля реальной частицы вещества ФЕ эквивалентна в данной кислотнооснoвной реакции одному иону водорода или в окислительно-восстановительной реакции одному электрону: f = 1/Zэкв, где Zэкв – это число эквивалентности, или эквивалентное число.
Или:
Фактор эквивалентности f экв – это величина, обратная числу эквивалентности; она показывает, какая доля формульной единицы вещества приходится на 1 химический эквивалент
f экв = 1/Zэкв.
Молярная масса химического эквивалента Мэкв - этомасса одного моля химического эквивалента вещества, которая в Zэкв раз меньше соответствующей молярной массы ФЕ вещества, участвующего в реакции и выражается в граммах на моль (г/моль):
Мэкв (ФЕ)= 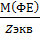 =М(ФЕ)* fэкв
=М(ФЕ)* fэкв
Молярный объем химического эквивалента (эквивалентный объем) Vэкв газа - это объем 1 моля химического эквивалента газа, выражается в литрах на моль (л/моль) и связан молярным объемом соотношением:
Vэкв =  =Vm* f экв
=Vm* f экв
Закон эквивалентов: массы реагирующих веществ относятся между собой как молярные массы их эквивалентов:
m (A): m (B): m (D)... = M экв (A): M экв (B): M экв (D)...
Теоретическая часть
Раздел химии, в котором рассматриваются количественные (массовые, объемные) соотношения между реагентами и продуктами реакции, а также количественный состав вещества, называют стехиометрией (от греч. Stoicheion –основа; metreo - измеряю). Она базируется на законах, определяющих строение вещества.
Эквивалент Э – это реальная или условная частица вещества ФЕ, эквивалентная в кислотно-оснoвной реакции одному иону водорода или в окислительно-восстановительной реакции – одному электрону.
ФЕ – формульная единица вещества, под которой понимается какое-либо вещество, например, NaOH, HCl, H2 и т. п.
Фактор эквивалентности f – число, показывающее, какая доля реальной частицы вещества ФЕ эквивалентна в данной кислотно-оснoвной реакции одному иону водорода или в окислительно-восстановительной реакции одному электрону: f = 1/Z,
где Z – число эквивалентности, или эквивалентное число, равное абсолютному значению степени окисления иона или числу электронов, переданному восстановителем окислителю или окислителем восстановителю.
Немецкие химики Венцель и Рихтер установили (1793 г.), что вещества реагируют и образуются в эквивалентных количествах.
Согласно закону эквивалентов, массы реагирующих веществ относятся между собой как молярные массы их эквивалентов:
m (A): m (B): m (D)... = M экв (A): M экв (B): M экв (D)...
Молярная масса эквивалента представляет собой массу одного моля эквивалента вещества, которая в Z раз меньше соответствующей молярной массы ФЕ вещества, участвующего в реакции и выражается в граммах на моль (г/моль):
Мэкв (ФЕ)= 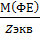 =М(ФЕ)* fэкв
=М(ФЕ)* fэкв
Например, для реакции нейтрализации
H2SO4 + 2NaOH → Na2SO4 + 2H2O:
(2+32+64=98) 2*(23+16+1=40) (23*2+32+64=142) 2*(18)
| H2SO4 | NaOH | Na2SO4 | H2O | |
| Формульное количество, моль | ||||
| Эквивалентное количество, моль | 1/2 | 1/2 | ||
| Число эквивалентности Z | ||||
| Фактор эквивалентности | 1/2 | 1/2 | ||
| Молярная масса эквивалента, г/моль | 98/2=49 | 40/1=40 | 142/2=71 | 18/1=18 |
Основные количественные законы протекания химических реакций, используемые в работе:
Закон Авогадро: