Данная работа рассчитана на 2 часа академических занятий и на 4 часа самостоятельной работы студентов с преподавателем.
Целью данной работы является ознакомление студентов с данными сокращенного химического анализа подземных вод, методикой их обработки и пересчета путем использования нормативов ГОСТа, систематизация и оценка пригодности их для питьевого водоснабжения или технического использования.
2.2.1 Свойства и характеристика подземных вод. Вопросы практического использования подземных и рудничных вод могут быть решены только после полного изучения их физико-химических свойств, химического и бактериального состава.
Химический состав и физические свойства подземных вод изучают для различных целей: питьевого и технически-хозяйственного водоснабжения (питания паровых котлов, охлаждения машин, тушения пожаров и т.п.), орошения полей, лечебных целей, как поисковый критерий на различные полезные ископаемые, для оценки агрессивности подземных вод по отношению к бетону, коррозирующих свойств по отношению к металлам, для установления связи водоносных горизонтов между собой и с поверхностными водами и т.п.
Подземные воды представляют собой сложные естественные растворы, находящиеся в многообразных связях и взаимодействии с окружающей природной средой. Естественная физико-географическая и геологическая обстановка определяют особенности генезиса и дальнейшего преобразования подземных вод.
К физическим свойствам подземных вод относятся температура, цвет, запах, прозрачность, вкус, привкус, электропроводность и радиоактивность. Определение этих свойств частично проводится непосредственно в полевых условиях при отборе проб воды, а в основном – в химических лабораториях по специальной методике.
Химические свойства подземных вод определяются количеством и соотношением содержащихся в них в растворенном виде солей, присутствующих в воде в виде ионов – анионов и катионов, а также некоторых недиссоциированных соединений, газов и органических соединений.
Среди ионов наибольшее практическое значение имеют следующие: катионы – водород – H+, натрий – Na+, калий – K+, магний – Mg2+, кальций – Ca2+, железо – Fe2+; анионы – хлор – Cl-, сульфат – SO42-, гидрокарбонат – HCO3-. Из недиссоциированных соединений наиболее часто встречаются окислы железа – Fe2O3, кремния – Si2O3, алюминия – Al2O3, а из газов – углекислый газ – CO2, кислород – O2, азот – N2, метан – CH4, сероводород – H2S.
В результате выполнения данной работы студенты, изучив химический состав подземных вод, должны иметь определенные навыки по их обработке и систематизации, а также определить область практического использования.
Перечень необходимых определений веществ, содержащихся в подземных водах, устанавливается в соответствии с целевым назначением анализа, что и указывается в программе работ гидрогеологических исследований.
2.2.2 Способы выражения химического состава подземных вод. В природной воде молекулы солей почти полностью диссоциированы на ионы, поэтому основной формой выражения результатов химического анализа воды является ионная форма. При этом содержание любого иона в процессе исследования выражается в граммах или миллиграммах на кубический дециметр (что равнозначно литру) воды (г/дм3 (г/л), мг/дм3 (мг/л)). Поэтому результаты анализов в химических лабораториях даются в ионной форме, т.е. в г/дм3 (г/л), мг/дм3 (мг/л).
Но, делать некоторые выводы о составе и свойствах воды можно, лишь имея анализы в миллиграмм - эквивалентной и эквивалент - процентной формах. Поэтому данные химического анализа должны быть пересчитаны (табл. 3). Для этого вначале необходимо определить эквивалент каждого аниона и катиона. Дело в том, что ионы взаимодействуют между собой в строго определенных эквивалентных весовых соотношениях. Например, один эквивалент одного иона хлора Cl- может взаимодействовать только с одним эквивалентом иона натрия Na+ или кальция Ca2+. Следовательно, эквивалент – это число, показывающее, в каком весовом соотношении данный ион вступает в соединение с другим ионом. Для пересчета анализа из ионной формы в миллиграмм – эквивалентную следует число миллиграммов каждого иона разделить на его эквивалентный вес, который представляет собой отношение атомного (или ионного) веса данного элемента к его валентности.
Например, кальция Ca2+ в воде содержится 420 мг/дм3. Эквивалентный вес одного иона кальция Ca2+ равен: 40,08: 2 = 20,04 мг/экв. Чтобы определить его миллиграмм – эквивалентное содержание надо 420: 20,04 = 20,96 мг/экв.
Также для пересчета анализов воды в миллиграмм-эквиваленты содержание ионов умножают на специальные пересчетные коэффициенты, которые представляют частное от деления единицы на эквивалентный вес. Для выше приведенного примера пересчетный коэффициент кальция Ca2+ равен 1: 20,04 = 0,0499. Если 420 • 0,0499 = 20,96 мг/экв – миллиграмм-эквивалентная форма.
Ниже приведены пересчетные коэффициенты для некоторых ионов:
натрий Na+ - 0,0435
кальций Ca2+ – 0,0499
магний Mg2+ – 0,0822
хлор Cl- – 0,00282
сульфат SO42- – 0,0208
гидрокарбонат HCO3- – 0,0164
Если сумму всех катионов и анионов в миллиграмм-эквивалентной форме принять за 100%, можно получить соответствующие выражения для анионов и катионов в эквивалент-процентной форме.
Количества катионов и анионов, выраженные в эквивалент-процентной форме, должны быть равны между собой, т.е. сумма всех катионов должна составлять 50% и сумма всех анионов тоже 50%, что является удобным контролем анализа.
В последнее время очень часто принимают за 100% сумму миллиграмм-эквивалентов анионов и также за 100% - сумму миллиграмм-эквивалентов катионов. Расчет от этого не изменяется, но величины эквивалент-процентов становятся в два раза больше.
Если результаты анализа воды выражены в миллиграмм-эквивалентной форме, то перед символом иона ставят букву r, например rCl- и т.д.
При анализе могут быть неточности. Допустимая неточность анализа определяется из выражения:

Таблица 3 - Исходные данные
| № скв. | глубина взятия пробы, м | pH | сухой оста-ток, г/л | катионы, мг/л | анионы, мг/л | темпе-ратура воды, t0C | второсте-пенн. компо-ненты, мг/л | ||||
| Na++ K+ | Ca2+ | Mg2+ | HCO3- | SO42- | Cl- | ||||||
В итоге пересчетов должна быть составлена таблица следующей формы (табл. 4):
Таблица 4 - Порядок пересчета ионной формы в другие формы
| Основные ионы | мг/л | мг∙экв/л | экв./проц. | пересчетные коэффициенты | прочие определения, мг/л |
| Катионы: Na+ K+ Ca2+ Mg2+ ∑ ∑r+ Анионы HCO3- Cl- SO42- ∑ ∑r- Всего | 0,0435 0,0256 0,0499 0,0822 0,0164 0,0282 0,0208 |
При химическом анализе воды определяют величину сухого остатка после выпаривания и количества веществ, содержащихся в воде (минерализацию). Количества веществ показывают в ионной форме, при которой содержание отдельных ионов определяют в миллиграммах на 1 л воды. При выборе и оценке воды источника централизованного хозяйственно-питьевого водоснабжения пользуются государственными стандартами (ГОСТ – 2874 – 82 и др.). Сумма растворенных в воде веществ – сухой остаток – при t = 105 – 1100 C не должна превышать 1000 мг/л.
2.2.3 Минерализация. Это экспериментально определенный сухой остаток или подсчитанная сумма минеральных веществ. Единой классификации по степени минерализации нет, их достаточно много применительно к требованиям отдельных ведомств. В таблице 5 приводится выражение общей минерализации подземных вод по В.М. Вернадскому, согласующееся с требованиями их практического использования.
Таблица 5 - Классификация подземных вод по общей минерализации
| Оценка воды (раствора) | Минерализация г/л |
| Пресная Солоноватая Соленая Горько-соленая Слабые рассолы Крепкие рассолы | До 1 1 – 3 3 – 10 10 – 50 50 – 100 >100 |
2.2.4 Жесткость воды. Особое ее качество, обусловленное присутствием углекислых и сернокислых солей Ca2+ и Mg2+. Жесткость поземных вод имеет большое значение при их оценке для практического использования. Жесткая вода плохо взмыливается, дает накипь в паровых котлах (что уменьшает их теплопроводность, приводит к перерасходу топлива и может вызвать аварию) и в посуде, вспенивается, в жесткой воде медленнее развариваются овощи, мясо, крупы и другие продукты.
Различают общую, временную (карбонатную или устранимую) и постоянную жесткость воды. Общей называют жесткость, соответствующую пробе свежей воды. При кипячении воды растворенные в ней бикарбонаты (двууглекислые соли) переходят в углекислые и выпадают в виде осадка или накипи. Жесткость, соответствующая кипяченной воде, называется постоянной. Разность между общей и постоянной жесткостью воды называют временной жесткостью.
Жесткость выражают в градусах жесткости. Существует три системы градусов жесткости: немецкая, французская, английская. За один немецкий градус жесткости принимается содержание в 1 л 10 мг CaO или 7,2 мг MgO. За один французский градус – содержание в 1 л воды 10 мг CaCO3 или 17,5 мг MgCO3. В английской системе одному градусу жесткости соответствует содержание в 1 л воды14 мг CaCO3 (точнее, в английских мерах, - 1 гран (64,79892 мг) CaCO3 на 1 галлон (4,546 л) воды).
Для перевода из одной системы градусов в другую можно воспользоваться такими соотношениями:
1,00 жестк. нем. = 1,790 жестк. франц. = 1,250 жестк. англ.
0,560 жестк. нем. = 1,00 жестк. франц. = 0,70 жестк. англ.
0,80 жестк. нем. = 1,430 жестк. франц. = 1,00 жестк. англ.
Количество солей, мг/л, из которых каждая в отдельности обусловливает 10 жесткости, представлены ниже:
Соли CaO MgO CaCO3 MgCO3 CaCl2 MgCl2 CaSO4 MgSO4
1,00 жестк. нем. 10,0 7,2 17,9 8,0 19,7 17,0 25,0 21,5
1,00 жестк. франц. 5,6 4,0 10,0 4,4 11,0 9,5 14,0 12,0
1,00 жестк. англ. 8,0 5,8 14,0 6,4 15,8 13,6 20,1 17,2
В настоящее время в нашем государстве вместо жесткости в градусах введено понятие жесткости в миллиграмм-эквивалентах на литр. За единицу жесткости принимают 1 мг-экв Ca, т.е.20,04 мг Ca на 1 л воды. Вместо кальция может быть принят 1 мг-экв магния, т.е. 12,16 мг Mg на 1 л воды. Для перевода из системы градусов жесткости (немецких) в миллиграмм-эквиваленты и обратно можно воспользоваться такими соотношениями: 1 мг-экв/л соответствует 2,80 жест. (нем.); 0,357 мг-экв/л соответствует 1,00 жест. (нем.).
Жесткость природных вод колеблется в пределах от нескольких до десятков и сотен мг-экв/л; в одном и том же водоисточнике жесткость неодинаковая в разные времена года.
В случае необходимости использования жестких вод для тех или иных целей их приходится обрабатывать специальными способами для снижения жесткости до требуемых норм.
Природные воды по общей жесткости О.А. Алекин подразделяет на пять групп (табл. 6):
Таблица 6 - Классификация природных вод по общей жескости
| Оценка воды | Жесткость, мг-экв/л |
| Очень мягкая Мягкая Умеренно-жесткая Жесткая Очень жесткая | До 1,5 1,5 – 3,0 3,0 – 6,0 6,0 – 9,0 >9,0 |
2.2.5 Оценка воды по активной реакции. Как уже отмечалось, в воде часть молекул всегда находится в диссоциированном состоянии, в виде ионов H+ и OH-. Концентрация недиссоциированной воды считается постоянной, поэтому произведение ионов водорода и ионов гидроксила при данной температуре тоже будет величиной постоянной. При температуре 220 C эта величина равна 10-14. Так как чистая вода имеет нейтральную реакцию, количества ионов водорода и ионов гидроксила должны быть равны. Следовательно,
[H+] = [OH-] = 10-7.
Это выражение означает, что в 1 л чистой воды при 220C содержится 10-7 грамм-молекул воды в ионизированном виде, т.е. 10-7 грамм-ионов водорода и 10-7 грамм-ионов гидроксила. Если [H+] = 10-7, то lg[H+] = -7 и - lg[H+] = 7. Выражение - lg[H+] означает pH. Следовательно, если pH < 7 – реакция воды кислая, pH = 7 – нейтральная, pH > 7 – щелочная.
По величине активной реакции или водородного показателя pH природные воды классифицируются следующим образом (табл. 7):
Таблица 7 - Классификация природных вод по активной реакции
| Признак | Значение pH |
| Весьма кислые Кислые Нейтральные Слабощелочные Высокощелочные | <5 5 – 7 7 – 9 >9 |
Подземные воды в большинстве своем имеют слабощелочную реакцию. Воды сульфидных и особенно колчеданных и каменноугольных месторождений обычно кислые и часто весьма кислые.
Определять концентрацию водородных ионов необходимо на месте взятия пробы; наиболее употребительный способ определения – колориметрический, основанный на свойстве индикаторов менять окраску в зависимости от концентрации водородных ионов.
2.2.6 Агрессивные свойства подземных вод. Отрицательное воздействие подземных вод на металл и бетон называется агрессивностью воды. Это свойство обусловлено присутствием в воде ионов бикарбоната, водорода, агрессивной углекислоты, сульфатов и магния. В связи с этим различают агрессивность выщелачивания, общекислотную, углекислую, сульфатную и магнезиальную. Оценку различных видов агрессивности проводят по справочнику «Нормы и технические условия. Бетон гидротехнический. Признаки и нормы агрессивности воды-среды».
Наличие натриевых и калиевых солей вызывает образование накипи. Свободный ион H+ вызывает разъедание стенок котлов и труб. Временная (устранимая) жесткость воды является с этой точки зрения положительным фактором, так как ионы HCO3- связывают свободные ионы H+. Кроме ионов водорода разъедающее действие на металл оказывают ионы кислорода, углекислоты, сероводорода. Поэтому вода, применяемая для технических целей, нуждается в предварительной обработке. После обработки вода по большей части становится непригодной для питья.
Агрессивность выщелачивания возникает при малом содержании в воде HCO3- (менее 1,5 мг-экв/л). В этих условиях происходит растворение и вымывание из бетона содержащейся в нем извести.
Общекислотная агрессивность обусловлена низким значением водородного показателя pH (менее 5), из-за чего усиливается растворение извести бетона.
Углекислая агрессивность возникает в результате действия агрессивной углекислоты CO2. В процессе взаимодействия с водой из цемента выделяется свободная известь CaCO3, которая реагирует со свободной углекислотой CO2. Реакция идет по схеме CaCO3 + CO2 + H2O = Ca(HCO3)2. Образующийся при этом бигидрокарбонат кальция является растворимым и легко выносится из бетона.
Вода для большинства марок цемента становится агрессивной, если содержание в ней свободной углекислоты больше величины, определяемой по формуле a∙Ca + b. Содержание Ca2+ выражается в мг/л, а коэффициенты a и b определяются в зависимости от карбонатной жесткости HCO3- (мг-экв/л) и суммарного содержания ионов Cl- + SO42- в мг/л по специальной таблице 14.
Сульфатная агрессивность возникает при наличии в воде повышенного количества сульфата SO42-; в бетоне происходит кристаллизация новых соединений, образование которых сопровождается увеличением объема, вследствие чего происходит разрушение бетона. Такими новыми соединениями являются гипс CaSO4 ∙ 2H2O и сульфоаллюминат кальция 3CaO ∙ Al2O3 ∙ 3CaSO4 ∙ 31H2O (цементная бацилла). При образовании гипса объем бетона увеличится в два раза, а при образовании цементной бациллы – в 2,5 раза.
При содержании в воде SO42- менее 250 мг/л сульфатная агрессивность отсутствует независимо от содержания хлора Cl-. Вода становится агрессивной по отношению к обычным портландцементам, если содержание ионов SO42- будет больше приведенных ниже показателей с учетом содержания в воде ионов хлора Cl- (мг/л):
Cl- - менее 1000 SO42- - 250
от 1000 до 6000 - 500
более 6000 - 1100
Магнезиальная агрессивность, подобно сульфатной, ведет к разрушению бетона при соприкосновении его с водой, содержащей повышенное количество Mg2+. При этом, если содержание ионов магния Mg2+ будет меньше 1000 мг/л, вода считается магнезиально – неагрессивной независимо от содержания иона SO42- (мг/л). При содержании ионов магния Mg2+ более 1000 мг/л и больше величины, определяемой по формуле К- SO42-, вода считается агрессивной. Величина К для обычного портланд - цемента равна 7000.
2.2.7 Классификация подземных вод по химическому составу. Единой общепринятой классификации подземных вод в зависимости от их химического состава нет, что объясняется чрезвычайно разнообразным качественным и количественным химическим составом природных вод. Наиболее удобны те классификации, которые построены на принципе деления вод по преобладающим ионам (катионам и анионам) и по соотношению между ними. Именно на этом принципе построена классификация О.А. Алекина, широко используемая в геолого–разведочной, горной промышленности, гидротехнике и коммунальном хозяйстве.
В соответствии с этой классификацией все природные воды по преобладающему в них аниону делятся на три больших класса – гидрокарбонатные, хлоридные и сульфатные. Каждый класс, в свою очередь, по преобладающему катиону делится на три группы – натриевые, кальциевые и магниевые. Группы по соотношению между ионами подразделяются на четыре типа:
I тип: HCO3- > Ca2+ + Mg2+ - воды маломинерализованные;
II тип: HCO3- < Ca2+ + Mg2+ < HCO3- + SO42- - воды умеренной минерализации;
III тип: HCO3- + SO42- < Ca2+ + Mg2+ или, что то же самое,
Cl- > Na+ - воды высокоминерализованные;
IV тип - HCO3- = 0 – воды кислые, имеются только в сульфатном и хлоридном классе.
Для удобства сопоставления анализов воды используют различные способы сокращенного изображения состава. Наиболее часто применяются формула М.Г. Курлова, графические – прямоугольник солевого состава Н.И. Толстихина и треугольники Фере ионного состава.
Формула М.Г. Курлова представляет собой псевдодробь, где в числителе располагаются по убывающей анионы с индексом, равным содержанию данного иона в экв/%, в знаменателе - в такой же последовательности катионы. Ионы, содержание которых не превышает 10 экв/%, в формулу не включаются. Количество анионов и катионов округляется до целого числа. Перед дробью даются значение минерализации (М) с индексом, равным количеству сухого остатка в г/л, а также содержание элементов и газов с индексами, равными их содержанию в мг/л. После дроби указываются температура воды в градусах (t0C) и активная реакция воды (pH).
В наименовании состава воды рекомендуется называть первыми анионы, затем катионы, а также элементы и газы. Ионы, содержание которых в воде менее 25%, не называются.
Прямоугольник солевого состава Н.И. Толстихина (рис. 13) состоит из трех вертикальных граф. Левая и правая графы делятся на 10 равных частей, каждая часть приравнивается 10%. Нумерация производится снизу вверх. В левой графе изображаются катионы, в правой – анионы в экв/%. В средней графе показывают состав и процентное содержание солей, которые образуются в результате реакции катионов и анионов. Катионы и анионы на графике располагаются снизу вверх в последовательности, определяемой относительной реактивной силой: K+, Na+, Mg2+, Ca2+, Fe2+, NO3-, Cl-, Br-, I-, SO42-, HCO3-, CO32-.
| Катионы | Соли | Анионы |
| Ca2+ | CaCl2, CaSO4, Ca(HCO3)2 | HCO3- |
| Mg2+ | MgCl2, MgSO4, Mg(HCO3)2 | SO42- |
| Na+ | NaCl, Na2SO4, NaHCO3 | Cl- |
Рисунок 13 – Прямоугольник солевого состава
Треугольники Фере ионного состава (рис. 14) составляются отдельно для катионов и анионов, содержание которых дается в экв/%. В произвольном масштабе вычерчиваются два равносторонних треугольника, в вершинах которых располагаются катионы и анионы. Считается, что в вершине количество каждого катиона и аниона равно 100%. Далее, каждая сторона треугольника делится на 10 равных отрезков, соответствующих 10-ти процентам. Содержание катиона или аниона откладывается в виде точек на двух прилежащих к этой вершине сторонах треугольника. Эти точки затем соединяются прямой линией, параллельной третьей стороне. В итоге в каждом треугольнике получится по три прямые линии, точка пересечения которых графически изображает химический состав воды.

2.2.8 Оценка воды для питьевого водоснабжения. Вода, используемаядля хозяйственно-питьевого водоснабжения, должна удовлетворять требованиям ГОСТ - 2874-82 «Вода питьевая, технические требования к качеству». Согласно этого стандарта ниже приведены предельно-допустимые концентрации (ПДК) для некоторых показателей (табл. 8):
Таблица 8 - Нормативы ГОСТ 2874-82
| Показатель | ПДК, не более |
| 1.Активная реакция, pH 2.Сухой остаток, мг/л 3.Общая жесткость, мг-экв/л 4.Хлориды Cl-, мг/л 5.Сульфаты SO42, мг/л 6.Нитраты N2, мг/л 7.Аммиак по N, мг/л 8.Железо Fe2+, мг/л 9.Свинец Pb2+, мг/л 10.Мышьяк As3+, мг/л 11.Фтор F, мг/л 12.Медь Cu2+, мг/л 13.Цинк Zn2+, мг/л 14.Остаточный алюминий Al2+, мг/л 15.Фенол, мг/л 16.Стронций Sr2+, мг/л 17.Природный уран U235, U238, мг/л | 6,0 – 9,0 2,0 0,3 0,5 0,05 1,5 1,0 5,0 0,5 0,001 2,0 1,7 |
При отсутствии источника с пресной водой разрешается использовать воду с сухим остатком до 1500 мг/л, при общей жесткости до 10 мг-экв/л. В каждом случае возможность использования таких вод должна быть согласована с органами санитарно-эпидемиологической службы.
Питьевая вода должна быть прозрачна, бесцветна, не иметь запаха, быть приятной на вкус. Золотисто-желтая или бурая окраска воды свидетельствует о наличии в ней растворенных органических веществ. Соленый вкус обуславливается значительным количеством NaCl, а горький – присутствием MgSO4. Наличие в воде солей азотной и азотистой кислот, а также аммиака указывает на связь этой воды с участками, где происходит разложение органических веществ, следовательно, на возможность наличия болезнетворных бактерий. Кроме того, пригодность воды для питья определяется по наличию кишечной палочки Coli. Сама по себе кишечная палочка безвредна, но ее наличие также свидетельствует о возможном присутствии болезнетворных бактерий. Количественные показатели определяются коли-тиром, т,е. наименьшим количеством кубических сантиметров воды, содержащим одну кишечную палочку (300 см3), или коли-тестом, т.е. наибольшим количеством кишечных палочек, содержащихся в 1 л воды (<3).
2.2.9 Задание и порядок выполнения работы. По данной работе каждому студенту выдается индивидуальное задание, которое он должен выполнить в соответствии с настоящими методическими указаниями. На примере обработки результатов одного химического анализа воды мы рассмотрим ход выполнения этой работы (табл. 9).
Таблица 9 - Исходные данные
| № скв. | Глу-бина взя-тия пробы, м | pH | Сухой остаток, г/л | Катионы, мг/л | Анионы, мг/л | Тем-пература воды, t0C | Второ-степен. компо-ненты, мг/л | ||||
| Na++ K+ | Ca2+ | Mg2+ | HCO3- | SO42- | Cl- | ||||||
| 25,0 | 6,5 | 33,0 | CO2=18 Br2=0,6 |
Выполнить следующие виды работ:
а) Пересчитать результаты анализа из ионной формы в миллиграмм-эквивалентную и эквивалент-процентную формы и составить таблицу.
б) Оценить воду по степени минерализации.
в) Определить и оценить воду по всем видам жесткости.
г) Оценить воду по pH.
д) Определить и оценить воду по всем видам агрессивности.
е) Произвести классификацию подземных вод по химическому составу.
ж) Выразить химический состав подземных вод в виде:
1) формулы М.Г. Курлова
2) прямоугольника солевого состава
3) треугольников Фере.
з) Оценить пригодность воды для питьевого водоснабжения.
Порядок выполнения работы
а ) Для перерасчета результатов анализа согласно заданию составляется таблица 10.
В природной воде содержание K+ составляет всего 4 – 10% от содержания Na+, поэтому все расчеты производятся по Na+.
Таблица 10 - Порядок пересчета из ионной формы в другие
| Основные ионы | мг/л | мг∙экв/л | экв./проц. | пересчетные коэффициен-ты | прочие определения, мг/л |
| Катионы: Na+ K+ Ca2+ Mg2+ | 482,85 20,96 106,86 | 79,07 3,43 17,50 | 0,0435 0,0256 0,0499 0,0822 | CO2=18,0 Br2=0,6 | |
| ∑ ∑r+ Анионы HCO3- Cl- SO42- ∑ ∑r- Всего | 610,67 1,15 545,67 56,16 602,98 | 0,19 90,50 9,31 | 0,0164 0,0282 0,0208 |
б) Определяем степень минерализации
Таблица 11 - Классификация подземных вод по общей минерализации
| Оценка воды (раствора) | Минерализация г/л |
| Пресная Солоноватая Соленая Горько-соленая Слабые рассолы Крепкие рассолы | До 1 1 – 3 3 – 10 10 – 50 50 – 100 >100 |
Согласно классификации данная вода горько-соленая (М = 34,940 г/л).
в) Определяем все виды жесткости
Общая жесткость равна 20,96 + 106,86 = 127,82 мг-экв/л
Карбонатная жесткость равна 1,15 мг-экв/л
Постоянная жесткость равна 127,82 – 1.15 = 126,67 мг-экв/л
Таблица 12 - Классификация природных вод по общей жесткости
| Оценка воды | Жесткость, мг-экв/л |
| Очень мягкая Мягкая Умеренно-жесткая Жесткая Очень жесткая | До 1,5 1,5 – 3,0 3,0 – 6,0 6,0 – 9,0 >9,0 |
Согласно таблицы 12 данная вода относится к очень жестким.
г) По значению активной реакции определяем pH среду
Таблица 13 - Классификация природных вод по активной реакции
| Признак | Значение pH |
| Весьма кислые Кислые Нейтральные Слабощелочные Высокощелочные | <5 5 – 7 7 – 9 >9 |
Так как в нашем анализе pH = 6,5, данная среда – кислая.
д) Определяем агрессивные свойства данной воды
- так как значение HCO3- равно 1,15 мг-экв/л, т.е меньше 1,5 мг-экв/л, агрессивность выщелачивания присутствует;
- так как pH = 6,5, больше 5,0, общекислотная агрессивность отсутствует;
- в нашем анализе содержание свободной углекислоты составляет 18,0 мг/л. Из таблицы 14 берем значения коэффициентов a = 0,00 и b = 17. Вычисляем по формуле: a∙Ca + b = 17. Так как содержание свободной углекислоты составляет 18,0 мг/л, т.е. больше, чем определенное по формуле, углекислая агрессивность присутствует.
- Так как в данном анализе содержание SO42- составляет 2700 мг/л при содержании Cl- = 19350 мг/л, сульфатная агрессивность присутствует.
- Содержание Mg2+ составляет 1300 мг/л (>1000), применяем формулу К - SO42-, т.е. 7000 – 2700 = 4300, 1300 < 4300. следовательно, магнезиальная агрессивность отсутствует.
е) Классификация подземных вод по химическому составу
Согласно классификации О.А. Алекина приведенная вода относится к хлоридному классу, группа – натриевая, II тип – воды умеренной минерализации.
ж) Выражение химического состава воды
1) Формула М.Г. Курлова, отображающая химический состав данной воды, выглядит следующим образом:
Cl95
М34,94 ∙ Br0,6 ∙ CO18 ∙ ——————— ∙ t140C pH6,5 (5)
Na79 ∙ Mg18
По химическому составу вода хлоридно-натриевая, бромисто-углекислая.
2)

Рисунок 15 - Прямоугольник солевого состава.
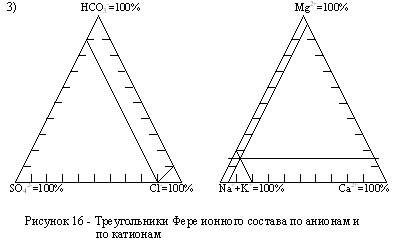
з) Оценка воды для питьевого водоснабжения
Таблица 15 - Нормативы ГОСТ 2874-82
| № | Показатель | ПДК, не более | Данные анализа |
| Активная реакция, pH Сухой остаток, мг/л Общая жесткость, мг∙экв/л Хлориды Cl-, мг/л Сульфаты SO42, мг/л | 6,0 – 9,0 | 6,5 127,82 |
Вывод: Данная вода по сухому остатку, общей жесткости, содержанию хлоридов и сульфатов не подходит для практического применения.
Таблица 14 - Значения коэффициентов «a» и «b» для определения углекислой агрессивности водной среды.
| Карбонат. жестк. мг-экв/л | Суммарное содержание Cl- + SO42- | |||||||||||
| 0 - 200 | 201 -400 | 401 - 600 | 601 - 800 | 801 - 1000 | >1000 | |||||||
| a | b | a | b | a | b | a | b | a | b | b | b | |
| 1,4 1,8 2,1 2,5 2,9 3,2 3,6 4,0 4,3 4,7 5,0 5,4 5,7 6,1 6,4 6,8 7,1 7,5 7,8 8,2 8,6 9,0 | 0,01 0,04 0,07 0,10 0,13 0,16 0,20 0,24 0,28 0,32 0,36 0,40 0,44 0,48 0,54 0,61 0,67 0,74 0,81 0,88 0,96 1,04 | 0,01 0,04 0,06 0,08 0,11 0,14 0,17 0,20 0,24 0,28 0,32 0,36 0,40 0,44 0,47 0,51 0,55 0,60 0,65 0,70 0,76 0,81 | 0,01 0,03 0,05 0,07 0,09 0,11 0,14 0,16 0,19 0,22 0,25 0,29 0,32 0,36 0,40 0,44 0,48 0,53 0,58 0,63 0,68 0,73 | 0,00 0,02 0,04 0,06 0,08 0,10 0,12 0,15 0,17 0,20 0,23 0,26 0,29 0,33 0,36 0,40 0,44 0,48 0,53 0,58 0,63 0,67 | 0,00 0,02 0,04 0,06 0,07 0,09 0,11 0,13 0,16 0,19 0,22 0,24 0,27 0,30 0,33 0,37 0,41 0,45 0,49 0,53 0,57 0,61 | 0,00 0,02 0,04 0,05 0,07 0,08 0,10 0,12 0,14 0,17 0,19 0,22 0,25 0,28 0,31 0,34 0,38 0,41 0,44 0,48 0,52 0,56 |
Вопросы для контроля знаний студентов
1. Перечислите основные физические свойства подземных вод и показатели, которыми они характеризуются.
2. Что входит в понятие «состав подземных вод»?
3. Каковы источники минерализации подземных вод? Что входит в понятие общей минерализации воды?
4. Что называется агрессивной углекислотой? Перечислите все виды агрессивности воды по отношению к бетону.
5. Каковы свойства жесткой воды и в каких единицах выражается жесткость?
6. Почему при кипячении жесткость уменьшается?
7. Какой показатель pH должна иметь вода, чтобы ее можно было отнести к кислотной, активной по отношению к металлам?
8. Как оценивается пригодность воды для питьевых целей? При каком коли-титре вода считается допустимой к употреблению без кипячения?
9. Как проводится пересчет результатов анализа воды из весовой формы в эквивалент-процентную?
10. Чем отличаются минеральные воды от минерализованных?
Список использованных источников
1. Ларионов А.К. Занимательная гидрогеология. – М.: Недра, 1979. – 155 с.
2. Николадзе Г.И. Улучшение качества подземных вод. – М.: Стройиздат, 1988. – 366 с.
3. Пешковский Л.М., Перескокова Т.М. Инженерная геология. – М: Высшая школа, 1982. – 344 с.
4. Седенко М.В. Основы гидрогеологии и инженерной геологии. – М: Недра, 1979. – 216 с.
5. Ташенов К.М. Подготовка технической воды. – А: КазГАСА, 1977. – 173 с.
6. Толстой М.П., Малыгин В.А. Геология и гидрогеологи. – М: Недра, 1988. – 274 с.