Вариант 1
Задание 1. Расчёт равновесных концентраций
1. Учитывая характер диссоциации электролита: А, Б, В, рассчитайте равновесные концентрации ионов Н+, ОН-. Значения Кравн. см. в справочнике.
А – 0,1м NaOH, Б – 0,1м CH3COOH
Решение:
NaOH – сильный электролит, со степенью диссоциации равной единице. Уравнение диссоциации электролита:
NaOH⇄ Na+ + OH–
Согласно уравнению реакции, [OH–] = C(NaOH) = 0,1 M,
[H+]= 1∙10-14/ [OH–] = 1∙10-14/ 0,1 = 1∙10-13 M.
где 1∙10-14 – значение ионного произведения воды, [H+]∙[OH–] = 1∙10-14
CH3COOH – слабый электролит. Константа диссоциации электролита Кравн.=1,75∙10-5. Уравнение диссоциации электролита:
CH3COOH ⇄ CH3COO– + H+
Степень диссоциации электролита связана с константой диссоциации уравнением Освальда:
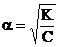
где, К – константа диссоциации,
С – концентрация электролита, моль/л

Концентрация ионов водорода равна: [H+] = α∙С = 0,013∙0,1 = 1,3∙10-3 моль/л
Концентрация гидроксил ионов:
[ОH–]= 1∙10-14/ [H+] = 1∙10-14/1,3∙10-3 = 7,56∙10-12 M.
Задание 2. Равновесные системы.
В каком направлении сместится равновесие в системе А при введении вещества Б? Запишите выражение Крав. для системы А. Запишите уравнение диссоциации вещества Б. Укажите ион, ответственный за смещение равновесия в системе А. Сделайте вывод о направлении смещения равновесия в системе А.
Система А – CH3COOH ⇄ CH3COO-+ H+, вещество Б – CH3COONa
Решение:
Выражение константы равновесия:
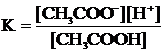
Уравнение диссоциации электролита Б:
CH3COONa ⇄ CH3COO– + Na+
При диссоциации указанного электролита, образуется ион CH3COO–, который ответственен за смещение равновесия в системе А, так как увеличивается концентрация продуктов диссоциаии. При этом равновесие в системе А сместится в сторону образования недиссоциированной кислоты, т.е. в сторону обратной реакции.
Вариант 2
Задание 1. Расчёт равновесных концентраций
Учитывая характер диссоциации электролита: А, Б, В, рассчитайте равновесные концентрации ионов Н+, ОН-. Значения Кравн. см. в справочнике. А – 0,1м HCl, Б – 0,1м NH4OH
Решение:
HCl – сильный электролит, со степенью диссоциации равной единице. Уравнение диссоциации электролита:
HCl ⇄ H+ + Cl –
Согласно уравнению реакции, [H+] = C(HCl) = 0,1 M,
[OH–]= 1∙10-14/ [H+] = 1∙10-14/ 0,1 = 1∙10-13 M.
где 1∙10-14 – значение ионного произведения воды, [H+]∙[OH–] = 1∙10-14
NH4OH – слабый электролит. Константа диссоциации электролита Кравн.=1,79∙10-5. Уравнение диссоциации электролита:
NH4OH ⇄ NH4+ + OH–
Степень диссоциации электролита связана с константой диссоциации уравнением Освальда:
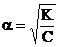
где, К – константа диссоциации,
С – концентрация электролита, моль/л
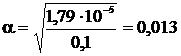
Концентрация ионов гидроксила равна:
[OH–] = α∙С = 0,013∙0,1 = 1,3∙10-3 моль/л
Концентрация ионов водорода:
[H+]= 1∙10-14/ [OH–] = 1∙10-14/1,3∙10-3 = 7,56∙10-12 M.
Задание 2. Равновесные системы.
В каком направлении сместится равновесие в системе А при введении вещества Б? Запишите выражение Крав. для системы А. Запишите уравнение диссоциации вещества Б. Укажите ион, ответственный за смещение равновесия в системе А. Сделайте вывод о направлении смещения равновесия в системе А.
Система А – NH4OH ⇄ NH4+ + OH–, вещество Б – NH4Cl
Решение:
Выражение константы равновесия:
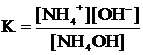
Уравнение диссоциации электролита Б:
NH4Cl ⇄ NH4+ + Cl –
При диссоциации указанного электролита, образуется ион NH4+, который ответственен за смещение равновесия в системе А. При этом равновесие в системе А сместится в сторону образования недиссоциированного основания, т.е. в сторону обратной реакции.
Вариант 3