ОКСИДЫ
Оксиды — сложные вещества, молекулы которых состоят из атомов двух химических элементов, один из которых — кислород. Атом кислорода в оксидах всегда имеет степень окисления –2.
Вопрос: Определите, какое из следующих соединений — оксид:
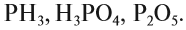
Ответ: Оксидом является последнее соединение — P2O5 (в состав РН3 не входит атом кислорода, а в состав H3PO4 входят атомы трёх химических элементов: H, Р, O).
Оксиды называют по схеме:
Оксид чего? (название элемента).
Например: СаО — оксид кальция.
Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность.
Например: Fe2О3 — оксид железа III, FеО — оксид железа II.
Многие оксиды могут реагировать с кислотами или основаниями. Продуктами таких реакций являются соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов, которые к таким реакциям не способны. Такие оксиды называются несолеобразующими:
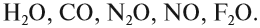
Некоторые оксиды имеют особые (тривиальные) названия:

Солеобразующие оксиды делятся на три группы:
1. основные,
2. кислотные,
3.амфотерные.
Точно установить характер оксида можно, только изучая его химические свойства. Например, кислотные оксиды реагируют с основаниями и не реагируют с кислотами. Основные оксиды реагируют с кислотами и не реагируют с основаниями. Амфотерные оксиды могут реагировать и с кислотами, и с основаниями, причём, реагируя с кислотами, они проявляют свойства основных оксидов, а реагируя с основаниями, — кислотных.
Отсюда вывод: в химических реакциях участвуют вещества с противоположными свойствами:
- основание и кислота;
- металл и неметалл;
- окислитель и восстановитель.
Впрочем, последние два случая мы рассмотрим позднее.
Поэтому, если определить по формуле оксида, какими свойствами он обладает, — можно предсказать, возможна ли эта реакция или нет! Но КАК это сделать? Вот некоторые правила:
- неметаллы образуют только кислотные оксиды*;
- металлы могут образовывать разные оксиды — основные, амфотерные, кислотные — в зависимости от валентности металла.
* Обратите внимание, что и безразличные оксиды образуются только неметаллами.
Предсказать свойства оксида металла может помочь эта схема.
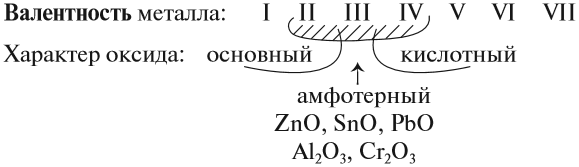
Итак, основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Но как быть с амфотерными оксидами? «Любимая» валентность металлов в этих оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов:
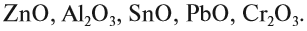
Зная характер оксида, можно описать его свойства.
Свойства кислотных оксидов
1. Кислотные оксиды, кроме SiО2, реагируют c водой, образуя кислоту:
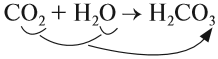
Чтобы составить формулу кислоты, нужно «сложить» все атомы исходных веществ, записывая на первом месте символ водорода, на втором — символ элемента, образующего оксид, и на последнем — символ кислорода. Если индексы получились чётными, их можно сократить:
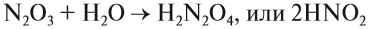
Эти же реакции можно записать в виде «арифметического примера»:
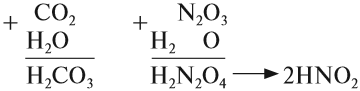
2. Кислотные оксиды реагируют с основными оксидами, образуя соль соответствующей кислоты, т. е. кислоты, которая образуется при взаимодействии этого оксида с водой (см. выше):
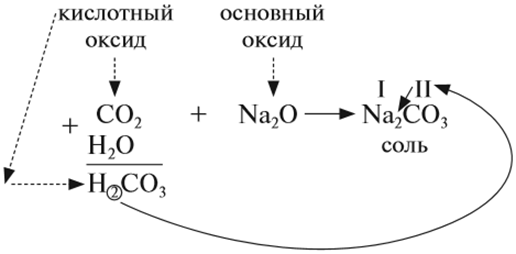
Для того чтобы составить такое уравнение, нужно:
- составить формулу кислоты («прибавив» к молекуле оксида молекулу воды);
- определить валентность кислотного остатка (это часть молекулы кислоты без атомов водорода). В данном случае кислотный остаток имеет состав СО3, его валентность равна числу атомов водорода в кислоте, т. е. II;
- составить формулу соли, записав вместо атомов водорода атом металла из основного оксида с его валентностью (в данном случае — натрий);
- составить формулу соли по валентности металла и кислотного остатка.
3. Кислотные оксиды реагируют с основаниями, образуя соль соответствующей кислоты и воду:
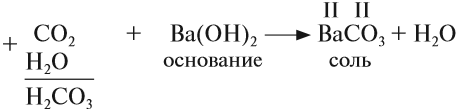
Принципы составления уравнения те же, что и для реакций с основными оксидами (см. пункт 2).
ЗАПОМНИТЕ! Кислотные оксиды и с кислотами и кислотными оксида
НЕ РЕАГИРУЮТ!