Постулаты Бора.
1-й постулат:
электрон в атоме может двигаться только по определенным стационарным орбитам, на которых он не излучает и не поглощает энергию. Момент импульса электрона на этих орбитах кратен постоянной Планка:
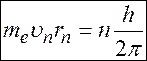 , (1)
, (1)
 – масса электрона,
– масса электрона,  - скорость электрона на орбите с номером
- скорость электрона на орбите с номером  ,
,  – радиус орбиты с номером
– радиус орбиты с номером  ,
,
 =1,2,3,….
=1,2,3,….

 - момент импульса электрона.
- момент импульса электрона.
 Дж·с – постоянная Планка.
Дж·с – постоянная Планка.
 Дж·с.
Дж·с.
2-й постулат:
при переходе электрона с одной орбиты на другую излучается или поглощается фотон с энергией  ,
,
 . (2)
. (2)
 и
и  - энергия электрона в состоянии 1 и 2 (т.е. на орбитах 1 и 2),
- энергия электрона в состоянии 1 и 2 (т.е. на орбитах 1 и 2),
 - частота электромагнитных волн.
- частота электромагнитных волн.

Следствия:
1. Радиус орбиты электрона в атоме водорода.
1-й постулат Бора,  . (3)
. (3)
2-ой закон Ньютона для электрона:
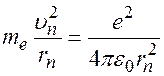 . (4)
. (4)
 - нормальное ускорение,
- нормальное ускорение,  - сила Кулона.
- сила Кулона.
Из (3): 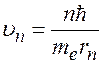 . Подставим в (4):
. Подставим в (4):
 .
.
 .
.
Радиус первой орбиты электрона ( = 1), называется радиусом Бора
= 1), называется радиусом Бора 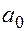 ,
,
 =
= 
 0.53·10-10 м.
0.53·10-10 м.
Радиус 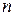 -ой орбиты электрона в атоме водорода
-ой орбиты электрона в атоме водорода
 ,
,  =1,2,3,…. – номер орбиты.
=1,2,3,…. – номер орбиты.
Энергия электрона в атоме водорода.

Кинетическая энергия  ,
,
потенциальная  .
.
Перепишем (4):
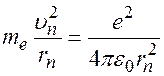 . (4)
. (4)
Из него:
 .
.
Тогда на  –ой орбите энергия электрона
–ой орбите энергия электрона
 =
=  =
= 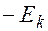 . Также:
. Также:
 =
= 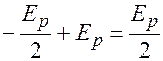 , или
, или
 .
.
Подставим  . Тогда
. Тогда
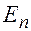 =
=  .
.
Энергия на первой орбите (на первом энергетическом уровне) равна
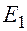 =
= 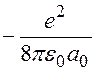 = -13,6 эВ.
= -13,6 эВ.


Величину  = 13,6 эВ = 2,18∙10-18 Дж называют энергией ионизации (эта энергия необходима, чтобы перевести электрон, находящийся на первом уровне, в свободное состояние, т.е. чтобы ионизовать атом). Энергия электрона на
= 13,6 эВ = 2,18∙10-18 Дж называют энергией ионизации (эта энергия необходима, чтобы перевести электрон, находящийся на первом уровне, в свободное состояние, т.е. чтобы ионизовать атом). Энергия электрона на  –ом энергетическом уровне (на
–ом энергетическом уровне (на  –ой орбите):
–ой орбите):
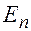 =
= 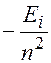 .
.
Спектр излучения водорода.
Энергия излучаемого или поглощаемого кванта:
 .
.
Частота  ,
, 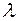 длина волны,
длина волны,  - скорость света в вакууме.
- скорость света в вакууме.
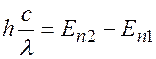 =
=  +
+  =
=  ,
,
 =
=  .
.
 =
=  - формула Бальмера,
- формула Бальмера,
определяет длины волн в спектре атома водорода.
 = 1,1∙107 м-1 - постоянная Ридберга.
= 1,1∙107 м-1 - постоянная Ридберга.
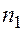 и
и 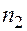 - номера энергетических состояний (номера орбит) электрона.
- номера энергетических состояний (номера орбит) электрона.
Если
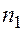 = 1 - излучение атома лежит в УФ области спектра (серия линий Лаймана),
= 1 - излучение атома лежит в УФ области спектра (серия линий Лаймана),
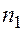 = 2 - излучение в видимой области (серия Бальмера),
= 2 - излучение в видимой области (серия Бальмера),
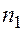 = 3, 4, 5, … - излучение в ИК области.
= 3, 4, 5, … - излучение в ИК области.


Основные положения квантовой механики.
1. Гипотеза де Бройля.
Любая микрочастица, наряду с корпускулярными, обладает также волновыми свойствами. Длина волны микрочастицы

 - длина волны де Бройля,
- длина волны де Бройля,
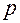 - импульс частицы.
- импульс частицы.
(Для фотона, импульс  . Это было распространено на любую микрочастицу).
. Это было распространено на любую микрочастицу).
Гипотеза де Бройля подтверждена экспериментально.
2. Принцип неопределенностей.
Невозможно одновременно точно определить координату и импульс микрочастицы:
 ,
,
 , (5)
, (5)
 .
.
Ур-я (5) – соотношения неопределенностей.
 ,
,  ,
,  интервал значений координат, в котором может находиться частица,
интервал значений координат, в котором может находиться частица,
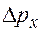 ,
,  ,
,  - интервал значений проекции импульса.
- интервал значений проекции импульса.
Если 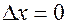 (координата точно известна), то
(координата точно известна), то 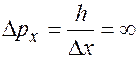 , т.е. импульс не определен.
, т.е. импульс не определен.
Соотношение неопределенностей для энергии-времени:
 .
.
 - время, в течение которого частица имеет энергию, лежащую в интервале
- время, в течение которого частица имеет энергию, лежащую в интервале  =
=  .
.
Атом в квантовой механике.
Состояние электрона в атоме описывается 4-мя квантовыми числами.
 - главное квантовое число,
- главное квантовое число,  = 1,2,3,…. Определяет энергию электрона в атоме.
= 1,2,3,…. Определяет энергию электрона в атоме.
 - орбитальное квантовое число,
- орбитальное квантовое число,  = 0,1,2,…,
= 0,1,2,…,  .
.
 определяет орбитальный момент импульса электрона
определяет орбитальный момент импульса электрона  ,
,  .
.
 - магнитное квантовое число,
- магнитное квантовое число,  = 0,
= 0,  1,
1,  2,…,
2,…, 
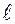 .
.
 определяет проекцию
определяет проекцию 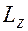 орбитального момента электрона на направление
орбитального момента электрона на направление 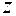 внешнего магнитного поля,
внешнего магнитного поля,
 .
.
 - магнитное спиновое квантовое число,
- магнитное спиновое квантовое число,  .
.
 определяет проекцию
определяет проекцию  собственного момента электрона на направление
собственного момента электрона на направление 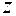 внешнего магнитного поля,
внешнего магнитного поля,
 .
.
Застройка электронной оболочки атома отражена двумя принципами.
1. Принцип (запрет) Паули: любые два электрона в атоме различаются значениями хотя бы одного квантового числа.
2. Принцип минимума энергии: из всех возможных, осуществляется такая конфигурация электронной оболочки, которая соответствует минимальной энергии атома.