1. ФЭК, СФМ по обеим цветным реакциям.
2. Комплексонометрия.
Количественное определение:12
1. ФЭК, СФМ по обеим цветным реакциям. 2. Комплексонометрия.
|
ГЕРОИН

 Метаболизм
Пробоподготовка
Метод Крамаренко
100 г измельченных органов заливают раствором серной кислоты оставляют на 2 ч при периодическом перемешивании. Кислые водные вытяжки из биологического материала соединяют. К центрифугату прибавляют кристаллический сульфат аммония. Образующийся осадок примесей отделяют от жидкости центрифугированием. Подкисленную жидкость дважды взбалтывают с диэтиловым эфиром. Эфирные вытяжки, содержащие примеси, отделяют от кислой водной фазы и в дальнейшем не исследуют.
Кислую водную фазу подщелачивают раствором гидроксида натрия и 3 раза взбалтывают с хлороформом Хлороформные вытяжки соединяют, профильтровывают и на водяной бане отгоняют хлороформ до небольшого объема. Оставшийся хлороформ выпаривают на воздухе досуха. Сухой остаток растворяют в растворе соляной кислоты. В полученном растворе проверяют наличие алкалоидов.
Обнаружение героина
1)Реакции с реактивами группового осаждения алкалоидов.
Героин дает осадки с реактивами группового осаждения алкалоидов (реактивы Бушарда, Драгендорфа, Майера, Зонненшейна и др.).
2)Цветные реакции. Героин дает окраску с концентрированной азотной кислотой, реактивами Манделина, Марки, Фреде и Эрдмана.
3)Реакция с хлоридом железа (Ш).
При наличии героина появляется синяя окраска.
4)Реакция с йодноватой кислотой (НIO 3).
выделяется свободный иод, который при взбалтывании с хлороформом переходит в хлороформный слой, окрашивая его в фиолетовый цвет.
5)Метод хроматографии.
На линию старта на хроматографической пластинке наносят 1—2 капли хлороформной вытяжки. Правее на расстоянии 2—3 см на линию старта наносят каплю раствора «свидетеля» (0,01 %-й раствор героина в хлороформе). Пятна на пластинке подсушивают на воздухе. Затем пластинку вносят в камеру для хроматографирования, насыщенную парами растворителей (эфир — ацетон — 25 %-ый аммиак в соотношении 40: 20: 2). Камеру плотно закрывают крышкой. После того как система растворителей поднимется на 10 см выше линии старта, пластинку вынимают из камеры, подсушивают на воздухе и опрыскивают реактивом Драгендорфа, модифицированным по Мунье.
При наличии героина пятна этого алкалоида на хроматографической пластинке приобретают розовато-бурую окраску (Rf = 0,18±0,01).
6)Обнаружение героина по УФ- и ИК-спектрам.
Количественное определение ВЭЖХ-анализ Метаболизм
Пробоподготовка
Метод Крамаренко
100 г измельченных органов заливают раствором серной кислоты оставляют на 2 ч при периодическом перемешивании. Кислые водные вытяжки из биологического материала соединяют. К центрифугату прибавляют кристаллический сульфат аммония. Образующийся осадок примесей отделяют от жидкости центрифугированием. Подкисленную жидкость дважды взбалтывают с диэтиловым эфиром. Эфирные вытяжки, содержащие примеси, отделяют от кислой водной фазы и в дальнейшем не исследуют.
Кислую водную фазу подщелачивают раствором гидроксида натрия и 3 раза взбалтывают с хлороформом Хлороформные вытяжки соединяют, профильтровывают и на водяной бане отгоняют хлороформ до небольшого объема. Оставшийся хлороформ выпаривают на воздухе досуха. Сухой остаток растворяют в растворе соляной кислоты. В полученном растворе проверяют наличие алкалоидов.
Обнаружение героина
1)Реакции с реактивами группового осаждения алкалоидов.
Героин дает осадки с реактивами группового осаждения алкалоидов (реактивы Бушарда, Драгендорфа, Майера, Зонненшейна и др.).
2)Цветные реакции. Героин дает окраску с концентрированной азотной кислотой, реактивами Манделина, Марки, Фреде и Эрдмана.
3)Реакция с хлоридом железа (Ш).
При наличии героина появляется синяя окраска.
4)Реакция с йодноватой кислотой (НIO 3).
выделяется свободный иод, который при взбалтывании с хлороформом переходит в хлороформный слой, окрашивая его в фиолетовый цвет.
5)Метод хроматографии.
На линию старта на хроматографической пластинке наносят 1—2 капли хлороформной вытяжки. Правее на расстоянии 2—3 см на линию старта наносят каплю раствора «свидетеля» (0,01 %-й раствор героина в хлороформе). Пятна на пластинке подсушивают на воздухе. Затем пластинку вносят в камеру для хроматографирования, насыщенную парами растворителей (эфир — ацетон — 25 %-ый аммиак в соотношении 40: 20: 2). Камеру плотно закрывают крышкой. После того как система растворителей поднимется на 10 см выше линии старта, пластинку вынимают из камеры, подсушивают на воздухе и опрыскивают реактивом Драгендорфа, модифицированным по Мунье.
При наличии героина пятна этого алкалоида на хроматографической пластинке приобретают розовато-бурую окраску (Rf = 0,18±0,01).
6)Обнаружение героина по УФ- и ИК-спектрам.
Количественное определение ВЭЖХ-анализ
| ТИОРИДАЗИН
 В-ва,изолируемые экстракцией полярными растворителями и сорбцией(фенотиазины)
Метаболизм фенотиазинов протекает в 3-х направлениях:
1 путь - трансформация в радикалах R1 и R2
а)N-O-S-деметилирование, которое приводит к увеличению полярности соединений;
б)окисление N10-боковой цепи.
2 путь - сульфоокисление
Сульфоокисление - образование сульфоксидов со степенью окисления 4 и 6.
В-ва,изолируемые экстракцией полярными растворителями и сорбцией(фенотиазины)
Метаболизм фенотиазинов протекает в 3-х направлениях:
1 путь - трансформация в радикалах R1 и R2
а)N-O-S-деметилирование, которое приводит к увеличению полярности соединений;
б)окисление N10-боковой цепи.
2 путь - сульфоокисление
Сульфоокисление - образование сульфоксидов со степенью окисления 4 и 6.
 3 путь - ароматическое гидроксилирование в положениях 3, 6 с последующим конъюгировапием с глюкуроновой кислотой.
3 путь - ароматическое гидроксилирование в положениях 3, 6 с последующим конъюгировапием с глюкуроновой кислотой.
 Фотометрия в видимой области спектра
В основу этих методов положено измерение поглощения окрашенных продуктов реакции пр.фенотиазина:
-с конц. H2SO4 –
-с реактивом Манделина и конц. H2SO4.
Фотометрия в УФ-области спектра
Выделение из биологического материала (метод Соломатина)
соединения основного характера
Биоматериал + 100% этанол + щавелевая кислота à образование растворимых в воде оксалатов фенотиазинов à настаивают 3 раза по 2 часа à вытяжка à упаривание + 100% спирт à очищенный от белков раствор à упаривание + вода à фильтрование à очищенный раствор + эфир à органическая фаза à исследование на фенотиазины.
Изолирование из мочи и крови
Раздельно 5-10 мл мочи и 2 мл крови + NaOHà 10 минут на водяной бане à гидролизат à охлаждается до комнатной температуры и дважды извлекается н-гептаном, содержащим 3% изоамилового спирта à промывают водой, насыщенной гептаном и делят на две равные части à в одной части проводится обнаружение производных фенотиазина методом тонкослойной хроматографии, а в другой – количественное определение.
Качественное обнаружение.
3.С растворами йодида висмута в йодиде калия и фосфорно-молибденовой кислоты получаются аморфные осадки.
4.С концентрированной серной кислотой возникает устойчивое пурпурно-красное окрашивание.
4. С формалинсерной кислотой аминазин дает пурпурно-красное окрашивание, усиливающееся при стоянии.
5. С концентрированной азотной кислотой возникает быстро исчезающее пурпурно-красное окрашивание.
Качественный анализ
а) Реакции осаждения
+общеалкалоидные осадающие реактивы (часто реактив Драгендорфа) +соль Рейнеке, Bi, Au
б) Микрокристаллические реакции
+5% раствор хлорного золота дает характерные кристаллические осадки +соль Рейнеке дает характерные кристаллические осадки
4) окисление солями металлов, имеющих высшую степень окисления(FeCl3иHPtCl4).
+ HPtCl4 → фиолетовый осадок; Тиоридазин – серо-розовый осадок;
Количественное определение
ФЭК
Фотометрия в видимой области спектра
В основу этих методов положено измерение поглощения окрашенных продуктов реакции пр.фенотиазина:
-с конц. H2SO4 –
-с реактивом Манделина и конц. H2SO4.
Фотометрия в УФ-области спектра
Выделение из биологического материала (метод Соломатина)
соединения основного характера
Биоматериал + 100% этанол + щавелевая кислота à образование растворимых в воде оксалатов фенотиазинов à настаивают 3 раза по 2 часа à вытяжка à упаривание + 100% спирт à очищенный от белков раствор à упаривание + вода à фильтрование à очищенный раствор + эфир à органическая фаза à исследование на фенотиазины.
Изолирование из мочи и крови
Раздельно 5-10 мл мочи и 2 мл крови + NaOHà 10 минут на водяной бане à гидролизат à охлаждается до комнатной температуры и дважды извлекается н-гептаном, содержащим 3% изоамилового спирта à промывают водой, насыщенной гептаном и делят на две равные части à в одной части проводится обнаружение производных фенотиазина методом тонкослойной хроматографии, а в другой – количественное определение.
Качественное обнаружение.
3.С растворами йодида висмута в йодиде калия и фосфорно-молибденовой кислоты получаются аморфные осадки.
4.С концентрированной серной кислотой возникает устойчивое пурпурно-красное окрашивание.
4. С формалинсерной кислотой аминазин дает пурпурно-красное окрашивание, усиливающееся при стоянии.
5. С концентрированной азотной кислотой возникает быстро исчезающее пурпурно-красное окрашивание.
Качественный анализ
а) Реакции осаждения
+общеалкалоидные осадающие реактивы (часто реактив Драгендорфа) +соль Рейнеке, Bi, Au
б) Микрокристаллические реакции
+5% раствор хлорного золота дает характерные кристаллические осадки +соль Рейнеке дает характерные кристаллические осадки
4) окисление солями металлов, имеющих высшую степень окисления(FeCl3иHPtCl4).
+ HPtCl4 → фиолетовый осадок; Тиоридазин – серо-розовый осадок;
Количественное определение
ФЭК
| ВИСМУТ
В-ва,изолируемые методом минерализации (металлические яды) Кумулируется в головном мозге, печени, почках, селезенке. Выводится с мочой, потом, через ЖКТ.
Изолирование: смесью двух кислот.
Исследование минерализатов на наличие висмута Для обнаружения висмута в минерализатах вначале выполняют предварительные реакции на ионы этого металла с тиомочевиной и оксином (8-оксихинолином). При положительном результате этих реакций висмут выделяют из минерализата в виде диэтилдитиокарбамата, который экстрагируют хлороформом. После прибавления кислоты к хлороформной вытяжке происходит разложение диэтилдитиокарбамата висмута. Образовавшиеся при этом ионы висмута переходят в водную фазу, которую используют для обнаружения указанных ионов при помощи соответствующих реакций.
Реакция с тиомочевиной. При взаимодействии ионов висмута с тиомочевиной могут образовываться различного состава тиомочевинные комплексы, имеющие лимонно-желтую окраску:
 Реакции образования тиомочевинных комплексов висмута мешают окислители.
Предел обнаружения: 0,4 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала.
Реакция с оксином основана на переведении ионов висмута в ацидокомплекс [ВiI 4 ] -, который при взаимодействии с оксином в кислой среде образует оранжево-красный осадок, представляющий собой ионный ассоциат (иодвисмутат оксина). Образование этого ионного ассоциата можно представить следующими уравнениями:
Реакции образования тиомочевинных комплексов висмута мешают окислители.
Предел обнаружения: 0,4 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала.
Реакция с оксином основана на переведении ионов висмута в ацидокомплекс [ВiI 4 ] -, который при взаимодействии с оксином в кислой среде образует оранжево-красный осадок, представляющий собой ионный ассоциат (иодвисмутат оксина). Образование этого ионного ассоциата можно представить следующими уравнениями:

 Предел обнаружения: 5 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала.
Если реакция дает положительный эффект, то проводят реэкстракцию.
Bi2(SO4)3 + 6ДДТКNa à 2(ДДТК)3Bi + 3Na2SO4
Хлороформный слой, содержащий (ДДТК)3Bi, отделяют, добавляют HNO3
(ДДТК)3Bi + HNO3 à Bi(NO3)3 + 3ДДТКН
С реэкстрактом проводят реакции:
Выделение ионов висмута из минерализата.К минерализату прибавляют раствор диэтилдитиокарбамата натрия. При этом ионы
висмута с этим реактивом образуют внутрикомплексное соединение:
Предел обнаружения: 5 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала.
Если реакция дает положительный эффект, то проводят реэкстракцию.
Bi2(SO4)3 + 6ДДТКNa à 2(ДДТК)3Bi + 3Na2SO4
Хлороформный слой, содержащий (ДДТК)3Bi, отделяют, добавляют HNO3
(ДДТК)3Bi + HNO3 à Bi(NO3)3 + 3ДДТКН
С реэкстрактом проводят реакции:
Выделение ионов висмута из минерализата.К минерализату прибавляют раствор диэтилдитиокарбамата натрия. При этом ионы
висмута с этим реактивом образуют внутрикомплексное соединение:
 Микрокристаллические реакции:
Реакция с бруциноми бромидом калия. На сухой остаток наносят каплю 2 н. раствора азотной кислоты, а затем прибавляют каплю насыщенного раствора бруцина в 1 н. серной кислоте и каплю 5%-го раствора бромида калия. При наличии ионов висмута сразу же или через несколько минут образуются желто-зеленые кристаллы, собранные в виде сфероидов.
Реакция с хлоридом цезия и иодидом калия.На сухой остаток наносят 1—2 капли 3 н. раствора соляной кислоты. Затем с одной стороны жидкости на предметном стекле помещают кристаллик хлорида цезия CsCl, а с другой — кристаллик иодида калия. Нанесенные кристаллики реактивов с помощью тонкой стеклянной палочки соединяют с жидкостью. При наличии ионов висмута в растворе образуются оранжево-красные кристаллы Cs[BiI 4 ], имеющие форму шестиугольников или шестилучевых звездочек. Предел обнаружения: 0,1 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала.
Реакция с тиомочевиной.В пробирку вносят 0,5 мл водной фазы, к которой прибавляют 0,5 мл насыщенного раствора тиомочевины. В пр Bi2(SO4)3 + nS=O(NH2)2 à Bi2(SO4)3 • nS=O(NH2)2
исутствии ионов висмута появляется лимонно-желтая окраска. n=3-9
Количественное определение основано на выделении висмута из минерализата экстракцией в виде В1(ДДТК)з в щелочной среде, реэкстракции в водный слой азотной кислоты и определении
а) объемным методом — титрованием комплексоном III (трилоном) в присутствии тиомочевины (или пирокатсхипового фиолетового). Граница определения 1 мг. КОМПЛЕКСОНОМЕТРИЯ
б) Фотоколоримстричсским методом по комплексу висмута с тиомочевинной. Оптическая плотность измеряется при Х = 470 нм
Микрокристаллические реакции:
Реакция с бруциноми бромидом калия. На сухой остаток наносят каплю 2 н. раствора азотной кислоты, а затем прибавляют каплю насыщенного раствора бруцина в 1 н. серной кислоте и каплю 5%-го раствора бромида калия. При наличии ионов висмута сразу же или через несколько минут образуются желто-зеленые кристаллы, собранные в виде сфероидов.
Реакция с хлоридом цезия и иодидом калия.На сухой остаток наносят 1—2 капли 3 н. раствора соляной кислоты. Затем с одной стороны жидкости на предметном стекле помещают кристаллик хлорида цезия CsCl, а с другой — кристаллик иодида калия. Нанесенные кристаллики реактивов с помощью тонкой стеклянной палочки соединяют с жидкостью. При наличии ионов висмута в растворе образуются оранжево-красные кристаллы Cs[BiI 4 ], имеющие форму шестиугольников или шестилучевых звездочек. Предел обнаружения: 0,1 мкг висмута в пробе. Граница обнаружения: 0,1 мг висмута в 100 г биологического материала.
Реакция с тиомочевиной.В пробирку вносят 0,5 мл водной фазы, к которой прибавляют 0,5 мл насыщенного раствора тиомочевины. В пр Bi2(SO4)3 + nS=O(NH2)2 à Bi2(SO4)3 • nS=O(NH2)2
исутствии ионов висмута появляется лимонно-желтая окраска. n=3-9
Количественное определение основано на выделении висмута из минерализата экстракцией в виде В1(ДДТК)з в щелочной среде, реэкстракции в водный слой азотной кислоты и определении
а) объемным методом — титрованием комплексоном III (трилоном) в присутствии тиомочевины (или пирокатсхипового фиолетового). Граница определения 1 мг. КОМПЛЕКСОНОМЕТРИЯ
б) Фотоколоримстричсским методом по комплексу висмута с тиомочевинной. Оптическая плотность измеряется при Х = 470 нм
|
ХЛОРОФОРМ
В-ва,изолируемые переводом в паровую фазу(летучие яды)
Метаболизм. Хлороформ, поступивший в организм, быстро исчезает из крови. Через 15—20 мин с выдыхаемым воздухом в неизмененном виде выделяется 30—50 % хлороформа. В течение часа через легкие выделяется до 90 % хлороформа, поступившего в организм. Однако еще и через 8 ч в крови можно обнаружить незначительные количества хлороформа. Часть хлороформа подвергается биотрансформации. При этом в качестве метаболитов образуются оксид углерода (IV) и хлороводород. При химико-токсикологических исследованиях основными объектами анализа на наличие хлороформа в организме являются выдыхаемый воздух, богатые жирами ткани трупов и печень.
Изолирование: макро и микродистилляция. ГЖХ на колонках различной полярности (детектор ДИП или детектор электронного захвата) или хромато-масспектрометрия по изотопам галогенов.
Обнаружение хлороформа
Реакция отщепления хлора. (“+”СХЗ) – белый осадок или белая муть, опалесценция.
При нагревании хлороформа со спиртовым раствором щелочи происходит отщепление атомов хлора, которые можно обнаружить при помощи реакции с нитратом серебра:
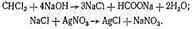 Перед выполнением этой реакции необходимо убедиться в том, что в исследуемом растворе (дистилляте) и в реактивах отсутствуют ионы хлора.
Реакция Фудживара. Хлороформ и ряд других галогенсодержащих соединений можно обнаружить при помощи реакции Фудживара, которая основана на взаимодействии этих веществ с пиридином в присутствии щелочи. При взаимодействии хлороформа с пиридином и щелочью образуется полиметиновый краситель. При этой реакции вначале образуется соль пиридиния:
Перед выполнением этой реакции необходимо убедиться в том, что в исследуемом растворе (дистилляте) и в реактивах отсутствуют ионы хлора.
Реакция Фудживара. Хлороформ и ряд других галогенсодержащих соединений можно обнаружить при помощи реакции Фудживара, которая основана на взаимодействии этих веществ с пиридином в присутствии щелочи. При взаимодействии хлороформа с пиридином и щелочью образуется полиметиновый краситель. При этой реакции вначале образуется соль пиридиния:
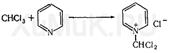 Под влиянием щелочи соль пиридиния превращается в производное глутаконового альдегида (I), при гидролизе которого образуется глутаконовый альдегид (II), имеющий розовую окраску: Под влиянием щелочи соль пиридиния превращается в производное глутаконового альдегида (I), при гидролизе которого образуется глутаконовый альдегид (II), имеющий розовую окраску:
 Описано два варианта реакции Фудживара. При использовании первого варианта наблюдают окраску образовавшегося глутаконового альдегида. При втором варианте этой реакции к образовавшемуся глутаконовому альдегиду прибавляют ароматический амин или другое соединение, содержащее подвижный атом водорода, а затем наблюдают окраску.
Реакция с резорцином. (“–“ СХЗ)При нагревании хлороформа с резорцином в присутствии щелочи появляется розовая или малиново-красная окраска.
Реакция образования изонитрила. При нагревании хлороформа с первичными аминами и щелочью образуется изонитрил (карбиламин), имеющий неприятный запах:
Описано два варианта реакции Фудживара. При использовании первого варианта наблюдают окраску образовавшегося глутаконового альдегида. При втором варианте этой реакции к образовавшемуся глутаконовому альдегиду прибавляют ароматический амин или другое соединение, содержащее подвижный атом водорода, а затем наблюдают окраску.
Реакция с резорцином. (“–“ СХЗ)При нагревании хлороформа с резорцином в присутствии щелочи появляется розовая или малиново-красная окраска.
Реакция образования изонитрила. При нагревании хлороформа с первичными аминами и щелочью образуется изонитрил (карбиламин), имеющий неприятный запах:
 Реакция с реактивом Фелинга.При взаимодействии хлорофор ма со щелочью образуется соль муравьиной (формиатной) кислоты: Реакция с реактивом Фелинга.При взаимодействии хлорофор ма со щелочью образуется соль муравьиной (формиатной) кислоты:
 Реактив Фелинга, содержащий внутрикомплексное соединение K 2 Na 2 [Cu(С 4 Н 3 O 6) 2 ], которое образуется при взаимодействии ионов меди (II) с сегнетовой солью, при нагревании окисляет муравьиную кислоту и ее соли. В результате реакции выпадает красного цвета осадок оксида меди (I): Реактив Фелинга, содержащий внутрикомплексное соединение K 2 Na 2 [Cu(С 4 Н 3 O 6) 2 ], которое образуется при взаимодействии ионов меди (II) с сегнетовой солью, при нагревании окисляет муравьиную кислоту и ее соли. В результате реакции выпадает красного цвета осадок оксида меди (I):

| НИТРОЗЕПАМ
 В-ва,изолируемые экстракцией полярными растворителями и сорбцией(1,4-бензодиазепины) (щелочн св-ва)
T1|2 = 18-38 часов.
Нитразепам — светло-желтый или светло-желтый с зеленым оттенком кристаллический порошок. Практически нерастворим в этиловом спирте и хлороформе.
Нитразепам оказывает транквилизирующее, мышечно-расслабляющее, снотворное действие и т. д. Он усиливает снотворное действие других снотворных средств и анальгетиков. Применяется при нарушении сна, неврозах, психопатиях.
Метаболизм. Метаболитами нитразепама являются 7-амино-метаболит, 7-ацетиламино-метаболит. В течение 48 ч из организма выделяется около 23 % принятой дозы нитразепама. В неизмененном виде с мочой выделяется около 5 % этого препарата. Свыше 8 % нитразепама выделяется с мочой в виде 7-амино- метаболита и около 10%—в виде 7-ацетиламино-метаболита. Часть неизмененного нитразепама может быть обнаружена в кале.
Выделение из биологического материала.
Биологический материал трижды настаивают с насыщенным раствором щавелевой кислоты (рН=1) à Через 1 ч после каждого настаивания вытяжки отделяют от биологического материала центрифугированием à кислый центрифугат трижды взбалтывают со смесью хлороформа и этилацетата à кислый центрифугат подщелачивают до рН = 10 à трижды взбалтывают с новыми порциями смеси хлороформа и этилацетата à исследование на наличие нитразепама.
Предварительные пробы на наличие в моче.
5 мл мочи + аммиак до рН=10 + 250 г дитионита натрия (Na2S2O4) à взбалтывают 10 мин à нагревают при 50 °С в течение часа и охлаждают à жидкость 10 мин взбалтывают с 10 мл смеси (метиленхлорида и этилацетата) à от водной фазы отделяют слой смеси органических растворителей à взбалтывают с 10 мл 5 %-го раствора буры à фаза органических растворителей à + 5 мл 0,2 н. раствора соляной кислоты à взбалтывают à органические растворители.
4 мл кислой водной фазы охлаждают в ледяной воде + 0,2 мл 0,4 н. раствора нитрита натрия à + 0,2 мл 2%-го раствора сульфамината аммония à перемешивают à + 0,2 мл 0,4 %-го раствора N-1-нафтилэтилендиамина дигидрохлорида à вишнево-красная окраска.
Выделение метаболитов нитразепама из мочи.
5 мл мочи + аммиак до рН=10 à взбалтывают 10 мин à нагревают при 50 °С в течение часа и охлаждают à жидкость 10 мин взбалтывают с 10 мл смеси (метиленхлорида и этилацетата) à от водной фазы отделяют слой смеси органических растворителей à взбалтывают с 10 мл 5 %-го раствора буры à фаза органических растворителей à + 5 мл 0,2 н. раствора соляной кислоты à взбалтывают à органические растворители.
4 мл кислой водной фазы охлаждают в ледяной воде + 0,2 мл 0,4 н. раствора нитрита натрия à + 0,2 мл 2%-го раствора сульфамината аммония à перемешивают à + 0,2 мл 0,4 %-го раствора N-1-нафтилэтилендиамина дигидрохлорида à вишнево-красная окраска.
Обнаружение нитразепама и его метаболитов методом хроматографии.
ПФ: силикагель/силуфол
НФ: этилацетат: метилен: аммиак
Д: р-в Драгендорфа
Обнаружение по УФ- и ИК-спектрам.
Раствор нитразепама в этиловом спирте имеет максимумы поглощения при 218 и 260 нм, в 0,1 и. растворе серной кислоты имеет максимум поглощения при 277 нм и изгиб около 340 нм; нитразепам в ИК-области спектра (диск с бромидом калия) имеет основные пики при 1692, 1615, 1352 и 702 см -1.
Изолирование: Стаса-Отто или Васильевой. М.б. в кислом и щелочном CHCl3 извл-ях.
Анализ: 1. по продуктам метаболизма: а) б/м настаивают с подкисленной водой или спиртом, экстрагируют CHCl3, к водному слою доб-т NH4OH до pH=9-10, снова экстр-т CHCl3. CHCl3 объед-т, выпаривают досуха, сух-й ост-к подвергают гидролизу H2SO4 или HCl. б) б/ж + HCl или H2SO4 (г-з) до бензофенонов.
К.О.: 1. после ТСХ с пластинки элюируют ацетонитрилом, испаряют, к сух-у ост-ку гептан и иссл-т м-дом ГЖХ и кач-но и кол-но. 2. ВЖХ – УФ детекция. 3. УФ спектроскопия в EtOH. 4. ФКМ по р-ии Братона-Маршала.
Анализ по нативной мол-ле: изол-е общее (Стас-Отто, Васильева), экстр-т CHCl3, pH=10, очистка м-м ТСХ, элюируют с пластинки и вновь наносят на пластинку со свидетелями. Обр-т HClр, в термостат, + р-р NaNO3 в HCl, удал-м изб NaNO2 cульфонатом аммония, обр-м α-нафтилэтиленамином – в местах локализации – окраш-е
В-ва,изолируемые экстракцией полярными растворителями и сорбцией(1,4-бензодиазепины) (щелочн св-ва)
T1|2 = 18-38 часов.
Нитразепам — светло-желтый или светло-желтый с зеленым оттенком кристаллический порошок. Практически нерастворим в этиловом спирте и хлороформе.
Нитразепам оказывает транквилизирующее, мышечно-расслабляющее, снотворное действие и т. д. Он усиливает снотворное действие других снотворных средств и анальгетиков. Применяется при нарушении сна, неврозах, психопатиях.
Метаболизм. Метаболитами нитразепама являются 7-амино-метаболит, 7-ацетиламино-метаболит. В течение 48 ч из организма выделяется около 23 % принятой дозы нитразепама. В неизмененном виде с мочой выделяется около 5 % этого препарата. Свыше 8 % нитразепама выделяется с мочой в виде 7-амино- метаболита и около 10%—в виде 7-ацетиламино-метаболита. Часть неизмененного нитразепама может быть обнаружена в кале.
Выделение из биологического материала.
Биологический материал трижды настаивают с насыщенным раствором щавелевой кислоты (рН=1) à Через 1 ч после каждого настаивания вытяжки отделяют от биологического материала центрифугированием à кислый центрифугат трижды взбалтывают со смесью хлороформа и этилацетата à кислый центрифугат подщелачивают до рН = 10 à трижды взбалтывают с новыми порциями смеси хлороформа и этилацетата à исследование на наличие нитразепама.
Предварительные пробы на наличие в моче.
5 мл мочи + аммиак до рН=10 + 250 г дитионита натрия (Na2S2O4) à взбалтывают 10 мин à нагревают при 50 °С в течение часа и охлаждают à жидкость 10 мин взбалтывают с 10 мл смеси (метиленхлорида и этилацетата) à от водной фазы отделяют слой смеси органических растворителей à взбалтывают с 10 мл 5 %-го раствора буры à фаза органических растворителей à + 5 мл 0,2 н. раствора соляной кислоты à взбалтывают à органические растворители.
4 мл кислой водной фазы охлаждают в ледяной воде + 0,2 мл 0,4 н. раствора нитрита натрия à + 0,2 мл 2%-го раствора сульфамината аммония à перемешивают à + 0,2 мл 0,4 %-го раствора N-1-нафтилэтилендиамина дигидрохлорида à вишнево-красная окраска.
Выделение метаболитов нитразепама из мочи.
5 мл мочи + аммиак до рН=10 à взбалтывают 10 мин à нагревают при 50 °С в течение часа и охлаждают à жидкость 10 мин взбалтывают с 10 мл смеси (метиленхлорида и этилацетата) à от водной фазы отделяют слой смеси органических растворителей à взбалтывают с 10 мл 5 %-го раствора буры à фаза органических растворителей à + 5 мл 0,2 н. раствора соляной кислоты à взбалтывают à органические растворители.
4 мл кислой водной фазы охлаждают в ледяной воде + 0,2 мл 0,4 н. раствора нитрита натрия à + 0,2 мл 2%-го раствора сульфамината аммония à перемешивают à + 0,2 мл 0,4 %-го раствора N-1-нафтилэтилендиамина дигидрохлорида à вишнево-красная окраска.
Обнаружение нитразепама и его метаболитов методом хроматографии.
ПФ: силикагель/силуфол
НФ: этилацетат: метилен: аммиак
Д: р-в Драгендорфа
Обнаружение по УФ- и ИК-спектрам.
Раствор нитразепама в этиловом спирте имеет максимумы поглощения при 218 и 260 нм, в 0,1 и. растворе серной кислоты имеет максимум поглощения при 277 нм и изгиб около 340 нм; нитразепам в ИК-области спектра (диск с бромидом калия) имеет основные пики при 1692, 1615, 1352 и 702 см -1.
Изолирование: Стаса-Отто или Васильевой. М.б. в кислом и щелочном CHCl3 извл-ях.
Анализ: 1. по продуктам метаболизма: а) б/м настаивают с подкисленной водой или спиртом, экстрагируют CHCl3, к водному слою доб-т NH4OH до pH=9-10, снова экстр-т CHCl3. CHCl3 объед-т, выпаривают досуха, сух-й ост-к подвергают гидролизу H2SO4 или HCl. б) б/ж + HCl или H2SO4 (г-з) до бензофенонов.
К.О.: 1. после ТСХ с пластинки элюируют ацетонитрилом, испаряют, к сух-у ост-ку гептан и иссл-т м-дом ГЖХ и кач-но и кол-но. 2. ВЖХ – УФ детекция. 3. УФ спектроскопия в EtOH. 4. ФКМ по р-ии Братона-Маршала.
Анализ по нативной мол-ле: изол-е общее (Стас-Отто, Васильева), экстр-т CHCl3, pH=10, очистка м-м ТСХ, элюируют с пластинки и вновь наносят на пластинку со свидетелями. Обр-т HClр, в термостат, + р-р NaNO3 в HCl, удал-м изб NaNO2 cульфонатом аммония, обр-м α-нафтилэтиленамином – в местах локализации – окраш-е
| ДИПРАЗИН
 В-ва,изолируемые экстракцией полярными растворителями и сорбцией (фенотиазины)(щелочн св-ва)
Дипразин (пипольфен, прометазин, протазии и др.) — белый кристаллический порошок, легкорастворимый в воде и этиловом спирте, хлороформе (1: 2), почти не растворим в диэтиловом эфире.
Дипразин экстрагируется органическими растворителями из щелочной среды.
Дипразин имеет выраженную противогистаминную активность. Он обладает седативным действием, усиливает действие наркотических, снотворных и анальгезирующих средств. Дипразин применяется для лечения аллергических заболеваний, зудящих дерматозов, хореи, энцефалита и др.
Главным метаболитом дипразина является сульфоксид этого препарата. Часть дипразина в неизмененном виде выделяется с мочой. Кроме этого, с мочой выделяется и сульфоксид дипразина, который можно обнаружить в моче даже через 14 сут после приема указанного препарата.
Выделение из биологического материала (по Б. М. Саломатину).
100 г измельченного биологического материала + этиловый спирт, подкисленным 10% р-м щавелевой кислоты до рН = 2...3. à кислые спиртовые вытяжки на водяной бане (при 40 °С) упаривают до густоты сиропа à + 96° этиловым спиртом à фильтруют à выпаривают досуха + 100 мл воды (темп. 40—60 °С) à жидкость охлаждают и фильтруют à + 5 % р-р щавелевой кислоты до рН = 2...3 + диэтиловый эфир (по 50 мл 2 раза) + 50%-м р-м гидроксида натрия до рН = 13 + 4 порции диэтилового à объединенные эфирные вытяжки + 0,5 н р-р серной кислоты à водные вытяжки соединяют и нагревают 3 мин на водяной бане (темп. 50—60 °С) à кислые водные вытяжки используют для обнаружения.
Обнаружение дипразина
· Реакция с концентрированной серной кислотой. Дипразин с концентрированной серной кислотой дает пурпурно-красную окраску.
· Реакция с концентрированной азотной кислотой. При взаимодействии дипразина с концентрированной азотной кислотой появляется бледная пурпурно-красная окраска, переходящая в желтую.
· Реакция с концентрированной соляной кислотой. Дипразин с концентрированной соляной кислотой дает розовато-фиолетовую окраску, переходящую в пурпурно-фиолетовую.
· Реакция Витали — Морена.
· Реакция с реактивом Марки. Дипразин с реактивом Марки дает пурпурную окраску.
· Реакция с реактивом Манделина. Реактив Манделина с Дй-празином дает зеленую окраску, переходящую в пурпурную.
Обнаружении методом ТСХ
НФ: силуфол
ПФ: бензол: диоксан: аммиак
Д: р-в Марки / HNO3: СН5ОН
Обнаружение дипразина по УФ- и ИК-спектрам.
Дипразин, растворенный в смеси воды и этилового спирта (1:1), имеет максимумы поглощения при длинах волн, равных 252 и 301 нм; в 0,01 н. растворе соляной кислоты имеет максимум поглощения при 249 и около 300 нм; в ИК-области спектра дипразин (диск с бромидом калия) имеет основные пики при 1459, 1222 и 757 см"1.
В-ва,изолируемые экстракцией полярными растворителями и сорбцией (фенотиазины)(щелочн св-ва)
Дипразин (пипольфен, прометазин, протазии и др.) — белый кристаллический порошок, легкорастворимый в воде и этиловом спирте, хлороформе (1: 2), почти не растворим в диэтиловом эфире.
Дипразин экстрагируется органическими растворителями из щелочной среды.
Дипразин имеет выраженную противогистаминную активность. Он обладает седативным действием, усиливает действие наркотических, снотворных и анальгезирующих средств. Дипразин применяется для лечения аллергических заболеваний, зудящих дерматозов, хореи, энцефалита и др.
Главным метаболитом дипразина является сульфоксид этого препарата. Часть дипразина в неизмененном виде выделяется с мочой. Кроме этого, с мочой выделяется и сульфоксид дипразина, который можно обнаружить в моче даже через 14 сут после приема указанного препарата.
Выделение из биологического материала (по Б. М. Саломатину).
100 г измельченного биологического материала + этиловый спирт, подкисленным 10% р-м щавелевой кислоты до рН = 2...3. à кислые спиртовые вытяжки на водяной бане (при 40 °С) упаривают до густоты сиропа à + 96° этиловым спиртом à фильтруют à выпаривают досуха + 100 мл воды (темп. 40—60 °С) à жидкость охлаждают и фильтруют à + 5 % р-р щавелевой кислоты до рН = 2...3 + диэтиловый эфир (по 50 мл 2 раза) + 50%-м р-м гидроксида натрия до рН = 13 + 4 порции диэтилового à объединенные эфирные вытяжки + 0,5 н р-р серной кислоты à водные вытяжки соединяют и нагревают 3 мин на водяной бане (темп. 50—60 °С) à кислые водные вытяжки используют для обнаружения.
Обнаружение дипразина
· Реакция с концентрированной серной кислотой. Дипразин с концентрированной серной кислотой дает пурпурно-красную окраску.
· Реакция с концентрированной азотной кислотой. При взаимодействии дипразина с концентрированной азотной кислотой появляется бледная пурпурно-красная окраска, переходящая в желтую.
· Реакция с концентрированной соляной кислотой. Дипразин с концентрированной соляной кислотой дает розовато-фиолетовую окраску, переходящую в пурпурно-фиолетовую.
· Реакция Витали — Морена.
· Реакция с реактивом Марки. Дипразин с реактивом Марки дает пурпурную окраску.
· Реакция с реактивом Манделина. Реактив Манделина с Дй-празином дает зеленую окраску, переходящую в пурпурную.
Обнаружении методом ТСХ
НФ: силуфол
ПФ: бензол: диоксан: аммиак
Д: р-в Марки / HNO3: СН5ОН
Обнаружение дипразина по УФ- и ИК-спектрам.
Дипразин, растворенный в смеси воды и этилового спирта (1:1), имеет максимумы поглощения при длинах волн, равных 252 и 301 нм; в 0,01 н. растворе соляной кислоты имеет максимум поглощения при 249 и около 300 нм; в ИК-области спектра дипразин (диск с бромидом калия) имеет основные пики при 1459, 1222 и 757 см"1.
|
ХЛОЗЕПИД
Хлордиазепоксид (элениум)
 В-ва,изолируемые экстракцией полярными растворителями и сорбцией(1,4-бензодиазепины)
Практически нерастворим в воде, растворим в воде соли 1,4-бенздиазепинов. В органических растворителях растворимость зависит от структуры. Наиболее высокая растворимость наблюдается в апротонных растворителях (диметилформамиде, диметилсульфоксиде). Слабое основание.pKa = 2.93
Выводятся производные 1,4-бенздиазепина, в основном, почками в виде основных соединений и метаболитов. Наличие в органах активных метаболитов производных 1,4-бенздиазепина снижает скорость элиминации. Время полувыведения (Т ½) 8-28 часов.
Хлордиазепоксид относится к транквилизаторам. Он оказывает успокаивающее действие на центральную нервную систему, обладает противосудорожной активностью, потенцирует действие снотворных веществ и анальгетиков, проявляет умеренный снотворный эффект.
Хлордиазепоксид (7-хлор-2-метиламино-5-фенил-ЗН-1,4-бензодиазепин-4-оксид) быстро всасывается из желудочно-кишечного тракта. Метаболитами хлордиазепоксида является N-деметилхлордиазепоксид и лактам (7-хлор-1,3-дигидро-5-фенил-2Н-1,4-бензодиазепин-2-он-4-оксид). Часть неизмененного хлордиазепоксида и его метаболитов выделяется с мочой, а часть — образует конъюгаты, которые тоже выделяются с мочой.
Пробоподготовка.
· 25 г измельченного биологического материала + вода + HCl до рН = 1 à 3 раза по одному часу à вытяжки центрифугируют à центрифугат подщелачивают до рН = 10 + хлороформ à 3 раза взбалтывают àхлороформные вытяжки соединяют à обнаружение и количественное определение хлордиазепоксида.
· 5 - 10 мл плазмы крови или мочи + аммиак à дважды взбалтывают с хлороформом à хлороформные вытяжки + вода àвзбалтываютà хлороформный слой + 5 мл р-ра соляной кислоты à взбалтывают 5 минà солянокислые вытяжки отделяют à нагревают на водяной банеà затем нагревают при 125 °С на парафиновой бане 30 мин (при этом образуется 2-амино-5-хлорбензофенон)à + 0,5 мл 10 %-го р-ра нитрита натрия + 0,5 мл 0,5 %-го раствора сульфамината аммония + 0,5 мл 0,1 %-го раствора N-1-нафтилэтилендиамина дигидрохлоридаà вишнево-красная окраска.
Цветные реакции.
1. Реакция с нингидрином, хлордиазепоксид дает коричневую окраску.
2. Реакция с реактивом Марки, хлордиазепоксид дает желтую окраску.
3. Реакция с реактивом Фреде, хлордиазепоксид дает оранжевую окраску.
4. Реакция Витали — Морена, хлордиазепоксид дает желтую окраску.
ТСХ-обнаружение
Обнаружение хлордиазепоксида методом хроматографии в тонком слое сорбента.
НФ: силикагель КСК или пластинки «силуфол»
ПФ: этилацетат: 25 %-го р-р аммиака: метиловый спирт
хлороформ: ацетон
Д: р-в Драгендорфа
Использование спектров.
5. Обнаружение хлордиазепоксида по УФ- и ИК-спектрам. Хлордиазепоксид в 0,1 н. растворе гидроксида натрия имеет максимумы поглощения при 243 и 260 нм; в 0,1 н. растворе серной кислоты хлордиазепоксид имеет максимумы поглощения при 245 и 306 нм.
6. Хлордиазепоксид в 0,1 н. растворе соляной кислоты имеет максимумы поглощения при 246 и 308 нм.
Изолирование: Стаса-Отто или Васильевой. М.б. в кислом и щелочном CHCl3 извл-ях.
Анализ: 1. по продуктам метаболизма: а) б/м настаивают с подкисленной водой или спиртом, экстрагируют CHCl3, к водному слою доб-т NH4OH до pH=9-10, снова экстр-т CHCl3. CHCl3 объед-т, выпаривают досуха, сух-й ост-к подвергают гидролизу H2SO4 или HCl. б) б/ж + HCl или H2SO4 (г-з) до бензофенонов.
К.О.: 1. после ТСХ с пластинки элюируют ацетонитрилом, испаряют, к сух-у ост-ку гептан и иссл-т м-дом ГЖХ и кач-но и кол-но. 2. ВЖХ – УФ детекция. 3. УФ спектроскопия в EtOH. 4. ФКМ по р-ии Братона-Маршала.
Анализ по нативной мол-ле: изол-е общее (Стас-Отто, Васильева), экстр-т CHCl3, pH=10, очистка м-м ТСХ, элюируют с пластинки и вновь наносят на пластинку со свидетелями. Обр-т HClр, в термостат, + р-р NaNO3 в HCl, удал-м изб NaNO2 cульфонатом аммония, обр-м α-нафтилэтиленамином – в местах локализации – окраш-е
В-ва,изолируемые экстракцией полярными растворителями и сорбцией(1,4-бензодиазепины)
Практически нерастворим в воде, растворим в воде соли 1,4-бенздиазепинов. В органических растворителях растворимость зависит от структуры. Наиболее высокая растворимость наблюдается в апротонных растворителях (диметилформамиде, диметилсульфоксиде). Слабое основание.pKa = 2.93
Выводятся производные 1,4-бенздиазепина, в основном, почками в виде основных соединений и метаболитов. Наличие в органах активных метаболитов производных 1,4-бенздиазепина снижает скорость элиминации. Время полувыведения (Т ½) 8-28 часов.
Хлордиазепоксид относится к транквилизаторам. Он оказывает успокаивающее действие на центральную нервную систему, обладает противосудорожной активностью, потенцирует действие снотворных веществ и анальгетиков, проявляет умеренный снотворный эффект.
Хлордиазепоксид (7-хлор-2-метиламино-5-фенил-ЗН-1,4-бензодиазепин-4-оксид) быстро всасывается из желудочно-кишечного тракта. Метаболитами хлордиазепоксида является N-деметилхлордиазепоксид и лактам (7-хлор-1,3-дигидро-5-фенил-2Н-1,4-бензодиазепин-2-он-4-оксид). Часть неизмененного хлордиазепоксида и его метаболитов выделяется с мочой, а часть — образует конъюгаты, которые тоже выделяются с мочой.
Пробоподготовка.
· 25 г измельченного биологического материала + вода + HCl до рН = 1 à 3 раза по одному часу à вытяжки центрифугируют à центрифугат подщелачивают до рН = 10 + хлороформ à 3 раза взбалтывают àхлороформные вытяжки соединяют à обнаружение и количественное определение хлордиазепоксида.
· 5 - 10 мл плазмы крови или мочи + аммиак à дважды взбалтывают с хлороформом à хлороформные вытяжки + вода àвзбалтываютà хлороформный слой + 5 мл р-ра соляной кислоты à взбалтывают 5 минà солянокислые вытяжки отделяют à нагревают на водяной банеà затем нагревают при 125 °С на парафиновой бане 30 мин (при этом образуется 2-амино-5-хлорбензофенон)à + 0,5 мл 10 %-го р-ра нитрита натрия + 0,5 мл 0,5 %-го раствора сульфамината аммония + 0,5 мл 0,1 %-го раствора N-1-нафтилэтилендиамина дигидрохлоридаà вишнево-красная окраска.
Цветные реакции.
1. Реакция с нингидрином, хлордиазепоксид дает коричневую окраску.
2. Реакция с реактивом Марки, хлордиазепоксид дает желтую окраску.
3. Реакция с реактивом Фреде, хлордиазепоксид дает оранжевую окраску.
4. Реакция Витали — Морена, хлордиазепоксид дает желтую окраску.
ТСХ-обнаружение
Обнаружение хлордиазепоксида методом хроматографии в тонком слое сорбента.
НФ: силикагель КСК или пластинки «силуфол»
ПФ: этилацетат: 25 %-го р-р аммиака: метиловый спирт
хлороформ: ацетон
Д: р-в Драгендорфа
Использование спектров.
5. Обнаружение хлордиазепоксида по УФ- и ИК-спектрам. Хлордиазепоксид в 0,1 н. растворе гидроксида натрия имеет максимумы поглощения при 243 и 260 нм; в 0,1 н. растворе серной кислоты хлордиазепоксид имеет максимумы поглощения при 245 и 306 нм.
6. Хлордиазепоксид в 0,1 н. растворе соляной кислоты имеет максимумы поглощения при 246 и 308 нм.
Изолирование: Стаса-Отто или Васильевой. М.б. в кислом и щелочном CHCl3 извл-ях.
Анализ: 1. по продуктам метаболизма: а) б/м настаивают с подкисленной водой или спиртом, экстрагируют CHCl3, к водному слою доб-т NH4OH до pH=9-10, снова экстр-т CHCl3. CHCl3 объед-т, выпаривают досуха, сух-й ост-к подвергают гидролизу H2SO4 или HCl. б) б/ж + HCl или H2SO4 (г-з) до бензофенонов.
К.О.: 1. после ТСХ с пластинки элюируют ацетонитрилом, испаряют, к сух-у ост-ку гептан и иссл-т м-дом ГЖХ и кач-но и кол-но. 2. ВЖХ – УФ детекция. 3. УФ спектроскопия в EtOH. 4. ФКМ по р-ии Братона-Маршала.
Анализ по нативной мол-ле: изол-е общее (Стас-Отто, Васильева), экстр-т CHCl3, pH=10, очистка м-м ТСХ, элюируют с пластинки и вновь наносят на пластинку со свидетелями. Обр-т HClр, в термостат, + р-р NaNO3 в HCl, удал-м изб NaNO2 cульфонатом аммония, обр-м α-нафтилэтиленамином – в местах локализации – окраш-е
| МОРФИН
 В-ва,изолируемые экстракцией полярными растворителями и сорбцией(щелочн св-ва)
Производные фенантренизохинолина
Опиаты – прир-е или синт-е в-ва с морфиноподобными св-ми, вл-т на ЦНС, гладкую муск-ру.
Морфин служит стандартом д/других Alk, сод в опии.
Опиаты выз-т эйфорию, при длит-м прим-ии требуется все большая доза д/дост-я эф-та. Выз-т физич и психич зав-ть → в мед практике прим-е огран-но.
Картина отр-я: сужение зрачков, кома, умен-е дых-я, ↓ t тела и АД. ЛД морфина 200мг, кодеина 0,8г
В-ва,изолируемые экстракцией полярными растворителями и сорбцией(щелочн св-ва)
Производные фенантренизохинолина
Опиаты – прир-е или синт-е в-ва с морфиноподобными св-ми, вл-т на ЦНС, гладкую муск-ру.
Морфин служит стандартом д/других Alk, сод в опии.
Опиаты выз-т эйфорию, при длит-м прим-ии требуется все большая доза д/дост-я эф-та. Выз-т физич и психич зав-ть → в мед практике прим-е огран-но.
Картина отр-я: сужение зрачков, кома, умен-е дых-я, ↓ t тела и АД. ЛД морфина 200мг, кодеина 0,8г
 П/помощь: пром-е жел-ка, солевое слаб-е, форсир-й диурез, гемосорбция, гемодиализ. в/в атропин, иск-я вент-я легких, согревание тела.
Метаболизм: А – Метилирование; B – N-демитилирование, с окислением и обр-ем N→O; С, D – конъюгаты с глюкуроновой к-той и H2SO4,
Изол-е: из б/м м-д Кромаренко или общие Стаса-Отто и Васильевой. Очистка извл-я: колоночная хр-я. Из б/ж (кровь, моча) – в колбу + HCl – нагр-м (гидролиз) – охл-м - + дитионитNa (Na2S2O4) (восстановление N оксидов) – идентификация, далее доб-т NH4OH до pH 9-10 и экстр-т х/ф.
Идент-я: 1. ТСХ 2. УФ спектроскопия в 0,1н щелочи и к-те. 3. Групповая р-я – р-я Пиллагри: сух ост-к + конц H2SO4 и HCl – нагр-м до выд-я SO3, к ост-ку воду и по каплям NaHCO3 до щелочной р-ии, несколько капель р-ра J2 и эфир.
П/помощь: пром-е жел-ка, солевое слаб-е, форсир-й диурез, гемосорбция, гемодиализ. в/в атропин, иск-я вент-я легких, согревание тела.
Метаболизм: А – Метилирование; B – N-демитилирование, с окислением и обр-ем N→O; С, D – конъюгаты с глюкуроновой к-той и H2SO4,
Изол-е: из б/м м-д Кромаренко или общие Стаса-Отто и Васильевой. Очистка извл-я: колоночная хр-я. Из б/ж (кровь, моча) – в колбу + HCl – нагр-м (гидролиз) – охл-м - + дитионитNa (Na2S2O4) (восстановление N оксидов) – идентификация, далее доб-т NH4OH до pH 9-10 и экстр-т х/ф.
Идент-я: 1. ТСХ 2. УФ спектроскопия в 0,1н щелочи и к-те. 3. Групповая р-я – р-я Пиллагри: сух ост-к + конц H2SO4 и HCl – нагр-м до выд-я SO3, к ост-ку воду и по каплям NaHCO3 до щелочной р-ии, несколько капель р-ра J2 и эфир.
 При отравлении опиатами эф слой розовый а водный – зеленый. 4. + р-в Марки – фиол-е окр-е. 5. Морфин + FeCl3 – голуб окр-е.
К.О.: 1. экстракционная ФК 2. по р-ии с FeCl3 (ФЭК или ФКМ в ВО) 3. ВЖХ 4. ГЖХ
FeCl3 (сине-зел), ТСХ (как хинин)- пластинка Армсорб, х/ф:ацетон:аммиак, детекция р-в Драгендорфа, УФ
Р-ции с общеалкалоидными реактивами:
Р-в Манделина-фиолетовое ок-е
Р-в Марки-фиолетовое ок-е
Р-в Фреде-фиолетовое ок-е
Р-в Эрдмана-красная,переходящая в желтую
При отравлении опиатами эф слой розовый а водный – зеленый. 4. + р-в Марки – фиол-е окр-е. 5. Морфин + FeCl3 – голуб окр-е.
К.О.: 1. экстракционная ФК 2. по р-ии с FeCl3 (ФЭК или ФКМ в ВО) 3. ВЖХ 4. ГЖХ
FeCl3 (сине-зел), ТСХ (как хинин)- пластинка Армсорб, х/ф:ацетон:аммиак, детекция р-в Драгендорфа, УФ
Р-ции с общеалкалоидными реактивами:
Р-в Манделина-фиолетовое ок-е
Р-в Марки-фиолетовое ок-е
Р-в Фреде-фиолетовое ок-е
Р-в Эрдмана-красная,переходящая в желтую
| ИЗОПРОПАНОЛ
СН3-СН2(он)-СН3
Вторичный пропиловый спирт (перспирит,петрогол),кипит при 82,40,с водой смешивается во всех соотношениях,испаряется в 1,5 раза медленнее этилового спиота.Низкая летучесть,медленное накопление в крови.Более ядовит,чем этиловый спирт.Пары изопропилового спирта в 2 раза токсичнее паров этилового спирта.
В крови можно обнаружить уже через 30 минут,после приема,а через 2 часа происходит его полное всасывание.
МЕТАБОЛИЗМ: окисляется до ацетона( промежуточный продукт,содержание во внутренних органах возрастает параллельно окислению изопропанола),который сохраняется в организме довольно долго.
После приема всего 5 мл изопропанола,ацетон выделяется с мочей в течении 24 часов,а 50 мл-4 суток.Возможность обнаружения ацетона в биосубстратах нужно также иметь в виду при проведении диффиренциальной диагносики с отравлением ацетоном.
Изопропанол и его метаболиты выводятся с выдыхаемым воздухом,мочой и калом.
Наружный осмотр трупа-цианоз кожи лица и туловища,в органах –гемодинамические расстройства.
На СХИ: 100г крови,всю мочу,300г головного мозга,сердце,одну почку,200-300г скелетных мышц и желудок с содержимим.
В биосубстратах определяют сам спирт,а не его метаболиты.Отрицательный анализ хим исследования- не всегда отсутствие отравления.
Смертельная доза: 100-400 мл.
К.О.:ГЖХ
АЛКИЛНИТРИТНЫЙ МЕТОД
(по расстоянию или времени удерживания).
В пенициллиновый флакон помещают 0,5 мл 50% ТХУ, 1 мл крови или мочи, вводят внутренний стандарт (1 мл 4‰ раствора пропанола или изопропанола), флакон закрывают, укупоривают металлическим колпачком под обкатку или пенициллиновый флакон помещают в металлический стакан, плотно закрывая навинчивающейся крышкой с отверстием для шприца. Шприцом вводят 0,5 мл раствора NaNO2, встряхивают (греть не надо). Чистым шприцом отбирают газовую фазу и вводят в хроматограф. На получившейся хроматограмме определяют высоту или площадь пика анализируемого спирта и стандарта. Находят отношение и определяют концентрацию по калибровочному графику.
 Определение спирта в выдыхаемом воздухе:
1) Проба Рапопорта. Воздух продувают через раствор KMnO4 + H2SO4, если раствор обесцвечивается в течение 30 секунд, значит, было потребление алкоголя. Проба не специфична, реагирует на корвалол, ацетон, бензин.
2) Проба Рапопорта-Архангеловой. Вместо KMnO4 K2Cr2O7. Проба неспецифична.
3) Проба Мохова-Шинкоренко. В трубке CrO3 смешиваем с селикагелем и H2SO4, концы трубки обламываем и продуваем. Если окраска меняется с желтого на зеленый или синий (большое количество алкоголя). Проба неспецифична.
Для расчета концентрации алкоголя в крови, используют формулу Видмарка.
A = P • r (c + β60 • t)
A – количество алкоголя, принятого, г.
Р – масса тела.
r – коэффициент распределения (для мужчин – 0,68, для женщин – 0,55).
β60 – количество алкоголя, выделенного из организма за час – ~15‰.
С – концентрация в ‰, установленная методом ГЖХ.
t – время от момента приема до момента анализа.
Определение спирта в выдыхаемом воздухе:
1) Проба Рапопорта. Воздух продувают через раствор KMnO4 + H2SO4, если раствор обесцвечивается в течение 30 секунд, значит, было потребление алкоголя. Проба не специфична, реагирует на корвалол, ацетон, бензин.
2) Проба Рапопорта-Архангеловой. Вместо KMnO4 K2Cr2O7. Проба неспецифична.
3) Проба Мохова-Шинкоренко. В трубке CrO3 смешиваем с селикагелем и H2SO4, концы трубки обламываем и продуваем. Если окраска меняется с желтого на зеленый или синий (большое количество алкоголя). Проба неспецифична.
Для расчета концентрации алкоголя в крови, используют формулу Видмарка.
A = P • r (c + β60 • t)
A – количество алкоголя, принятого, г.
Р – масса тела.
r – коэффициент распределения (для мужчин – 0,68, для женщин – 0,55).
β60 – количество алкоголя, выделенного из организма за час – ~15‰.
С – концентрация в ‰, установленная методом ГЖХ.
t – время от момента приема до момента анализа.
|
МЫШЬЯК 1
В-ва,изолируемые методом минерализации (металлические яды)
Мышьяк способен кумулироваться в организме. При остром отравлении соединениями мышьяка они накапливаются в основном в паренхиматозных органах, а при хронических отравлениях — в костях и ороговевших тканях (покровы кожи, ногти, волосы и др.).
Мышьяк выводится из организма через почки с мочой, кишки и через некоторые железы. Выделение мышьяка из организма происходит медленно, чем и обусловлена возможность его кумуляции. В экскрементах мышьяк еще можно обнаружить через несколько недель, а в трупном материале — и через несколько лет после смерти.
Исследование минерализатоз на наличие соединений мышьяка
Применяемые в химико-токсикологическом анализе методы обнаружения мышьяка основаны на переведении его в мышьяковистый водород и на последующем определении мышьяковистого водорода при помощи реакции Зангер — Блека, реакции с раствором диэтилдитиокарбамата серебра в пиридине и реакции Марша. При всех этих реакциях из соединений мышьяка выделяется летучий и очень ядовитый мышьяковистый водород. Поэтому при выполнении всех перечисленных выше реакций на мышьяк требуется предосторожность.
Реакция Зангер — Блека основана на восстановлении соединений мышьяка до мышьяковистого водорода, который затем на фильтровальной бумаге реагирует с хлоридом или бромидом ртути (II). Реакция выполняется в специальном приборе (рис. 6).
Восстановление соединений мышьяка производится водородом в момент его выделения, который получают при взаимодействии металлического цинка с серной кислотой:
 Металлический цинк и серная кислота, применяемые для получения водорода, не должны содержать мышьяка. Реакция между металлическим цинком и серной кислотой протекает медленно.
Для ее ускорения применяют так называемый «купрированный» цинк (цинк, поверхность которого покрыта сульфатом меди).
Водород, образовавшийся при взаимодействии серной кислоты и цинка, восстанавливает соединения мышьяка до AsH 3:
Металлический цинк и серная кислота, применяемые для получения водорода, не должны содержать мышьяка. Реакция между металлическим цинком и серной кислотой протекает медленно.
Для ее ускорения применяют так называемый «купрированный» цинк (цинк, поверхность которого покрыта сульфатом меди).
Водород, образовавшийся при взаимодействии серной кислоты и цинка, восстанавливает соединения мышьяка до AsH 3:
 Скорость восстановления соединений трех-и пятивалентного мышьяка (арсенитов и арсена-тов) водородом неодинаковая. Арсениты восстанавливаются водородом легче, чем арсенаты. Поэтому вначале производят восстановление арсенатов в арсениты водородом в присутствии солей железа (II) или олова (II), затем арсениты восстанавливаются водородом с образованием мышьяковистого водорода:
Скорость восстановления соединений трех-и пятивалентного мышьяка (арсенитов и арсена-тов) водородом неодинаковая. Арсениты восстанавливаются водородом легче, чем арсенаты. Поэтому вначале производят восстановление арсенатов в арсениты водородом в присутствии солей железа (II) или олова (II), затем арсениты восстанавливаются водородом с образованием мышьяковистого водорода:
  Образовавшийся мышьяковистый водород реагирует с хлоридом или бромидом ртути (II), которыми пропитана фильтровальная бумага. При реакции образуется ряд окрашенных соединений, которые располагаются на бумаге в виде желтых или коричневых пятен.
Образовавшийся мышьяковистый водород реагирует с хлоридом или бромидом ртути (II), которыми пропитана фильтровальная бумага. При реакции образуется ряд окрашенных соединений, которые располагаются на бумаге в виде желтых или коричневых пятен.
 После обработки бумаги слабым раствором иодида калия вся бумага (кроме пятна, содержащего указанные соединения мышьяка) приобретает красноватую окраску, обусловленную переходом хлорида или бромида ртути в иодид этого металла:
После обработки бумаги слабым раствором иодида калия вся бумага (кроме пятна, содержащего указанные соединения мышьяка) приобретает красноватую окраску, обусловленную переходом хлорида или бромида ртути в иодид этого металла:
 При дальнейшей обработке бумаги концентрированным раствором иодида калия бумага обесцвечивается (образуется K 2 [HgI 4 ]), а пятно, содержащее соединения мышьяка AsH 2 (HgCl), AsH(HgCl) 2, As(HgCl) 3, остается желтым или коричневым.
Реакции Зангер — Блека мешает сероводород, который может образоваться при взаимодействии водорода с серной кислотой: H 2 SO 4 + 8Н ---> H 2 S + 4Н 2 О.
Реакции Зангер — Блека также мешают соединения, ионы которых восстанавливаются водородом. Сереводород, выделившийся при взаимодействии водорода с серной кислотой, на фильтровальной бумаге реагирует с хлоридом или бромидом ртути (II). В результате этой реакции образуется черного цвета сульфид ртути, который маскирует окраску пятен, содержащих соединения мышьяка. Для связывания сероводорода применяют вату,
При дальнейшей обработке бумаги концентрированным раствором иодида калия бумага обесцвечивается (образуется K 2 [HgI 4 ]), а пятно, содержащее соединения мышьяка AsH 2 (HgCl), AsH(HgCl) 2, As(HgCl) 3, остается желтым или коричневым.
Реакции Зангер — Блека мешает сероводород, который может образоваться при взаимодействии водорода с серной кислотой: H 2 SO 4 + 8Н ---> H 2 S + 4Н 2 О.
Реакции Зангер — Блека также мешают соединения, ионы которых восстанавливаются водородом. Сереводород, выделившийся при взаимодействии водорода с серной кислотой, на фильтровальной бумаге реагирует с хлоридом или бромидом ртути (II). В результате этой реакции образуется черного цвета сульфид ртути, который маскирует окраску пятен, содержащих соединения мышьяка. Для связывания сероводорода применяют вату,
| МЫШЬЯК 2пропитанную раствором ацетата свинца:
H 2 S + Pb (CH 3 COO) 2 ---> PbS + 2СН 3 СООН
Предел обнаружения: 0,1 мкг мышьяка в пробе. Граница обнаружения: 0,01 мг мышьяка в 100 г биологического материала.
Реакция с раствором диэтилдитиокарбамата серебра в пиридине.При выполнений этой реакции находящиеся в минерализате соединения мышьяка восстанавливают до мышьяковистого водорода, который собирают в пробирку (приемник), содержащую свежеприготовленный раствор диэтилдитиокарбамата серебра в пиридине. Раствор диэтилдитиокарбамата серебра в пиридине не должен содержать влаги. При наличии мышьяка в минерализате раствор диэтилдитиокарбамата серебра приобретает устойчивую красно-фиолетовую окраску. Химизм этой реакции не выяснен.
Обнаружению мышьяка при помощи этой реакции мешают соединения сурьмы, которые тоже реагируют с указанным реактивом и дают оранжево-красную окраску. Сурьма дает эту реакцию тогда, когда содержание ее в 100 г биологического материала составляет 0,5 мг и выше.
Восстановление соединений мышьяка при этой реакции происходит под влиянием водорода, условия получения которого подробно приведены при описании реакции Зангер — Блека. Реакцию соединений мышьяка с диэтилдитиокарбаматом серебра выполняют в специальном аппарате (см. рис. 7).
Предел обнаружения: 0,5 мкг мышьяка в 1 мл минерализата. Граница обнаружения: 0,01 мг мышьяка в 100 г биологического материала.
Реакция Маршаоснована на восстановлении соединений мышьяка водородом в момент его выделения и на последующем термическом разложении образовавшегося при этом мышьяковистого водорода:
 Мышьяк, образовавшийся при термическом разложении мышьяковистого водорода, откладывается на стенках восстановительной трубки аппарата Марша в виде налета («мышьякового зеркала»).
Мышьяк, образовавшийся при термическом разложении мышьяковистого водорода, откладывается на стенках восстановительной трубки аппарата Марша в виде налета («мышьякового зеркала»).
 Определение мышьяка с помощью реакции Марша выполняют в три этапа. Вначале проверяют реактивы на отсутствие в них мышьяка, затем определяют мышьяк в исследуемом растворе и, наконец, проверяют подлинность налета, образовавшегося в восстановительной трубке.
1. Проверка чистоты реактивов. Прежде чем приступить к обнаружению мышьяка в исследуемом растворе, необходимо убедиться в том, что применяемые для этой цели реактивы («купрированный» цинк и серная кислота) не содержат мышьяка.
С этой целью в колбу аппарата Марша вносят 10 г мелких гранул «купрированного» цинка, колбу закрывают пробкой с вмонтированными капельной воронкой и отводной трубкой. В капельную воронку вносят 30 мл 10 %-го раствора серной кислоты, которую небольшими порциями (по 4—5 мл) приливают к «купрированному» цинку, находящемуся в колбе аппарата Марша. Всегда необходимо оставлять в капельной воронке 8—10 мл раствора серной кислоты, которая препятствует проникновению воздуха извне в аппарат Марша. Попадание воздуха в аппарат Марша через капельную воронку может быть причиной взрыва этого аппарата при нагревании восстановительной трубки или при зажигании выходящих из нее газов.
Через 20—25 мин после начала выделения водорода проверяют полноту вытеснения воздуха водородом из аппарата Марша. Для этого над выходным отверстием восстановительной трубки аппарата держат опрокинутую узкую пробирку. Через 4—5 мин эту пробирку закрывают пальцем и, не переворачивая
Определение мышьяка с помощью реакции Марша выполняют в три этапа. Вначале проверяют реактивы на отсутствие в них мышьяка, затем определяют мышьяк в исследуемом растворе и, наконец, проверяют подлинность налета, образовавшегося в восстановительной трубке.
1. Проверка чистоты реактивов. Прежде чем приступить к обнаружению мышьяка в исследуемом растворе, необходимо убедиться в том, что применяемые для этой цели реактивы («купрированный» цинк и серная кислота) не содержат мышьяка.
С этой целью в колбу аппарата Марша вносят 10 г мелких гранул «купрированного» цинка, колбу закрывают пробкой с вмонтированными капельной воронкой и отводной трубкой. В капельную воронку вносят 30 мл 10 %-го раствора серной кислоты, которую небольшими порциями (по 4—5 мл) приливают к «купрированному» цинку, находящемуся в колбе аппарата Марша. Всегда необходимо оставлять в капельной воронке 8—10 мл раствора серной кислоты, которая препятствует проникновению воздуха извне в аппарат Марша. Попадание воздуха в аппарат Марша через капельную воронку может быть причиной взрыва этого аппарата при нагревании восстановительной трубки или при зажигании выходящих из нее газов.
Через 20—25 мин после начала выделения водорода проверяют полноту вытеснения воздуха водородом из аппарата Марша. Для этого над выходным отверстием восстановительной трубки аппарата держат опрокинутую узкую пробирку. Через 4—5 мин эту пробирку закрывают пальцем и, не переворачивая
Поиск по сайту©2015-2026 poisk-ru.ru
Все права принадлежать их авторам. Данный сайт не претендует на авторства, а предоставляет бесплатное использование. Дата создания страницы: 2016-08-20 Нарушение авторских прав и Нарушение персональных данных |
Поиск по сайту: Читайте также: Деталирование сборочного чертежа Когда производственнику особенно важно наличие гибких производственных мощностей? Собственные движения и пространственные скорости звезд |