ГБОУ г. Москвы «Лицей № 1568 имени Пабло Неруды»
АДСОРБЕНТЫНА ОСНОВЕ СУПЕРПАРАМАГНИТНЫХ НАНОЧАСТИЦ
Выполнила: ученица 10 “А” класса
ГБОУ Лицей № 1568 имени Пабло Неруды
Руководитель: м.н.с. химического факультета МГУ имени М.В.Ломоносова Дзубан Александр Владимирович
Москва, 2017
Содержание
Введение............................................................................................................................. 3
Обзор литературы............................................................................................................. 5
Практическая часть........................................................................................................... 8
Обсуждение результатов................................................................................................ 11
Основные результаты и выводы.................................................................................... 13
Список литературы......................................................................................................... 14
Приложение..................................................................................................................... 16
Введение
В XXI веке все большее значение в быстро развивающихся отраслях науки и экономики приобретают нанотехнологии, которые нашли свое применение как в технических, так и в медико-биологической областях. Научный интерес к нанообъектам связан с тем, что в отличие от массивных объектов они проявляют необычные физические и химические свойства, особое место среди которых занимают магнитные свойства [1].
В середине 60-х годов XX века были синтезированы магнитные жидкости, в состав которых входят магнитные наночастицы. К настоящему времени разработаны различные методы получения магнитных жидкостей с заданными физическими свойствами, которые определяются их основой, размером и стабильностью наночастиц, напряженностью внешнего магнитного поля [2]. Изучение свойств магнитных жидкостей и промышленные технологии их производства открыли широкие возможности применения магнитных жидкостей как герметизирующих и смазочно-охлаждающих средств, в радиотехнике, электронных устройствах, автомобилестроении, авиакосмической промышленности, приборостроении, электроэнергетике, горнодобывающей промышленности, экологии, ведутся исследования по применению магнитных жидкостей в фармацевтике и медицине [3].
Химико-физические свойства магнитных жидкостей позволяют рассматривать их в качестве адсорбентов. В нашей работе мы осуществили синтез магнитной жидкости и использовали ее для очистки воды от тяжёлых металлов.
Цель настоящей работы — изучить адсорбционные свойства модифицированных суперпарамагнитных наночастиц магнетита в водных растворах, содержащих ионы тяжёлых металлов.
Задачи:
1. синтезировать магнитную жидкость на основе наночастиц магнетита, стабилизированных гуминовой кислотой;
2. охарактеризовать полученный коллоидный раствор и, в частности, диспергированные наночастицы;
3. приготовить растворы солей тяжёлых металлов (Co, Ni, Cu, Hg, Pb) различной концентрации;
4. провести адсорбцию солей тяжёлых металлов из водных растворов с помощью магнитной жидкости;
5. сделать вывод об эффективности использования магнитной жидкости для очистки водных растворов от примесей тяжёлых металлов.
Гипотеза: покрытие поверхности наночастицы магнетита особыми веществами, способными связывать растворённые катионы тяжёлых металлов, позволяет использовать магнитную жидкость для очистки воды, а наличие магнитных свойств — легко отделять наночастицы от растворителя.
Актуальность работы состоит в изучении адсорбционных свойств магнитной жидкости для очистки воды от ионов тяжелых металлов, которые представляют серьезную опасность с точки зрения их негативного воздействия на биосреду. Для очистки воды от ионов тяжелых металлов применяют различные методы и материалы, в том числе и сорбционные материалы. Преимущество сорбентов с магнитными свойствами заключается в том, что они обладают высокой сорбционной емкостью и управляются при помощи магнитного поля [4]. Получение доступных и эффективных модифицированных магнитных сорбентов является актуальной научной и технологической задачей.
Работу выполняли с сентября 2016 г. по январь 2017 г. на базе ГБОУ г. Москвы «Лицей № 1568 имени Пабло Неруды» и химического факультета и факультета наук о материалах МГУ имени М.В. Ломоносова.
Обзор литературы
Магнитные жидкости — это коллоидные дисперсии магнитных материалов с частицами размером от 5 нм до 10 мкм, стабилизированные в полярной (водной, спиртовой) или неполярной (углеводородной, силиконовой) средах с помощью поверхностно-активных веществ (ПАВ) или полимеров [5].
Уникальность магнитных жидкостей заключается в том, что они одновременно обладают свойствами, обычно исключающими друг друга, — намагниченностью и текучестью. Эти свойства магнитной жидкости зависят, прежде всего, от соотношения ее компонентов.
Магнитные жидкости состоят из трех компонентов: немагнитной жидкой основы (жидкость-носитель), магнитных коллоидных частиц (магнетик) и стабилизатора, препятствующего слипанию коллоидных частиц [1].




 В качестве магнитных коллоидных частиц в магнитных жидкостях, как правило, используются ферромагнетики — это вещества, обладающие сильно выраженными магнитными свойствами (их магнитная восприимчивость положительна и значительно больше единицы). К ним относятся: железо, никель, кобальт, гадолиний, их сплавы и соединения.
В качестве магнитных коллоидных частиц в магнитных жидкостях, как правило, используются ферромагнетики — это вещества, обладающие сильно выраженными магнитными свойствами (их магнитная восприимчивость положительна и значительно больше единицы). К ним относятся: железо, никель, кобальт, гадолиний, их сплавы и соединения.







 В ферромагнитных материалах возникают самопроизвольно намагниченные области, т.н. домены — области, в которых энергетически выгодным состоянием соседних атомов является однонаправленность спинов их электронов. В каждом таком домене намагниченность достигает максимального значения. Большое количество доменов, хаотически направленных, делает макрообъекты ненамагниченными, но действие внешнего магнитного поля упорядочивает магнитную направленность большинства доменов, усиливая магнитную индукцию, и наступает магнитное насыщение [6].
В ферромагнитных материалах возникают самопроизвольно намагниченные области, т.н. домены — области, в которых энергетически выгодным состоянием соседних атомов является однонаправленность спинов их электронов. В каждом таком домене намагниченность достигает максимального значения. Большое количество доменов, хаотически направленных, делает макрообъекты ненамагниченными, но действие внешнего магнитного поля упорядочивает магнитную направленность большинства доменов, усиливая магнитную индукцию, и наступает магнитное насыщение [6].


 Для ферромагнетиков характерен магнитный гистерезис — зависимость намагничивания и размагничивания ферромагнитного образца от изменения индукции внешнего магнитного поля (петля гистерезиса). При определенных условиях ферромагнетики способны сохранять намагниченность и в отсутствие
Для ферромагнетиков характерен магнитный гистерезис — зависимость намагничивания и размагничивания ферромагнитного образца от изменения индукции внешнего магнитного поля (петля гистерезиса). При определенных условиях ферромагнетики способны сохранять намагниченность и в отсутствие 


 внешнего магнитного поля. Для того чтобы полностью размагнитить образец, необходимо, изменив знак внешнего поля, довести магнитную индукцию до значения коэрцитивной силы.
внешнего магнитного поля. Для того чтобы полностью размагнитить образец, необходимо, изменив знак внешнего поля, довести магнитную индукцию до значения коэрцитивной силы.








 Исследователи установили зависимость коэрцитивной силы материалов от размеров образующих его частиц. У однодоменных частиц роль междоменных границ в процессе перемагничивания становится менее заметной, при этом наблюдается более широкая петля гистерезиса и увеличение коэрцитивной силы. Но при дальнейшем уменьшение размеров частиц под действием тепловой энергии они переходят в суперпарамагнитное состояние, для которого характерно отсутствие магнитного гистерезиса (коэрцитивная сила равна 0) и наличие тепловых флуктуаций магнитного момента наночастицы (аналогичных тепловым флуктуациям в обычном парамагнетике) [7].
Исследователи установили зависимость коэрцитивной силы материалов от размеров образующих его частиц. У однодоменных частиц роль междоменных границ в процессе перемагничивания становится менее заметной, при этом наблюдается более широкая петля гистерезиса и увеличение коэрцитивной силы. Но при дальнейшем уменьшение размеров частиц под действием тепловой энергии они переходят в суперпарамагнитное состояние, для которого характерно отсутствие магнитного гистерезиса (коэрцитивная сила равна 0) и наличие тепловых флуктуаций магнитного момента наночастицы (аналогичных тепловым флуктуациям в обычном парамагнетике) [7].

 Каждая суперпарамагнитная наночастица должна быть покрыта слоем поверхностно-активных веществ (ПАВ), для того чтобы изолировать частицы друг от друга из-за действия Ван-дер-Ваальсовых или магнитных сил и предотвратить их выпадение в осадок. Защитная оболочка вокруг наночастиц, образуемая ПАВ, не должна реагировать с электролитами и разрушаться под действием температуры или механической вибрации [8].
Каждая суперпарамагнитная наночастица должна быть покрыта слоем поверхностно-активных веществ (ПАВ), для того чтобы изолировать частицы друг от друга из-за действия Ван-дер-Ваальсовых или магнитных сил и предотвратить их выпадение в осадок. Защитная оболочка вокруг наночастиц, образуемая ПАВ, не должна реагировать с электролитами и разрушаться под действием температуры или механической вибрации [8].
При рассмотрении устойчивости магнитной жидкости пользуются теорией ДЛФО (теория Дерягина, Ландау, Фервея, Овербека). Она базируется на сопоставлении межмолекулярного взаимодействия частиц дисперсной фазы в дисперсной среде и электростатического взаимодействия диффузных ионных слоев с учетом теплового броуновского движения частиц дисперсной фазы [9]. Вещество, в котором распределено другое тело, называется дисперсной средой, а распределенное тело — дисперсной фазой. Благодаря броуновскому движению коллоидные частицы дисперсной фазы могут сближаться до соприкосновения своих диффузных оболочек (ПАВ), но для дальнейшего сближения им надо деформировать свои ионные слои. Но из-за плохой сжимаемости жидкости со стороны ПАВ возникают силы “расклинивающего давления”, препятствующие взаимному перекрыванию или проникновению друг в друга диффузных оболо  чек. Это обеспечивает сохранение исходных размеров частиц и предотвращает их слипание (укрупнение), что и является агрегативной устойчивостью магнитной жидкости как коллоидной системы.
чек. Это обеспечивает сохранение исходных размеров частиц и предотвращает их слипание (укрупнение), что и является агрегативной устойчивостью магнитной жидкости как коллоидной системы.









 Совокупность правильно подобранных размеров суперпарамагнитных наночастиц и ПАВ обуславливают высокую стабильность магнитной жидкости, которая не расслаивается во внешнем магнитном поле и сохраняет свои первоначальные свойства после снятия магнитного поля. Это позволяет использовать магнитные жидкости в качестве эффективного средства для адсорбции — изменения концентрации вещества вблизи поверхности раздела фаз («поглощение на поверхности») [10]. Преимущество адсорбентов с магнитными свойствами заключается в том, что они обладают высокой сорбционной мощностью и процесс адсорбции осуществляется с помощью магнитного поля, что позволяет уменьшить трудоемкость технологического процесса адсорбции-десорбции [4].
Совокупность правильно подобранных размеров суперпарамагнитных наночастиц и ПАВ обуславливают высокую стабильность магнитной жидкости, которая не расслаивается во внешнем магнитном поле и сохраняет свои первоначальные свойства после снятия магнитного поля. Это позволяет использовать магнитные жидкости в качестве эффективного средства для адсорбции — изменения концентрации вещества вблизи поверхности раздела фаз («поглощение на поверхности») [10]. Преимущество адсорбентов с магнитными свойствами заключается в том, что они обладают высокой сорбционной мощностью и процесс адсорбции осуществляется с помощью магнитного поля, что позволяет уменьшить трудоемкость технологического процесса адсорбции-десорбции [4].
Процесс получения магнитной жидкости включает в себя две основные стадии: получение магнитных частиц коллоидных размеров и стабилизация их в жидкой основе. Обе эти стадии происходят одномоментно для предотвращения коагуляции наночастиц в растворе. Наночастицы можно получить двумя методами: механическим и химическим [11].
Механический метод (диспергирования) заключается в измельнии магнетита, смешении полученной магнетитовой пудры с жидкой основой и ПАВ. Недостатки этого метода заключаются в значительном разбросе размеров частиц, низкой производительности.
Химический метод (конденсации) заключается в соосаждении магнетита из растворов солей двух- и трёхвалентного железа избытком концентрированного раствора щелочи. Полученные кристаллы переводят в жидкую основу и стабилизируют ПАВ. Преимуществами этого метода являются монодисперсность магнитных наночастиц, высокая производительность, низкая стоимость магнитной жидкости [8].
Практическая часть
В данной работе для получения магнитной жидкости мы использовали метод соосаждения солей двух- и трёхвалентного железа избытком концентрированного аммиака. Основой служила дистиллированная вода. В качестве стабилизатора применяли гуминовую кислоту — сложную смесь высокомолекулярных природных органических соединений, образующихся при разложении отмерших растений и их последующей гумификации [12].
1) Навески FeCl3·6H2O (хч) массой 6,100 г и FeSO4·7H2O (хч) массой 4,201 г растворили в 100 мл дистиллированной H2O. Полученный раствор в колбе Эрленмейера поместили в заранее нагретый до 87°C лабораторный термостат-редуктазник (ЛТР-24)1.
2) Включили верхнеприводную мешалку1, опущенную в раствор, и по каплям добавили 12 мл концентрированного NH3·H2O (25%-ный раствор в воде, хч). Реакции:
Fe3+ + Fe2+ + 4 OH– àFe3O4 + 4 H+
2 FeCl3·6H2O + FeSO4·7H2O + 8 NH3·H2O à Fe3O4 + 6 NH4Cl + (NH4)2SO4 + 20 H2O
3) Полученную суспензию разделили на 2 части. Одну оставили без изменения (нестабилизированный Fe3O4), а к другой добавили 1,390 г гуминовой кислоты (18 масс.% раствор в воде) и продолжили нагревание в течение 30 минут при прежней температуре и работающей верхнеприводной мешалке.
Fe3O4 + гуминовая кислота (Humic Acid) (в воде) à Fe3O4/HA
4) Синтезированные магнитные жидкости промыли дистиллированной водой до нейтральной pH-среды на воронке Бюхнера с вакуумным фильтрованием1 или декантированием, отделяя Fe3O4 от воды магнитом и убирая воду дозатором.
5) Густые черные осадки Fe3O4/HA и Fe3O4 шпателем перенесли на чашки Петри и поместили в воздушный термостат (ТС-1/80 СПУ)1 при температуре 35°C на несколько суток.
6) Высушенные магнитные материалы отделили от чашек Петри и измельчили в агатовой ступке. Часть образцов использовали для их характеризации различными методами, остаток редиспергировали в воде при помощи ультразвуковой ванны (Elma ELMASONIC P30H).
Взвешивание проводили на аналитических весах ВЛ-224 (ГОСМЕТР)1 с точностью до 0.1 мг.
Для характеризации полученных наночастиц и их коллоидных растворов в воде использовали следующие методы:
1) рентгенофазовый анализ (РФА) — для определения кристаллической структуры синтезированных образцов и анализа их чистоты;
2) инфракрасная (ИК) спектроскопия — для подтверждения связывания гуминовой кислоты с поверхностью наночастиц;
3) просвечивающая электронная микроскопия (ПЭМ) — для прямого наблюдения и визуализации наночастиц;
4) метод динамического светорассеяния (ДСР) с приставкой для измерения дзета-потенциала — для определения размера наночастиц и устойчивости их водных растворов;
5) магнетометрия на весах Фарадея — для измерения зависимости магнитной восприимчивости образцов от величины внешнего магнитного поля.
Рентгенофазовый анализ проводили на дифрактометре с вращающимся медным анодом Rigaku D/MAX-2500V/PC в геометрии Брегга-Брентано (на отражение) в кремниевых (111) кюветах. Угол 2θ измеряли в диапазоне 10-60º с шагом 0.02 и скоростью сканирования 3 град/мин. Обработку рентгенограмм и идентификацию веществ проводили с использованием пакета программ STOE WinXpow и базы данных ICDD PDF-2.
ИК-спектры снимали на Фурье-спектрометре Perkin-Elmer Spectrum One FTIR в режиме пропускания в области 4000 – 400 см-1 с разрешением 1 см-1. Накопление сигнала проводили за 32 прохода. Образцы непосредственно перед измерением тщательно перетирали в ступке с отожжённым безводным KBr в соотношении 1:100 и прессовали в таблетки.
Просвечивающую электронную микроскопию выполняли на микроскопе LEO912 AB OMEGA (ускоряющее напряжение 100 кэВ, разрешение 0,37 нм). Образцы наносили на медные сетки для микроскопии (диам. ~3мм) в виде капли объёмом 1 мкл водной суспензии, разведенной до концентрации порядка ~0.01-0.1 масс. % с последующим высушиванием. Съемку вели преимущественно в областях утоньшения пленки для повышения контраста.
Измерения динамического светорассеяния и дзета-потенциала проводили на анализаторе Zetasizer nanoseries Nano ZS (Malvern, Великобритания) в термостатируемой при 25°C кювете (l = 10 мм), содержащей водные суспензии концентрации ~0.01-0.1 масс. %.
Магнитные измерения проводили на магнитометре типа «весы Фарадея» (изготовлен в Институте химии твердого тела УрО РАН) в магнитных полях напряженностью 18 кЭ при комнатной температуре. Для фиксации образцов в держателе использовался диамагнитный полимерный клей. Точность измерения магнитного момента составляла 3%, точность определения приложенного магнитного поля ± 100 Э. При калибровке прибора использовались стандартные образцы железоиттриевого граната (NIST SRM-2853) и соли Мора.
Для изучения сорбционных свойств полученных наночастиц Fe3O4/HA их 2% (масс.) коллоидный раствор смешивали в определённых соотношениях с индивидуальными растворами нитратов Co, Ni, Cu, Hg, Pb концентрации 50 ppm (табл. 1), взбалтывали на шейкере в течение 30 минут и отбирали пробы для проведения масс-спектрометрии с индуктивно-связанной плазмой (ИСП-МС). В качестве стандартов для построения калибровочной зависимости использовали растворы солей металлов концентрации 1, 3 и 10 ppm.
Обсуждение результатов
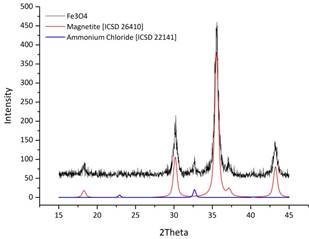
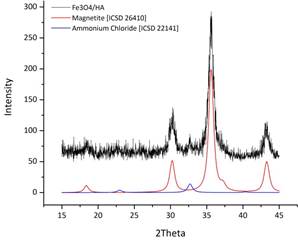
Согласно данным РФА полученные образцы представляют собой магнетит с незначительной примесью хлорида аммония (до 3%, рис. 1). Присутствие последнего вызвано использованием избытков исходных реактивов и не влияет на наши дальнейшие исследования.
Используя формулу Шеррера (ссылка), можно оценить размер области когерентного рассеяния (ОКР) в каждом образце, который должен быть приблизительно равен размеру наночастиц:
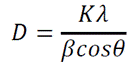 |
где D — размер ОКР, К — фактор формы (для сферических частиц 1,11), λ — длина волны падающего излучения (в нашем случае CuKα1 — 1.54056 Å), β — полуширина рефлекса на дифрактограмме (в радианах), θ — положение рефлекса. Мы выбрали для анализа наиболее интенсивный пик при 2 θ = 35,5° (рис. 2). В результате для немодифицированного Fe3O4 D = 24 нм, а для Fe3O4/HA D = 15,5 нм.
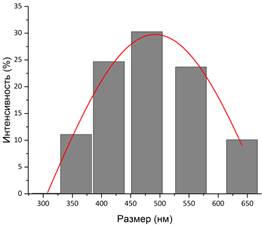
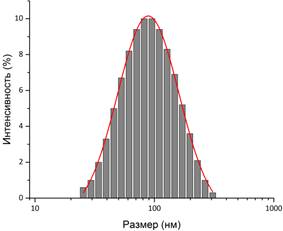
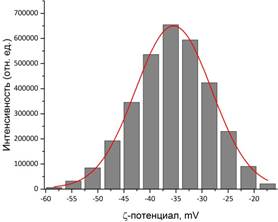
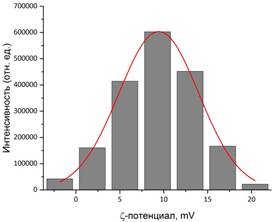
Подтверждение связывания гуминовой кислоты с поверхностью магнетита можно получить при помощи ИК-спектроскопии. Валентные колебания свободной карбонильной группы должны лежать в пределах 1700 – 1760 см-1. На рис. 3 сдвиг этого значения в сторону меньших энергий в нашем случае свидетельствует об образовании связей между COO–-группой и поверхностью наночастиц. Остальные колебания на рисунке соответствуют адсорбированной воде (3650 – 2850 см–1, 1120 – 985 см–1) и непосредственно Fe3O4 (800 – 500 см–1). Размер наночастиц и их устойчивость в водном растворе дополнительно оценивали методом ДСР (рис. 4) и измерением дзета-потенциала (рис.5). Оказалось, что частицы Fe3O4 оказались очень крупными (490 нм) и нестабильными в растворе (ζ-потенциал = +9,4 мВ). Добавление гуминовой кислоты в процессе синтеза приводит к росту не очень крупных частиц магнетита (90 нм), которые образуют весьма стабильный раствор в воде (ζ-потенциал = – 35,5 мВ). Согласно теории ДЛФО (Дерягина-Ландау-Фервея-Обербека) устойчивыми считаются коллоидные растворы со значением ζ-потенциала, превышающим по модулю 30 мВ.
Прямым методом наблюдения наночастиц является просвечивающая электронная микроскопия (ПЭМ). Можно видеть (рис. 6), что синтезированные наночастицы Fe3O4/HA имеют размеры порядка 15–20 нм, образуя при этом агрегаты существенно большего размера, не превышающего при этом 50 нм. Полученные результаты находятся в согласии с РФА (т.е. каждая наночастица — монокристалл).
Метод ДСР определяет гидродинамический радиус частиц в растворе (т.е. наночастица + двойной электрический слой + “шуба” из молекул воды), что объясняет разницу полученные значений.
Дифракция электронов с наночастиц Fe3O4/HA говорит о том, что они имеют структуру обратной шпинели. Это можно видеть по расположению колец на электронограмме (рис. 7).
Кроме того, на микрофотографии на большом увеличении можно оценить толщину покрытия наночастиц гуминовой кислотой (рис. 8): она варьируется от 2 до 5 нм.
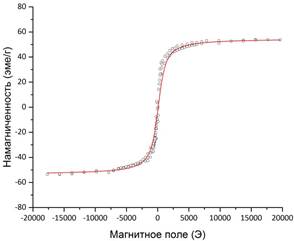
Результаты магнитных измерений (рис. 9) говорят о том, что все синтезированные образцы суперпарамагнитны (коэрцитивная сила равна нулю). Намагниченность насыщения в случае Fe3O4/HA несколько меньше по сравнению с чистым Fe3O4, что связано с меньшим процентным содержанием магнитного материала в пробе.
Согласно экспериментам по очистке воды от примесей тяжёлых металлов (рис. 10) эффективность связывания их катионов поверхностью Fe3O4/HA довольно высока (табл. 2). Лучше всего из растворов извлекается свинец (II), хуже всего — ртуть (II). В целом же можно достичь степени извлечения не ниже 70%.
Основные результаты и выводы
· Простым соосаждением железа (II) и (III) из водного раствора аммиаком при нагревании можно получить суперпарамагнитные частицы Fe3O4.
· Добавление в процессе синтеза такого стабилизатора поверхности как гуминовая кислота позволяет ограничить рост зародышей и получить наночастицы магнетита (диаметром ~20 нм).
· Наночастицы Fe3O4, покрытые гуминовой кислотой, образуют стабильные водные коллоидные растворы, устойчивые в течение долгого времени.
· Сорбция катионов тяжёлых металлов из водных растворов на поверхности наночастиц Fe3O4/HA зависит от концентрации последних и проходит с большей эффективностью для свинца (II) и никеля (II). Минимальная степень извлечения при высоком содержании НЧ в растворе составила 71%.
Список литературы
[1] Губин, С.П. Магнитные наночастицы: методы получения, строение и свойства / Губин С.П., Кокшаров Ю.А., Хомутов Г.Б., Юрков Г.Ю. // Успехи химии. — 2005. — №74 (6) — С. 539-574.
[2] Магнитные жидкости / Б.М. Берковский, В.Ф. Медведев, М.С. Краков. — М.: Химия. — 1989. — 240 с.
[3] Сенатская И., Байбуртский Ф. Магнитная жидкость // Наука и жизнь. — 2002. — № 11. — Режим доступа: https://www.nkj.ru/archive/articles/4971/ (дата обращения 08.01.2017)
[4] Мечковский, С.А. Высокодисперсные магнитоизвлекаемые сорбенты/ Мечковский С.А., Лесникович А.И., Воробьева С.А., Заневская Ю.В., Козыревская А.Л., Молоток Е.В. // Вестн. Белорус. Гос. Ун-та. Сер.2. — 1998. — № 3. — С. 13—16, 79.
[5] Сучилин, В.А. Применение магнитной жидкости в технологиях сервиса транспортных средств / Сучилин В.А., Грибут И.Э., Голиков С.А. // Электротехнические и информационные комплексы и системы. — 2011 — № 4. — Т. 7. — С. 41—45.
[6] Глебов А.Н., Буданов А.Р. Магнетохимия: магнитные свойства и строения веществ// Соросовский образовательный журнал. — 1997. — № 7. — С.44—51.
[7] Казин, П.Е. Методы исследования магнитных свойств материалов: Методическая разработка / Казин П.Е., Кульбакин И.В. — М. — 2011. — 34 с.
[8] Фертман В.Е. Магнитные жидкости: Справ. пособие. — Мн.: Выш. шк. — 1988. — 184 с.
[9] Щукин, Е.Д. Коллоидная химия: Учеб. для университетов и химико-технолог. вузов / Е.Д. Щукин, А.В. Перцев, Е.А. Амелина. — 3-е изд., перераб. и доп. — М.: Высш. шк. — 2004. — 445 с.
[10] Никифоров И.А. Адсорбционные методы в экологии. — Саратовский госуниверситет — 48 с.
[11] Байбуртский Ф.С. Магнитные жидкости: способы получения и области применения. — 24 с.
[12] Химическая энциклопедия: В 5 т.: т.1: А-Дарзана / Редкол.: Кнунянц И.Л. (гл. ред.) и др. — М.: Сов. энцикл. — 1988. — 623 с.
Приложение
Таблица 1. Соотношения реагентов для адсорбционных экспериментов
| Наименование | Пробирка №1 | Пробирка №2 | Пробирка №3 | Пробирка №4 |
| Количество вещества в пробирке | ||||
| Раствор соли тяжёлого металла | 1 мл | 1 мл | 1 мл | 1 мл |
| NH3·H2O конц. | 0,15 мл | 0,15 мл | 0,15 мл | 0,15 мл |
| 2% коллоидный раствор Fe3O4/HA | 1 мл | 0,5 мл | 0,25 мл | 0,1 мл |
| H2O дист. | 1,85 мл | 3,35 мл | 3,60 мл | 3,75 мл |
| Итого | 5 мл | 5 мл | 5 мл | 5 мл |
 (а) (б)
(а) (б)
Рис. 1. Дифрактограммы образцов магнетита без стабилизатора (а) и покрытого гуминовой кислотой (б).
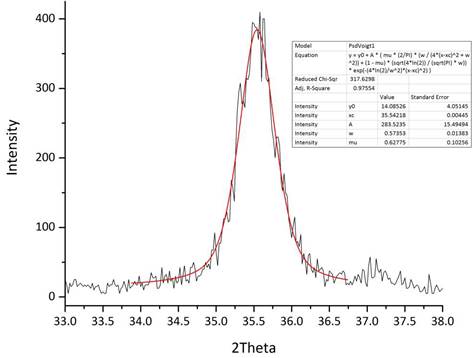
Рис. 2. Увеличенная область дифрактограммы Fe3O4 и аппроксимация пика.
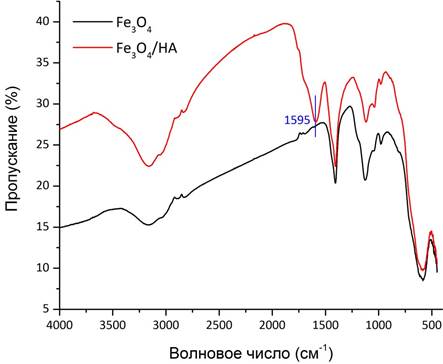
Рис. 3. ИК-спектры полученных образцов магнетита.
 (а) (б)
(а) (б)
Рис. 4. Разброс частиц по размерам Fe3O4 (а) и Fe3O4/HA (б).
(а) (б)
Рис. 5. Стабильность коллоидных растворов частиц Fe3O4 (а) и Fe3O4/HA (б).



 Рис. 6. Микрофотографии полученных наночастиц Fe3O4/HA.
Рис. 6. Микрофотографии полученных наночастиц Fe3O4/HA.

 (а) (б)
(а) (б)
Рис. 7. Электронограммы синтезированных наночастиц Fe3O4/HA (а) и порошка чистого магнетита (б).

(а) (б)
Рис. 8. Магнитные характеристики порошков частиц Fe3O4 (а) и Fe3O4/HA (б).

 (а) (б)
(а) (б)
Рис. 9. Фотографии пробирок с образцами воды с примесью тяжёлых металлов и различным содержанием наночастиц Fe3O4/HA (табл. 1) до магнитной сепарации (а) и после (б).
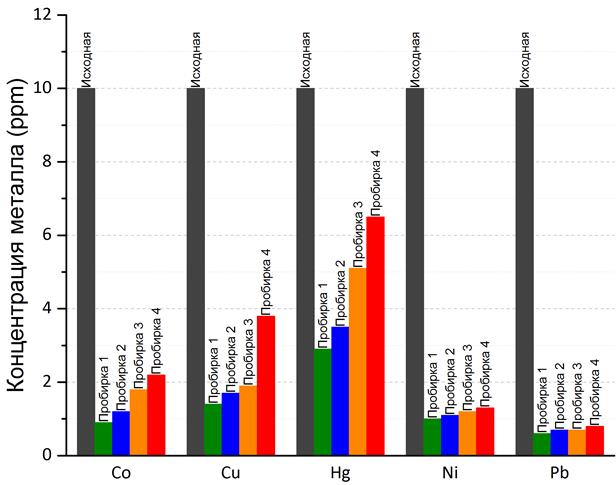
Рис. 10. Содержание примесей тяжёлых металлов в образцах воды до и после очистки при помощи магнитных наночастиц Fe3O4/HA
 Таблица 2. Степень извлечения (%) примесей тяжёлых металлов из водных растворов магнитными наночастицами Fe3O4/HA
Таблица 2. Степень извлечения (%) примесей тяжёлых металлов из водных растворов магнитными наночастицами Fe3O4/HA
Co Ni Cu







 91 88 82 78 90 89 88 87 86 83 81 62
91 88 82 78 90 89 88 87 86 83 81 62
Hg Pb







 71 65 49 35 94 93 93 92
71 65 49 35 94 93 93 92