Свойства веществ различных классов
| Кислота | + мет (до Н) = соль + Н2 | Основание | + к-та= соль + Н2О |
| + осн оксид = соль + Н2О | + кисл окс = соль + Н2О | ||
| + основание = соль + Н2О | + соль = др.соль+др.осн-е(РИО,↓,↑, Н2О, слаб.эл-т) | ||
| + соль = др.соль+др.к-та (РИО,↓,↑, Н2О, слаб.эл-т) | Нераств. осн. t осн окс + Н2О | ||
| Кислотный оксид | + основание = соль + Н2О | Основной оксид | + к-та= соль + Н2О |
| + осн оксид = соль | + кисл окс = соль | ||
| + вода = кислота | + вода = щелочь | ||
| + Н2 = мет+ вода | |||
| + CO = Мет + СО2 | |||
| Соль | + мет =др.соль +др.мет (см табл ниже) | CO2↑ SO2↑ Н2СО3 H2SO3 H2S↑ H2O H2O Кислоты, которые в реакции дают газы! | |
| + к-та= др.соль+др.к-та(РИО,↓,↑, Н2О, слаб.эл-т) | |||
| + осн-е = др.соль+др.осн-е(РИО,↓,↑, Н2О, слаб.эл-т) | |||
| +соль = 2 др.соли(РИО,↓,↑, Н2О, слаб.эл-т) | |||
Химические св-ва металлов.
| Высокая активность | средняя | низкая | инертны | |||||||
| Li, K, Ba, Ca, Na | Mg, Al, Mn | Zn, Cr, Fe+2, Ni, Sn, Pb, Fe+3 | H2 | Cu, Ag, Hg | Pt, Au | |||||
| +O2 | Образуют оксиды Мет + O2 = МетхОу | Не взаимод. | ||||||||
| + S | Образуют сульфиды (Метх Sу) Мет + S = МетхSу | Не взаимод. | ||||||||
| +Hal2 | Образуют галогениды (соли) Метх Halу Мет + Hal2 = МетHalу (Hal2: Cl2, F2, Br2, I2) | Не взаимод. | ||||||||
| +соль | Не вытесняют мет из р-ров солей, сразу взаимод с Н2О с образованием щелочи и Н2 | Каждый левее стоящий металл вытесняет из водных р-ров солей металл, стоящий правее мет + соль= др.мет. + др.соль | ||||||||
| + вода | Мет+ Н2О=щелочь +Н2 Al+ Н2О= Al(ОН)3 + Н2 | Мет+ Н2О= оксид металла + Н2 (кроме Al) | Не взаимод. | |||||||
Особенности взаимодействия кислот с металлами
| кислота | Конц. | Металлы (в порядке уменьшения активности) | |||||
| K,Ba,Ca,Na,Mg | Al,Fe,Cr | Zn,Sn | H2 | Cu | Hg,Ag | ||
| Н3РО4 (фосфорная) | Разб. | Соль+ водород | Соль+ водород | Соль+ водород | - | - | |
| HCl (Соляная) | Разб. | Соль+ водород | Соль+ водород | Соль+ водород | - | - | |
| Конц. | Соль+ водород | Соль+ водород | Соль+ водород | - | - | ||
| H2SO4 (Серная) | Разб. | Соль+ водород | Соль+ водород | Соль+ водород | - | - | |
| Конц. | Соль+ H2S + H2O | Мет-л пассивирует при обычн t При t: с железом Соль+SO2+H2O | Соль+SO2+H2O | Соль+SO2+H2O | Соль+SO2+H2O | ||
| HNO3 (Азотная) | Разб. | Соль+NH3 + H2O | Соль+ NO + H2O | Соль+ NO + H2O | Соль+ NO + H2O | Соль+ NO + H2O | |
| Конц. | Соль+N2O + H2O | Металл (+Ni,Pb) пассивирует при обычн t При t:Соль+ NO2 + H2O | Соль+ NO2 + H2O | Соль+ NO2 + H2O | Соль+ NO2 + H2O |
Названия кислот и солей
| Формула соответ. оксида | Формула кислоты | Название | Формула кислотного остатка (валентность) | Название кислотного остатка |
| - | HCl | Соляная | Cl (I) | Хлорид |
| - | HBr | Бромоводородная | Br(I) | Бромид |
| - | HI | Йодоводородная | I (I) | Иодид |
| - | HF | Фтороводородная | F (I) | Фторид |
| - | H2S | Сероводородная | S (II) | Сульфид |
| N2O5 | HNO3 | Азотная | NO3 (I) | Нитрат |
| N2O3 | HNO2 | Азотистая | NO2(I) | Нитрит |
| SO3 | H2SO4 | Серная | SO4(II) | Сульфат |
| SO2 | H2SO3 | Сернистая | SO3(II) | Сульфит |
| CO2 | H2CO3 | Угольная | CO3(II) | Карбонат |
| SiO2 | H2SiO3 | Кремневая | SiO3(II) | Силикат |
| P2O5 | H3PO4 | Фосфорная | PO4(III) | Фосфат |
Формулы для решения задач и величины
| величина | Единица измерения | |
| Ar | Относительная атомная масса (см таб.Менделеева) | - |
| n | Химическое количество (порция в-ва, которая содержит 6,02•1023 частиц.) | Моль |
| m | Масса | г, кг |
| Mr | Относительная молекулярная масса(сумма всех Ar в-ва) | - |
| M | Молярная масса (это масса 1 моль в-ва в граммах) | г/моль |
| V | Объем | дм3, л |
| Vm | Молярный объем газа (это объем 1 моль газа) | 22,4 дм3/моль |
| N | Число структурных единиц (атомов, ионов, молекул, формульных единиц) | штук(атомов, ионов, молекул, формульных единиц) |
| Na | Число Авогадро | 6,02•1023 моль-1 |
| ρ | Плотность | г/ см3 |
| ω | Массовая доля (масса в-ва на 100 г р-ра) | - или (%) |
| η | Выход продукта реакции | - или (%) |
| с | Молярная концентрация (химич.количество в-ва на 1 дм3 раствора) | Моль/дм3 |
| s | Коэффициент растворимости (масса в-ва в 100 г воды) | г на 100 г воды |
| α | Степень диссоциации | % |
| u | а.е.м. | 1,66•10-24(г) (10-27 кг) |
1. Общие формулы n= 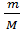 =
= 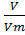 =
= 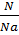 ; ρ=
; ρ=  =
= 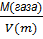
2. Нахождение массовой доли элемента ω= 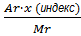 ; x=
; x= 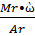
3. Формулы для растворов (сплавов) ω = 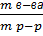 ; m(р-р) = m(в-ва) + m(воды); с=
; m(р-р) = m(в-ва) + m(воды); с=  ;
;
При долив воды: При упаривании: При досыпании в-ва: При сливании 2 р-ров:
ὼ = 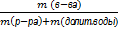 ὼ =
ὼ = 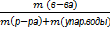 ὼ =
ὼ = 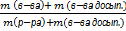 ὼ =
ὼ = 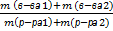
4. Нахождение массы раствора после реакции m(кон.р-ра) = m1+ m2 – m↓ - m↑
5. Формулы для выхода реакции η= 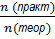 =
= 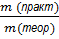 =
= 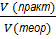 ;
;
6. Содержание примесей в техническом образце mсм = mчист + mприм
wчист.в.= 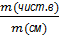 ; wприм.=
; wприм.= 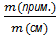
7. Формулы на газы и смеси
1) ρсм= 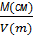 =
= 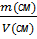
2) φ = 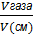 •100%
•100%
3) Мсм = 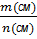
4) φ (газа)= χ(газа)= 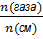
5) ω= 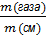 •100%
•100%
6) DB(A)= 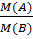 =
= 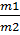 =
= 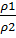
7) Dвозд(А)= 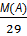
8) DН2(А)= 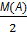
8. Растворимость s= 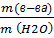 • 100; ὼ =
• 100; ὼ = 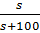 ; s=
; s= 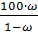
9. Степень диссоциации α = 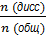 =
= 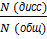 , N(общ)= N(дис) + N(нераспав)
, N(общ)= N(дис) + N(нераспав)
n(общ)= n(дис) + n(нераспав)
10. Масса атома (молекулы) m = 1u• Ar(Mr)= Ar (Mr):Na
Алгоритм решения задач по уравнению:
1. Запиши дано, уравнение, коэффициенты.
2. Данные из дано переведи в химическое количество (n)
n=  n=
n= 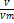 n=
n= 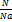
3. Составь пропорцию:
А) над уравнением пишем х и то, что получили в предыдущем действии (n)
Б) под уравнением пишем коэффициенты
В) решаем пропорцию
4. Химическое количество, полученное в пропорции, переведи в массу (V, N)
m= n•M; V= n•Vm; N= n• Na
Расчет массы исходного вещества, если известны масса продукта реакции и выход продукта.
(Если дана масса по условию, то она –практическая, теоретическую рассчитываем по уравнению (пропорции)!!)
1. Данные из дано переведи в химическое количество (n)
2. Найдите теоретическое n вещества по формуле nтеор= nпракт: η
3. Составь пропорцию и реши ее. Это вы нашли n исходного в-ва
4. Химическое количество, полученное в пропорции, переведи в массу (V, N)
Расчет массы продукта реакции, если известен выход продукта и масса исходного в-ва
1. Запишите уравнение, расставьте коэффициенты; Данные из дано переведи в химическое количество (n)
2. Найдите теоретическое количество вещества продукта реакции согласно уравнению (составь и реши пропорцию).
3. Вычислите практическое n продукта реакции nпракт = nтеор• η
4. Химическое количество, полученное в пропорции, переведи в массу (V, N)