Растворы солей хрома (III) имеют характерную зелёную окраску.
1. Реакция с пероксидом водорода H2O2. При действии окислителей на катион Cr3+ образуются соли хромовой и дихромовой кислот. В кислой среде пероксид водорода окисляет хром (III) до дихромат-иона (раствор оранжевого цвета). Пероксид водорода в щелочной среде окисляет хром (III) до хромат-иона (раствор желтого цвета).
[Cr(OH)4]- + 3H2O2 + 2OH- = 2CrO42- + 8H2O.
Методика проведения реакции. К 3 каплям раствора, содержащего ионы хрома, добавляют 3 капли раствора NaOH, 3 капли раствора H2O2, смесь подогревают. После появления желтой окраски охлаждают, добавляют 5 капель раствора HNO3 для перехода хромата в дихромат (до появления оранжевой окраски), 6 капель смеси эфира с изоамиловым спиртом и 3 капли раствора H2O2. Раствор интенсивно перемешивают. Верхний слой окрашивается в синий цвет вследствие перехода в спиртовоэфирный слой пероксида хрома:
Cr2O72- + 4H2O2 + 2H+ = 2CrO5 + 5H2O.
2. Реакция с бензидином NH2─C6H4─C6H4─ NH2. Бензидин окисляется различными окислителями, в том числе и хромат-ионами, в соединение синего цвета. Прежде чем проводить капельную реакцию, нужно окислить ион Cr3+ в CrO42- пероксидом водорода в щелочной среде.
Методика проведения реакции. К 2-3 каплям раствора соли хрома (III) прибавить раствор щелочи до растворения выпавшего осадка Cr(ОН)3, 2-3 капли 3%-го раствора H2O2 и нагреть, пока окраска из зеленой не перейдет в желтую. На полоску фильтровальной бумаги нанести каплю полученного раствора хромата и каплю бензидина. Появляется синее пятно. Эту реакцию можно использовать для дробного обнаружения Cr3+ в смеси других катионов.
3. Реакция с пероксодисульфатом аммония (NH4)2S2O8. При окислении хрома(III) пероксодисульфатом аммония в кислой среде образуются бихромат-ионы. Для ускорения реакцию проводят в присутствии катализатора - нитрата серебра.
2Cr3+ + 3S2O82- + 7H2O = Cr2O72- + 6SO42- + 14H+.
Методика проведения реакции. К 3 каплям раствора, содержащего ионы Cr3+, добавляют 3 капли HNO3, 2 капли AgNO3 и 4 капли (NH4)2S2O8. Смесь подогревают и наблюдают появление оранжевой окраски.
4. Реакция с гидроксидом аммония NH4OH. Растворы аммиака осаждают гидроксид хрома(III) серо-зеленого цвета, растворимый в избытке реагента с образованием комплексного соединения - гидроксида гексааминохрома(III) [Cr(NH3)6](OH)3.
Cr3+ + 3NH4OH = Cr(OH)3 (тв) + 3NH4+,
Cr(OH)3 + 6NH4OH = [Cr(NH3)6](OH)3 + 6H2O.
Методика проведения реакции. К 3 каплям раствора соли хрома добавляют 3 капли раствора гидроксида аммония. После выпадения осадка добавляют 6-8 капель гидроксида аммония.
Реакции катиона цинка
1. Реакция с тетрароданомеркуратом аммония (NH4)2[Hg(SCN)4]. В присутствии соли кобальта выпадает голубой осадок, состоящий из смеси солей Co[Hg(SCN)4] и Zn[Hg(SCN)4]:
Co2+ + [Hg(SCN)4]2- = Co[Hg(SCN)4](тв) – голубой
Zn2+ + [Hg(SCN)4]2- = Zn[Hg(SCN)4](тв) – белый
Методика проведения реакции. К 2-3 каплям (NH4)2[Hg(SCN)4] прибавить одну каплю очень разбавленного (0,02%) раствора СоС12. Затем в ту же пробирку добавить 1-2 капли раствора соли цинка и потереть палочкой стенки пробирки. Быстро выпадает осадок, состоящий из смеси солей Co[Hg(SCN)4] голубого цвета и Zn[Hg(SCN)4] белого цвета.
Роль цинка заключается в том, что образуемый им белый осадок как затравка ускоряет выпадение синего осадка соли кобальта. Реакция проводится в слабокислом растворе.
2. Реакция с гексацианоферратом(II) калия (желтой кровяной солью) K4[Fe(CN)6]. При проведении реакции в нейтральной или кислой среде образуется осадок двойной соли белого цвета:
Zn2+ + K4[Fe(CN)6] = K2Zn[Fe(CN)6](тв) + 2K+
Методика проведения реакции. В пробирку помещают 3 капли раствора соли цинка, 3 капли раствора гексацианоферрата(II) калия, нагревают и наблюдают образование белого осадка.
3. Реакция с дифенилтиокарбазоном (дитизоном) (C6H5)2CSN4H2. При добавлении раствора дитизона в хлороформе CHCl3 к водному раствору, содержащему ионы цинка, образуется дитизонат цинка, окрашивающий в щелочной среде хлороформный и водный слой в красный цвет. Мешают определению ионы Ag+, Hg2+, Pb2+, Cu2+, Cd2+, Co2+, Ni2+, Bi3+.
Методика проведения реакции. К 3-4 каплям раствора, содержащего ионы цинка, прибавляют 3-4 капли 2 н. раствора NaOH. Каплю полученного щелочного раствора наносят капилляром на фильтровальную бумагу. Пятно обводят по периферии капилляром с раствором дитизона в CCl4. Образуется характерное красное кольцо, которое сравнивают с контрольным опытом. Для этого рядом помещают на бумагу каплю 2 н. NaOH и также обводят ее капилляром с раствором дитизона в CCl4. Образуется оранжевое пятно.
Вывод:
Из общей характеристики катионов III группы следует, что их соли – сульфиды – нерастворимы в воде, но растворяются в разбавленных сильных кислотах, отличаясь тем самым от сульфидов катионов I и II групп.
Групповым реактивом на катионы III группы является сульфид аммония, с катионами железа, цинка, марганца образует сульфиды. С катионами хрома, алюминия образует гидроксиды. Образование гидроксидов хрома и алюминия объясняется наличием гидроксид – ионов ОН.
При обменных реакциях образуются наименее растворимые вещества. В случае катионов Al3+ и Cr3+ наименее растворимы гидроксиды, поэтому они и выпадают из раствора. Из соединений остальных катионов III группы наименьшей растворимостью отличаются сульфиды, поэтому они и выпадают из раствора. Следует иметь в виду, что при осаждении сульфидов очень сильное влияние оказывает концентрация ионов водорода.
Амфотерность гидроксидов изучалась в курсе неорганической химии, явление следует вспомнить, т.к. амфотерность играет большую роль в химическом анализе.
Типичными амфотерными гидроксидами катионов III группы являются Z(OH)2, Al(OH)3, Cr(OH)3. Амфотерные свойства этих гидроксидов проявляются в том, что при диссоциации они дают как ионы Н+, так и ионы ОН-
При действии кислот на амфотерный гидроксид он реагирует как основание: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
При действии щелочей он реагирует как кислота:
Zn(OH)2 + 2NaOH = Na2 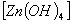 Тетрагидроксоцинкат натрия
Тетрагидроксоцинкат натрия
Следовательно, в кислых растворах присутствуют ионы: Zn2+, Al3+, Cr3+, а в щелочных растворах – в виде анионов тетрагидроксоцинкат-иона 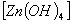 2-, гексагидроксоалюминат-иона
2-, гексагидроксоалюминат-иона 
 3-, гексагидроксо (III) хромат-иона
3-, гексагидроксо (III) хромат-иона 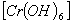 3-. Для отдаления Zn2+, Al3+, Cr3+ - ионов от остальных катионов III группы можно воспользоваться действием избытка щелочи, осаждающей все остальные катионы в виде гидроксидов. В растворе остаются цинкат, алюминат и хромит ионы.
3-. Для отдаления Zn2+, Al3+, Cr3+ - ионов от остальных катионов III группы можно воспользоваться действием избытка щелочи, осаждающей все остальные катионы в виде гидроксидов. В растворе остаются цинкат, алюминат и хромит ионы.
Окислительно-восстановительные реакции изучались в курсе неорганической химии, поэтому учащийся должен вспомнить, что химические процессы, связанные с изменением степени окисления элементов или ионов, участвующих в реакции, называют окислительно-востановительными.
Катионы III группы склонны к реакциям окисления-восстановления. Многие катионы III аналитической группы открываются, осаждаются реакциями окисления-восстановления.
Названия комплексных солей образуют по общему правилу: сначала называют анион, а затем – катион в родительном падеже. В названии комплексной частицы в определенном порядке перечисляются все ее составные части. В начале называют лиганды ионного происхождения, количество лигандов обозначают, используя греческие числительные 2-ди, 3-три, 4-тетра, 5-пента, 6-гекса. К латинскому названию анионного лиганда добавляется окончание «о» (при этом, если название аниона оканчивается на «ид», то оно отбрасывается), Cl- - хлоро, F- - фторо, для обозначения таких лигандов, как Н+ и S2-, используются названия «гидридо» и «тио» (соответственно).
Затем указывают число и название молекулярных лигадов, причем вода называется – акво, аммиак – аммин.
Последним называется комплексообразователь. Если он входит в состав катиона или молекулы, то ему дается русское название данного элемента и указывается степень его окисленности (в скобках римскими цифрами после названия комплексообразователя).
Название комплексного аниона составляют аналогично названию катиона и заканчивают суффиксом «ат».
Название нейтральных комплексных частиц образуют так же, как и катионов, но комплексообразователи называют в именительном падеже, а степень окисленности не указывают, так как она определяется электронейтральностью комплекса:
1. Комплексная соль содержит комплексный катион:
 SO4 – сульфат бромопентаамминокобальта (III)
SO4 – сульфат бромопентаамминокобальта (III)
2. Комплексная соль содержит комплексный анион:
(NH4)2 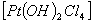 - дигидроксотетрахлороплатинат (IV) аммония
- дигидроксотетрахлороплатинат (IV) аммония
3. Нейтральная комплексная частица:
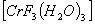 - трифторотриаквохром (III)
- трифторотриаквохром (III)