Обучающийся должен проделать следующие реакции катионов:
· Катион железа Fe3+ - с групповым реактивом (NH4)2S, едкой щелочью NaOH, гидроксидом аммония NH4OH, хлоридом аммония NH4Cl
· Катион хрома Cr3+ - с групповым реактивом, едкой щелочью, реакция окисления до хромат-иона CrO4
· Катион цинка Zn2+ - с групповым реактивом, едкой щелочью, гидроксидом аммония
· Катион марганца Mn2+ - с групповым реактивом, едкой щелочью, висмутатом натрия NaBiO3, окисление в марганцевую кислоту HМnO4
Контрольные вопросы
1. Чем отличаются химико – аналитические свойства катионов III группы от свойств катионов I и II групп?
2. В виде каких соединений переходят в осадок катионы III группы при действии сульфида аммония (NH4)2S в присутствии гидроксида аммония NH4OH? Подтвердите уравнениями реакций.
3. Гидроксиды каких катионов обладают амфотерным характером? Какими свойствами обладает амфотерный гидроксид? Подтвердите уравнениями реакций.
4. Как отделить катион Zn2+ от катиона Al3+? Подтвердите уравнениями реакций.
5. Как отделить катион Mn2+ от катиона Al3+? Подтвердите уравнениями реакций.
6. Составьте схему разделения и открытия катионов: Fe3+, Mn2+, Zn2+. При разделении предусматрите наименьшее число операций
7. Для чего в ходе анализа катионов III группы при отделении амфотерных катионов от неамфотерных прибавляют перекись водорода?
8. Какие процессы называются окислительными и какие восстановительными? Разберите окислительно-восстановительные уравнения реакций:
FeSO4 + HNO3 + H2SO4 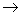 Fe2(SO4)3 + NO + H2O
Fe2(SO4)3 + NO + H2O
SO2 + KmnO4 + KOH 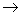 K2SO4 + MnO2 + H2O
K2SO4 + MnO2 + H2O
K2Cr2O7 + KJ + H2SO4 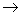 Cr2(SO4)3 + J2 + K2SO4 + H2O
Cr2(SO4)3 + J2 + K2SO4 + H2O
9. Определите заряд и координационное число центрального атома в следующих комплексных солях: К2 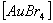 ; Na2
; Na2 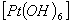 . Дайте схему строения комплексного иона.
. Дайте схему строения комплексного иона.
10. Определите величину и знак заряда комплексных ионов:
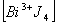 ;
; 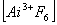 ;
; 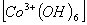 .
.
Четвертая группа катионов
Групповым реактивом на катионы является сероводород H2S, который осаждает катионы IV группы в кислой среде, добавляя соляную кислоту HCl. Это отличает сульфиды катионов IV группы от сульфидов катионов I, II, III групп, которые растворимы в воде или в сильных кислотах. Сульфиды катионов IV группы растворимы только в концентрированной азотной кислоте HNO3. Растворение является окислительно-восстановительной реакцией.
Например: 3Ag2+S-2 + 8H+NO3-2 = 6Ag+N+5O3-2 + 2N+2O-2 + 3S0 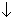 + 4H2+O-2
+ 4H2+O-2
3 S-2 – 2e = S0 восст-ль окисление
2 N+5 + 3e = N+2 окис-ль восстановление
Катионы IV группы делятся на подгруппы. Деление основывается на различии растворимости хлоридов серебра AgCl, свинца PbCl2 (I подгруппа) и меди CuCl2 (II подгруппа).
Изучая тему «Катионы IV группы», следует повторить понятия «амфотерность», «окислительно-восстановительные реакции», «комплексные соли».
Содержание лабораторных работ по IV аналитической группе катионов.
Изучение частных реакций катионов и решение контрольной задачи.
Обучающийся должен проделать следующие реакции катионов:
· Катион серебра Ag+ - реакция с групповым реактивом – сероводородом H2S, едкой щелочью NaOH, соляной кислотой HCl, Хроматом калия K2CrO4;
· Катион свинца Pb+ - реакция с групповым реактивом – сероводородом H2S, едкой щелочью NaOH, гидроксидом аммония NH4OH.
Систематический ход анализа смеси катионов IV группы.
Контрольная задача – анализ смеси катионов IV группы.
Контрольные вопросы
1. Как произвести разделение катионов IV группы на подгруппы?
2. Как отделить катион серебра от катиона свинца? Подтвердите уравнениями реакций.
3. Как действует на ион меди гидроксид аммония? За счет каких ионов раствор окрашивается в темно-синий цвет? Подтвердите уравнениями реакций в молекулярной и ионной формах.