ГЕНЫ
ПРЕДРАСПОЛОЖЕННОСТИ,
Или Болезни, которые нас
Выбирают...
Член-корреспондент РАМН B.C. БАРАНОВ, Институт акушерства и гинекологии им. Д.О. Отта РАМН ____________ (Сан кт- П етербург) ____________
Наступивший XXI в. стартовал под флагом биологии и генетики.
Впервые ученым удалось расшифровать геном человека,
Полностью прочитать (просеквенировать) «нить жизни» —
Гигантскую молекулу ДНК, в структуре которой закодировано
Не только все прошлое людей (филогенез), весь процесс развития
каждого индивида (онтогенез), но и содержатся молекулярные основы будущей эволюции человека.
| К |
ак всякое научное открытие, расшифровка генома человека привела к появлению новых важных научных направлений*, в том числе и в молекулярной медицине, основанной на диагностике, лечении и профилактике наследственных и ненаследственных болезней с помощью самих генов, точнее — нуклеиновых кислот.
* См.: Ю.П. Алтухов. Природоохранная генетика; К.В. Судаков, К.В. Анохин. Гены, мозг и поведение. — Наука в России,
2002, № 3 (прим. ред.).,
Что же отличает молекулярную медицину от традиционной, хорошо всем знакомой с детства? Прежде всего — универсальность диагностики, базирующейся на точных методах анализа самих генов. Ее профилактическая направленность — возможность с высокой вероятностью прогнозировать возникновение того или иного заболевания (предиктив-ная медицина). Она имеет четко выраженную индивидуальность (лекарства подбирают каждому больному, как костюм на заказ). При этом широко применяют генную терапию —
использование генов и их продуктов для лечения разных наследственных и ненаследственных болезней.
Следует подчеркнуть: люди отличаются друг от друга не только социальными особенностями (происхождение, воспитание, образование и т.д.), но и спецификой молекулярной структуры своего наследственного аппарата. Как показывают результаты сравнительного анализа, частота вариабельности (изменчивости) молекулярной структуры гено-мов разных индивидуумов составляет около 0,1%. Это означает: раз-

|
«Генная сеть» бронхиальной астмы.
личия (замены отдельных «букв») встречаются очень часто — примерно через каждые 400 знаков, что предполагает наличие 9 000 000 замен на каждый геном! Подобные варианты нередки и внутри самих генов. Их результатом может стать полиморфизм, в итоге чего синтезируются белки с необычными, сильно измененными свойствами, не схожими с нормальными. Существование таких функционально различных белков (изоферментов, гормонов и пр.) создает биохимический паттерн каждого человека, его биохимический «фингерпринт» по аналогии с уникальным рисунком отпечатков пальцев.
Подобные замены в генах далеко не всегда нейтральны. Они, а точнее продукты деятельности таких генов, как правило, работают менее эффективно и делают человека уязвимым к тому или иному заболеванию. Особенно ярко эту мысль выразил директор международной программы «Геном человека» Ф. Коллинз: «Никто из нас не совершенен. Все больше генетических тестов становится доступно и каждый из нас, в конечном счете, обнаруживает у себя мутацию, предрасполагающую к какой-нибудь болезни».
Действительно, именно при помощи генетических тестов у человека любого возраста, а при необходимости даже внутриутробно, можно установить предрасположенность к тому или иному заболеванию. При этом, естественно, анализируют не все, а только определенные гены — гены предрасположенности. Они совместимы с жизнью, однако при определенных неблагоприятных воздействиях внешних факторов (лекарства, диета, загрязнения воды, воздуха и т.д.) или продуктов других генов могут быть причиной различных, в том числе и столь частых недугов, как диабет, остеопороз, атеросклероз, инфаркт миокарда, а также психических расстройств, злокачественных новообразований и так называемых мультифакториальных заболеваний. Причем к большинству из них приводят мутации не отдельных, а многих разных генов (генных сетей), обеспечивающих соответствующие метаболические процессы. В последнее время именно расшифровка составляющих элементов этих сетей при соответствующих заболеваниях, выяснение роли полиморфизма отдельных генов в их возникновении составляет «горячую сферу» предик-тивной медицины.
Важным разделом последней является фармакогенетика — понимание генетически обусловленных особенностей индивидуальной реакции организма на различные фармакологические препараты (по некоторым данным, ежегодно в мире погибает свыше 100 тыс. человек в связи с неправильной дозировкой лекарств, если игнорируют индивидуальную вариабельность их действия).
Не так давно разработаны и сейчас широко применяются в лаборатори-

|
ях и диагностических центрах многочисленные генетические тесты. Часть из них направлена на обнаружение носителей мугантных генов, приводящих к таким тяжелым наследственным заболеваниям, как муковисцидоз (застаивание секрета повышенной вязкости в том или ином органе, что приводит к нарушению его деятельности), фиенел-кетонурия (нарушение обмена веществ), гемофилия (повышенная кровоточивость) и др. Знание их особенно необходимо в семьях высокого риска, где уже есть больной ребенок. Они позволяют выявить носителей соответствующих мугантных генов и предотвратить рождение второго заведомо больного ребенка благодаря своевременной дородовой (пренатальной) диагностики. Существует, однако, большая группа ней-родегенеративных и некоторых онкологических заболеваний (рак молочной железы, толстого кишечника и т.п.), первые клинические проявления которых наблюдаются сравнительно поздно, уже в зрелом возрасте. Для таких недугов разработаны методы досимптоматической диагностики.
Наконец, сейчас все больше внимания уделяется генетическим тестам, направленным на выявление наследственной предрасположенности к диабету, остеопорозу, атеросклерозу, болезням сердечно-сосудистой системы, нейропсихическим и онкологическим недугам. Как показывает анализ мировой литературы, для клинического применения уже доступны около 150—200 генетических тестов. Их широко применяют в различных центрах США и стран Западной Европы, особенно во Франции, Великобритании и ФРГ.
Во Франции, например, разработана и уже используется в медицинской практике система SESAM. Она включает в себя компьютерную интерпретацию результатов генетического тестирования, а также данные биохимических, серологических и иммунологических анализов. В ходе ее выполнения уже используют свыше
«Генетизация» человечества в XXI в.
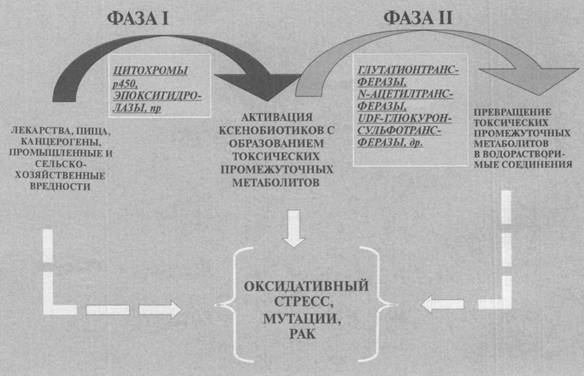
80 тестов, которые обрабатывают при помощи специальной компьютерной программы РРМА. Последняя включает в себя собственно экспертную оценку, разделы обучения и тренинга для практикующих врачей, медицинское консультирование и справочник для населения. Не случайно именно в этой стране в 2001 г. был проведен 1-й Международный конгресс по предиктивной медицине. Основной упор в данной программе сделан на интерпретацию результатов различных генетических тестов, в первую очередь на изучение состояния генов системы детоксика-ции, ответственных за чувствительность человека к различным внешним воздействиям, особенно к химическим препаратам, лекарствам, другим ксенобиотикам.
В свою очередь, в Великобритании
осуществляют масштабный проект по созданию Биобанка, содержаще-
|
Основные фазы процесса детоксикации.
го генетическую информацию о более 500 тыс. британцах разных рас и этнических групп с целью изучения диабета, рака, болезни Альцгеймера, сердечно-сосудистых недугов. Предполагается, что этот проект (в случае его успешной реализации) станет началом новой эры в медицине, так как с его помощью появится возможность прогнозировать и лечить заболевания, основываясь на индивидуальных генетических особенностях пациентов.
В России аналогичных программ пока нет. Однако различные предик-тивные генетические тесты уже проводятся в молекулярных лабораториях и центрах Москвы, Санкт-Петербурга, Новосибирска, Томска и Уфы.
В частности, исследования по пре-диктивной медицине в НИИ акушерства и гинекологии имени Д.О. Отта РАМН, начатые еще в 1995 г., касались наследственной предрасположенности к такому частому муль-тифакториальному заболеванию, как эндометриоз (занос слизистой оболочки тела матки в различные ткани и органы). Этим недугом, нередко приводящим к бесплодию, страдает от 10 до 55% всех женщин. В серии экспериментов нами установлено: эндометриоз чаще развивается у женщин с нулевыми аллельными* вариантами генов, отвечающих за 2-ю фазу детоксикации ксенобиоти-ков — глутатион-трансферазы Ml и TI (GSTMI О/О, GSTTI О/О) в сочетании с медленной формой М-аце-тилтрансферазы (NAT-2). Более того, оказалось: пациентки с неблагоприятным сочетанием этих аллелей, страдающие эндометриозом, имеют выраженную резистентность (устойчивость) к медикаментозной терапии, особенно при использовании иммуномодуляторов. Тестирование генов системы детоксикации позволяет не только выявить женщин с наследственной предрасположенностью к этому тяжелому заболеванию, но и оценить прогноз его течения, выбрать оптимальную стратегию лечения.
Высокодостоверная корреляция функционально неблагоприятных аллелей генов детоксикации (GSTMI, GSTTI) обнаружена нами и в отно-
* Аллели — различные формы одного и того же гена, расположенные в одинаковых участках (локусах) гомологичных парных хромосом (прим. ред.). шении столь частых легочных заболеваний, как бронхиальная астма и тяжелый хронический бронхит. А при наличии в геноме сразу нескольких нулевых аплельных вариантов (GSTMI О/О, GSTTI О/О) вероятность бронхиальной астмы у ребенка возрастает более чем в 10 раз! Нулевые аллели (GSTMI О/О, GSTTI О/О) в сочетании с медленной формой плацентарной* глутатион-трансферазы (GSNPi) встречаются в 3 раза чаще у женщин, страдающих невынашиванием плода, что, к сожалению, свойственно 10—25% представительниц слабого пола. Гены системы детоксикации, как показало дальнейшее изучение, вовлечены и в такие нередкие заболевания, как рак легкого, алкогольный цирроз печени. Ферменты, контролируемые этими генами, важны для метаболизма всех ксенобиотиков, включая различные фармпрепараты.
Естественно, гены системы детоксикации — лишь одни из многих генных комплексов, чье тестирование важно для целей предиктивной ме-
* Плацентарные — группа живородящих млекопитающих, чьи зародыши развиваются в матке с образованием плаценты (прим. ред.).
дицины. Существенное значение в наследственной предрасположенности имеют и другие гены, в частности, контролирующие трансмембранный перенос метаболитов, а также гены, продукты которых играют ключевую роль в клеточном процессе.
Сотрудники нашего института показали: наличие аллелей коллагено-вого* гена CoIIAI и гена рецептора витамина D-VDR-3 повышает индивидуальную чувствительность к тяжелой форме остеопороза соответственно в 17,8 и 5,4 раза. Еще неблагоприятнее прогноз в отношении остеопороза при сочетании в одном организме функционально ослабленных аллелей этих обоих генов. А выявление их в гене андрогенных рецепторов ADR позволяет судить о предрасположенности к раку простаты. Наличие аллельной формы в сочетании с протяженной делецией (потерей) в гене рецепторов лимфоцитов CCR-5 позволяет обнаружить лиц с повышенной восприимчивостью ВИЧ-инфекции.
Словом, как ни печально, однако приходится констатировать: люди зачастую рождаются с набором генов, способствующих развитию того или иного тяжелого заболевания. Причем в каждой семье и у каждого человека выраженность наследственной предрасположенности к конкретному недугу сугубо индивидуальна. Тестирование соответствующих генов позволяет не только выявить лиц с повышенным риском этих и других мультифакториальных заболеваний, но и оптимизировать стратегию их лечения.
Следует отметить: достаточно объективная информация о наследственной предрасположенности к любым болезням, которые «тянутся» от родителей, может быть получена в результате тестирования не одного или двух, а сразу нескольких различных генов. В настоящее время методы этого поиска разработаны для более 25 мультифакториальных заболеваний: ишемическая болезнь сердца, сахарный диабет, гипертония, рак молочной железы, легких, предстательной железы, наркомания, бронхиальная астма, алкоголизм, психоневрологические расстройства и др.
* Коллаген — белок, составляющий основу соединительной ткани животных и человека (прим. ред.).
Помимо нашего института, новые подходы к выявлению наследственной предрасположенности активно разрабатывают и в других научно-практических центрах России. В Санкт-Петербурге — это НИИ онкологии им. Н.Н. Петрова (различные опухоли), Педиатрическая медицинская академия (диабет, сердечнососудистые заболевания), Санкт-Петербургский медицинский университет им. академика И.П. Павлова Министерства здравоохранения РФ (сердечно-сосудистые заболевания, атеросклероз), НИИ экспериментальной медицины РАМН (атеросклероз), Институт геронтологии (наркомания, сердечно-сосудистые заболевания). В Москве данной проблематикой успешно занимаются в НИИ генетики и селекции промышленных микроорганизмов (диабет), Научном центре медицинской генетики РАМН (онкология, диабет, сердечно-сосудистые заболевания). К аналогичным исследованиям приступили Уфимский научный центр РАН (наркомания, диабет, атеросклероз, ишемическая болезнь сердца), а также НИИ медицинской генетики Томского научного центра СО РАМН (сердечно-сосудистые заболевания, гипертония, бронхиальная астма и др.).
Ко всему сказанному добавим: идентификация известных генов человека, открытие новых полиморфизмов неизмеримо увеличивают возможности тестирования наследственной предрасположенности и медико-генетического консультирования. Существенную помощь в этом могут оказать современные технологии. В частности, методы анализа на основе микрочипов, позволяющие одномоментно тестировать тысячи генетических полиморфизмов у одного человека или сразу у многих людей. Такой подход особенно важен для суждения о генетической структуре населения целого государства, планирования наиболее эффективной системы профилактики частых мультифакториальных болезней. Отрадно отметить наличие приоритетных отечественных разработок в области микрочиповой технологии генного полиморфизма, выполненных в Институте молекулярной биологии им. В.А. Энгельгардта РАН (Москва).
Итак, благодаря генетическим тестам уже на начальных этапах эмбрионального развития плода можно получить достаточно объективную информацию о том, какие болезни уже «выбрали» нас, т. е. понять, носителями каких мутантных генов мы являемся. Вполне реально сегодня узнать, в какой мере те или иные особенности нашего генома могут представлять реальную угрозу для здоровья родных детей и близких по крови людей, а также привести нас самих к тяжелым, неизлечимым заболеваниям. Внедрение в практическую медицину пренатальной диагностики наследственных болезней, скрининг (обследование) носителей мутантных генов и проведение генетических тестов активно способствуют формированию соответствующей базы данных для отдельных индивидуумов и целых семей. Дополненная сведениями о кариотипе (наборе хромосом) и генетическим номером (уникальный генетический код каждого человека, устанавливаемый методами геномной дактилоскопии), эта база может представить собой своеобразный «генетический паспорт».
Казалось бы, польза от него очевидна: человек полностью осведомлен о слабых и сильных сторонах своего наследственного аппарата (генома), а с помощью врачей, особенно семейного доктора, он способен предвидеть и даже предотвратить многие неприятные неожиданности, связанные с собственным здоровьем или здоровьем близких.
Проблема, однако, заключается в том, что далеко не каждый гражданин хочет и готов знать о «подводных камнях» своей наследственности. Не менее серьезным вопросом является обязательное соблюдение строгой конфиденциальности соответствующей информации. Решение этих и многих других трудностей требует детального осмысления учеными и обществом возникших задач, четкой регламентации и гармоничной социальной адаптации применения достижений предиктивной медицины.
Иллюстрации предоставлены автором