Покажите геометрическую структуру молекул, используя графическое изображение атомной орбитали. Определите полярность связи, полярность молекул.
Например, Ковалентная связь в молекулах H2S и RuCl2 образуется по обменному механизму за счет перекрывания атомных орбиталей, имеющих по одному неспаренному электрону.
А + В → АВ
Рассмотрим механизм образования молекулы H2S.
Две ковалентные связи в молекуле H2S образуются за счет перекрывания двух р -орбиталей атома серы с двумя s -орбиталями двух атомов водорода.
S…3s23p4
H…1s1
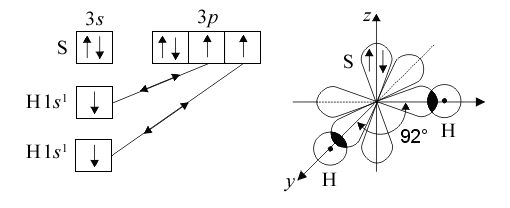
Пространственная ориентация р -орбиталей атома серы – вдоль трех осей, находящихся под углом 90о друг к другу. Молекула H2S имеет угловую структуру, угол между связями ≈ 900 (920).
Атомы водорода и серы имеют разное значение электроотрицательности:
ЭО(Н) = 2,1 и ЭО(S) = 2,5. Таким образом, DЭО ¹ 0, т.е. связь полярная,электрический момент диполя связи m св ¹ 0.
Структура молекулы Н2S – угловая, векторная сумма дипольных моментов связи m св имеет вид:

Векторная сумма дипольных моментов связи m св характеризует
электрический момент диполя молекулы m м:
m м = S m св ¹ 0, следовательно, молекула Н2S в целом полярная.
Рассмотрим механизм образования молекулы RuCl2.
В молекуле RuCl2 образуются две ковалентные связи.
В атоме хлора Cl имеется неспаренный электрон на р -орбитали для образования связи.
В атоме рутения Ru неспаренных электронов на последнем электронном уровне нет. Атом рутения переходит в возбужденное состояние Ru*. Возбужденный атом рутения для образования двух ковалентных связей с двумя атомами хлора предоставляет два неспаренных электрона, находящихся на разных орбиталях: один – на s -орбитали, другой – на р -орбитали, т.е. имеет место sр-гибридизация атомных орбиталей рутения.
Ru…4 d 65 s 2
Сl …3 s 23 р 5
Ru*…4 d 65 s 15 p 1
Сl …3 s 23 р 5
Пространственная структура молекулы RuCl2 линейная, угол между связями 1800 .

Cl Ru Cl
Атомы хлора и рутения имеют разное значение электроотрицательности:
ЭО(Cl) = 3,0 и ЭО(Ru) = 2,2. Таким образом, DЭО ¹ 0 т.е. связь полярная,электрический момент диполя связи m св ¹ 0.
Структура молекулы RuCl2 – линейная, векторная сумма дипольных моментов связи m св имеет вид:
m св ←→ m св
Векторная сумма дипольных моментов связи m св характеризует
электрический момент диполя молекулы m м:
m м = S m св = 0, следовательно, молекула RuCl2 в целом неполярная.
ЗАДАЧА 2. Комплексные соединения.
Например, дано комплексное соединение Na2[Ni(NO2)4].
Определите заряд комплексного иона. Укажите комплексообразователь и его заряд; лиганды; координационное число.
В комплексном соединении Na2[Ni(NO2)4] внешняя сфера состоит из двух ионов натрия Na+; заряд комплексного иона [Ni(NO2)4]2 -
Z = -2, это - анионный комплекс.
Комплексообразователь в данном комплексном ионе – Ni2+;
лиганды – NO2-; координационное число n =4.
Покажите механизм образования связей в комплексном ионе. Определите тип гибридизации, реализующейся при образовании связей, пространственную структуру комплексного иона.