19. Магний, как активный металл, восстанавливает сурьму из ее соединений:
2SbCl3 + 3Mg ® 3MgCl2 + 2Sb¯.
20. Равновесный потенциал пары (Bi(III)/Bi) существенно положительнее по сравнению с парой (Zn2+/Zn), в результате чего протекает реакция:
3Zn + 2Bi(NO3)3® 2Bi¯ + 3Zn(NO3)2.
21. Окислительные свойства соединений Bi(III) могут быть продемонстрированы в реакции с восстановителем – комплексом Sn(II):
SnCl2 + 3NaOH®Na[Sn(OH)3] + 2NaCl
2Bi(NO3)3 + 3Na[Sn(OH)3] +9NaOH® 2Bi¯ + 3Na2[Sn(OH)6] + 6NaNO3.
22. При постепенном добавлении раствора щелочи к раствору SbCl3 происходит образование белого осадка Sb(OH)3:
SbCl3 + 3NaOH (по каплям) ®Sb(OH)3¯ + 3NaCl
Гидроксид сурьмы(III) амфотерен:
Sb(OH)3¯ + 3HCl®SbCl3 + 3H2O
Sb(OH)3¯ + NaOH®Na[Sb(OH)4].
Координационное число Sb(III) равно четырем. Комплексы имеют геометрию бисфеноида.
23. Выпадение белого осадка Bi(OH)3 происходит в результате протекания реакции:
Bi(NO3)3 + 3NaOH®Bi(OH)3¯ + 3NaNO3.
Гидроксид висмута(III) практически не проявляет амфотерных свойств:
Bi(OH)3¯ + 3HNO3® Bi(NO3)3 + 3H2O
 Bi(OH)3¯ + NaOH® (реакция не идет в растворе).
Bi(OH)3¯ + NaOH® (реакция не идет в растворе).
24. Гидролиз соединений Sb(III) и Bi(III) приводит к выпадению осадков сложного состава:
3 n SbCl3 + 3 n H2O® (Sb3O3Cl2) n Cl n ¯ + 3 n HCl.
Формально формулу осадка можно описать формулой SbOCl, однако ионов антимонилаSbO+ он не содержит. На самом деле, строение соединения полимерное, оно состоит из пирамид SbO3, связанных друг с другом мостиковыми атомами кислорода, и содержащими мостиковые группы. В растворе хлористоводородной кислоты осадок растворяется:
SbOCl¯ + 2HCl®SbCl3 + H2O.
25. Гидролиз соединений висмута также приводит к образованию соединений сложного состава и может быть описан уравнением:
6Bi3+ + 8H2O® [Bi6O4(OH)4]6+¯ +12H+.
Упрощенно осадки могут быть представлены как соливисмутила, например, BiONO3, BiOCl.
26. Добавление раствора KI к раствору, содержащему соли Bi(III), приводит к образованию черного BiI3:
Bi(NO3)3 + 3KI ® BiI3¯ + 3KNO3.
В избытке раствора KI выпавший осадок растворяется с образованием комплексного соединения:
BiI3¯ + KI®K[BiI4].
Сильное разбавление раствора приводит к разрушению координационного соединения и выпадению черного осадка BiI3:
K[BiI4] ®BiI3¯ + KI (сильное разбавление).
27. Добавление раствора сульфидов к раствору Sb(III) приводит к образованию оранжево-красного Sb2S3:
2SbCl3 + 3Na2S®Sb2S3¯ + 6NaCl.
Сульфид сурьмы(III) имеет кислотный характер, поэтому при действии избытка сульфида натрия происходит растворение осадка с образованием раствора тиосоли:
Sb2S3¯ + 3Na2S® 2Na3SbS3.
Действие кислоты при нагревании приводит к разрушению тиосоли:
2Na3SbS3 + 6HCl ® Sb2S3¯ + 3H2S + 6NaCl.
28. При действии сульфида натрия на растворимые соли Bi(III) происходит образование черного Bi2S3:
2Bi(NO3)3 + 3Na2S ® Bi2S3¯ + 6NaNO3.
В отличие от Sb2S3, сульфид висмута не растворяется в растворе Na2S, т.к. имеет основный, а не кислотный характер, т.е. не является тиоангидридом:
 Bi2S3 + Na2S® реакция не идет.
Bi2S3 + Na2S® реакция не идет.
29. При окислении сурьмы концентрированным раствором азотной кислоты происходит образование белого гидратированного оксида сурьмы Sb2O5× n H2O:
2Sb + 10HNO3конц 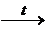 Sb2O5× n H2O + 10NO2 + (5– n)H2O.
Sb2O5× n H2O + 10NO2 + (5– n)H2O.
Оксид сурьмы(V) обладает преимущественно кислотным характером:
Sb2O5× n H2O + 2KOH + (5– n)H2O® 2K[Sb(OH)6].
Sb2O5 способен проявлять окислительные свойства:
Sb2O5 + 12HClконц®2H[SbCl4] + 2Cl2 + 5H2O.