Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
Растворы по агрегатному состоянию бывают жидкие (раствор соли, кровь), твердые (сплавы металлов) и газообразные (воздух).
Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении. В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Образование раствора зависит от характера взаимодействия частиц растворителя и растворенного вещества, и их природы.
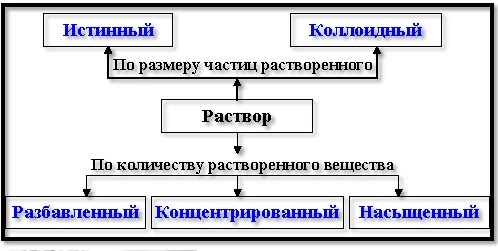
В истинных растворах размер частиц менее 1 нм, частицы в таких растворах невозможно обнаружить оптическими методами; в то время как в коллоидных растворах размер частиц 1 нм — 100 нм, частицы в таких растворах можно обнаружить при помощи ультрамикроскопа (эффект Тиндаля).
По соотношению преобладания числа частиц, переходящих в раствор или удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. По относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Разбавленные растворы - растворы с небольшим содержанием растворенного вещества.
Концентрированные растворы - растворы с большим содержанием растворенного вещества.
Раствор, содержащий растворенного вещества больше, чем его должно быть в данных условиях в насыщенном растворе, называется пересыщенным. Пересыщенные растворы представляют собой неустойчивые, неравновесные системы, в которых наблюдается самопроизвольный переход в равновесное состояние. При этом выделяется избыток растворенного вещества, и раствор становится насыщенным.
|
|
Насыщенный раствор – это раствор, в котором данное вещество при данной температуре больше не растворяется.
Ненасыщенный раствор - это раствор, в котором при данной температуре вещество ещё может растворяться.
Суспензией называют взвесь, в которой мелкие частицы твёрдого вещества равномерно распределены между молекулами воды.
Эмульсией называют взвесь, в которой мелкие капельки какой-либо жидкости распределены между молекулами другой жидкости.
Коэффициент растворимости – отношение массы растворенного вещества к массе растворителя (например, 10 г соли на 100 г воды).
По способности растворяться вещества условно делят на:
§ малорастворимые (от 0,001 до 1 грамма растворенного вещества на 100 грамм растворителя);
§ растворимые (больше 1 г растворенного вещества на 100 г растворителя);
§ нерастворимые (менее 0,001 г растворенного вещества на 100 г растворителя).
При попадании в воду вещество может:
1. раствориться в воде, то есть перемешаться с ней на атомно-молекулярном уровне;
2. химически прореагировать с водой;
3. не раствориться в воде и химически не прореагировать.
Одни вещества хорошо растворяются в воде, другие мало, а третьи – не растворяются совсем.
Растворение – физико–химический процесс, не ведущий к превращению одних веществ в другие.
Физический – разрушение структуры растворяемого вещества
|
|
Химический – образование гидратов (сольватов, если растворитель не вода), вследствие взаимодействия молекул растворителя с частицами растворённого вещества).
Если на разрушение кристаллической решётки затрачивается больше энергии, чем выделяется при образовании гидратов, то растворение сопровождается охлаждением раствора (NH4NO3; KNO3), а если меньше – нагреванием (приготовление растворов щелочей, кислот).
Растворение газов и жидкостей не сопровождается разрушением кристаллической решётки, поэтому такие процессы растворения всегда экзотермические.
Тепловые эффекты растворения подавляющего большинства веществ незначительны, потому не заметны.
Растворимость увеличивается с ростом температуры (бывают исключения). Вы прекрасно знаете, что удобнее и быстрее растворять сахар в горячей, а не в холодной воде.
Задание. Пользуясь таблицей рстворимости,определите растворимость следующих веществ: AgNO3, Fe(OH)2, Ag2SO3, Ca(OH) 2, CaCO3, MgCO3, KOH.
Растворимость веществ
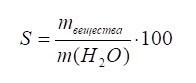
Растворимость (S)
1.Растворимость – способность веществ равномерно распределяться в виде атомов, молекул или ионов по всему объёму растворителя.
Количественно растворимость вещества выражают максимальным числом граммов вещества, которое растворяется в 100 г воды при данной температуре.
Коэффициент растворимости (растворимость) S – это максимальное число граммов вещества, которое растворяется в 100 г воды при данной температуре.
При этом получается насыщенный раствор при данной температуре.
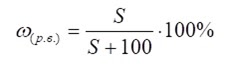
Процентная концентрация насыщенного раствора (%)
|
|
2. Для газов растворимость часто выражают максимальным объёмом газа, который растворяется в 1 л воды при данных условиях (температуре и давлении).
Например, S20°C=2,5л (при 20°С в 1 л воды растворяется 2,5 л сероводорода)
3. Некоторые жидкости (этиловый спирт, ацетон) смешиваются с водой в любых соотношениях. В этом случае говорят о неограниченной растворимости жидкостей друг в друге.
4. По растворимости в воде вещества делят на:
1. Хорошо растворимые (S> 1 г)
2. Малорастворимые (S= 0,01 – 1 г)
3. Нерастворимые (S<0,01 г)
Следует помнить! Нет абсолютно нерастворимых веществ (серебро, погружённое в воду, оказывает бактерицидное действие)
5. Растворимость солей, кислот, оснований характеризуют по ТР. Некоторые соли водой разлагаются в следствие гидролиза, такие соли существуют только в сухом виде или в неводных растворах.
6. Влияние различных факторов на растворимость:
1) Природа растворителя и растворимого вещества – подобное растворяется в подобном.
2) Температура – как правило, растворение твёрдых веществ при повышении температуры увеличивается.
Однако, NaCl – при увеличении температуры почти не меняется; Ca(OH)2 – уменьшается; Na2SO4 x 10H2O – сначала увеличивается, затем уменьшается.
Растворимость жидкостей в жидкостях с ростом температуры увеличивается, а газов в жидкостях – уменьшается.
Зависимость растворимости веществ от температуры связана с тепловым эффектом растворения: если процесс растворения эндотермический, то, согласно пр. Ле-Шателье, повышение температуры благоприятствует растворению.
3) Давление (влияет только на растворимость газов) – при постоянной температуре растворимость газа прямо пропорциональна его парциальному давлению (закон Генри).
Вопросы.
1. Способность одного вещества растворяться в другом – это ________________.
2. Выберите вещества хорошо растворимые в воде:
а) АlРО4 б). NаОН в). АgNO3 г). CuS
3. Выберите вещества нерастворимые в воде:
а). НNО3 б). Cu(ОН)2 в). Zn(NO3)2 г). HgS
4. Если 50 г хлорида калия растворить в 200 г воды, то массовая доля хлорида калия в полученном растворе (%)
5. В растворе соли массой 150 г с массовой долей вещества10% масса соли равна:
а) 15 г б) 10 г в) 7,5 г г) 5 г